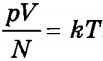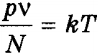Температура как мера кинетической энергии.
Из основного уравнения молекулярно-кинетической теории, записанного в форме
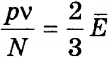
и определения абсолютной температуры согласно
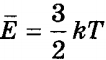
Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Из полученного результата однозначно следует, что абсолютная температура есть мера средней кинетической энергии движения молекул.
Соотношение между температурой и кинетической энергией справедливо не только для разреженных газов (идеальных газов), но также для любых тел, подчиняющихся законам механики Ньютона. Оно справедливо и для жидкостей, и для твердых тел, атомы которых колеблются около положения равновесия.
Из формулы 
Из формулы р = nkT очевидно, что при одинаковых давлениях и температурах концентрация молекул у всех газов одинакова.
Отсюда следует известный закон Авогадро: в равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Средняя скорость теплового движения молекул может быть также выражена через абсолютную температуру, если в формуле:
заменить 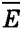
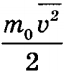
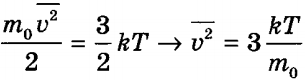
Квадратный корень из этой величины называется средней квадратичной скоростью:
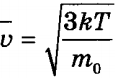
Температура как мера средней кинетической энергии молекул
Представляем формулу основного уравнения молекулярно-кинетической теории (МКТ) газов:
(где n = N V – это концентрация частиц в газе, N – это число частиц, V – это объем газа, 〈 E 〉 – это средняя кинетическая энергия поступательного движения молекул газа, » open=» υ k v – это средняя квадратичная скорость, m 0 – это масса молекулы) связывает давление – макропараметр, достаточно просто измеряющийся с такими микропараметрами, как средняя энергия движения отдельной молекулы (или в другом выражении), как масса частицы и ее скорость. Но находя только лишь давление, нельзя установить кинетические энергии частиц отдельно от концентрации. Поэтому для нахождения в полном объеме микропараметров нужно знать еще какую-то физическую величину, связанную с кинетической энергией частиц, составляющих газ. За данную величину можно взять термодинамическую температуру.
Газовая температура
Для определения газовой температуры нужно вспомнить важное свойство, которое сообщает о том, что в условиях равновесия средняя кинетическая энергия молекул в смеси газов одинаковая для различных компонентов данной смеси. Из данного свойства следует то, что если 2 газа в различных сосудах находятся в тепловом равновесии, тогда средние кинетические энергии молекул данных газов одинаковые. Это свойство мы и будем использовать. К тому же в ходе экспериментов доказано, что для любых газов (при неограниченном числе), которые находятся в состоянии теплового равновесия, справедливо следующее выражение:
С учетом вышесказанного, используем ( 1 ) и ( 2 ) и получаем:
Из уравнения ( 3 ) следует, что величина θ , которой мы обозначили температуру, вычисляется в Д ж , в чем измеряется также и кинетическая энергия. В лабораторных работах температура в системе измерения вычисляется в кельвинах. Поэтому введем коэффициент, который уберет данное противоречие. Он обозначается k , измеряется в Д ж К и равняется 1 , 38 · 10 — 23 . Данный коэффициент называется постоянной Больцмана. Таким образом:
θ = k T ( 4 ) , где T – это термодинамическая температура в кельвинах.
Связь термодинамической температуры и средней кинетической энергией теплового движения молекул газа выражается формулой:
» open=» E = 3 2 k T ( 5 ) .
Из уравнения ( 5 ) видно, что средняя кинетическая энергия теплового движения молекул прямо пропорциональна температуре газа. Температура является абсолютной величиной. Физический смысл температуры заключается в том, что она, с одной стороны, определяется средней кинетической энергией, которая приходится на 1 молекулу. А с другой стороны, температура – это характеристика системы в целом. Таким образом, уравнение ( 5 ) показывает связь параметров макромира с параметрами микромира.
Известно, что температура – это мера средней кинетической энергии молекул.
Можно установить температуру системы, а затем рассчитать энергию молекул.
Температура как мера средней кинетической энергии уравнение
«Физика — 10 класс»
Вместо температуры Θ, выражаемой в энергетических единицах, введём температуру, выражаемую в привычных для нас градусах.
Будем считать величину Θ прямо пропорциональной температуре Т, измеряемой в градусах:
где k — коэффициент пропорциональности.
>Определяемая равенством (9.12) температура называется абсолютной.
Такое название, как мы сейчас увидим, имеет достаточные основания. Учитывая определение (9.12), получим
По этой формуле вводится температурная шкала (в градусах), не зависящая от вещества, используемого для измерения температуры.
Температура, определяемая формулой (9.13), очевидно, не может быть отрицательной, так как все величины, стоящие в левой части этой формулы, заведомо положительны. Следовательно, наименьшим возможным значением температуры Т является значение Т = 0, если давление р или объём V равны нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Это самая низкая температура в природе, та «наибольшая или последняя степень холода», существование которой предсказывал Ломоносов.
Английский учёный У. Томсон (лорд Кельвин) (1824—1907) ввёл абсолютную шкалу температур. Нулевая температура по абсолютной шкале (её называют также шкалой Кельвина) соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия.
Единица абсолютной температуры в СИ называется кельвином (обозначается буквой К).
Постоянная Больцмана.
Определим коэффициент k в формуле (9.13) так, чтобы изменение температуры на один кельвин (1 К) было равно изменению температуры на один градус по шкале Цельсия (1 °С).
Мы знаем значения величины Θ при 0 °С и 100 °С (см. формулы (9.9) и (9.11)). Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле (9.12)
Θ100 — Θ0 = k • 100 K = (5,14 — 3,76) • 10 -21 Дж.
k = 1,38 • 10 -23 Дж/К (9.14)
называется постоянной Больцмана в честь Л. Больцмана, одного из основателей молекулярно-кинетической теории газов.
Постоянная Больцмана связывает температуру Θ в энергетических единицах с температурой Т в кельвинах.
Это одна из наиболее важных постоянных в молекулярно-кинетической теории.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0 °С. Так как при 0 °С kT1 = 3,76 • 10 -21 Дж, то
Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:
Т (К) = (f + 273) (°С). (9.15)
Изменение абсолютной температуры ΔТ равно изменению температуры по шкале Цельсия Δt: ΔТ(К) = Δt (°С).
На рисунке 9.5 для сравнения изображены абсолютная шкала и шкала Цельсия. Абсолютному нулю соответствует температура t = -273 °С.
В США используется шкала Фаренгейта. Точка замерзания воды по этой шкале 32 °F, а точка кипения 212 °Е Пересчёт температуры из шкалы Фаренгейта в шкалу Цельсия производится по формуле t(°C) = 5/9 (t(°F) — 32).
Отметим важнейший факт: абсолютный нуль температуры недостижим!
Температура — мера средней кинетической энергии молекул.
Из основного уравнения молекулярно-кинетической теории (9.8) и определения температуры (9.13) вытекает важнейшее следствие:
абсолютная температура есть мера средней кинетической энергии движения молекул.
Из уравнений (9.7) и (9.13) следует, что 
Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре.
Чем выше температура, тем быстрее движутся молекулы. Таким образом, выдвинутая ранее догадка о связи температуры со средней скоростью молекул получила надёжное обоснование. Соотношение (9.16) между температурой и средней кинетической энергией поступательного движения молекул установлено для идеальных газов.
Однако оно оказывается справедливым для любых веществ, у которых движение атомов или молекул подчиняется законам механики Ньютона. Оно верно для жидкостей, а также и для твёрдых тел, где атомы могут лишь колебаться возле положений равновесия в узлах кристаллической решётки.
При приближении температуры к абсолютному нулю энергия теплового движения молекул приближается к нулю, т. е. прекращается поступательное тепловое движение молекул.
Зависимость давления газа от концентрации его молекул и температуры. Учитывая, что 
Из формулы (9.17) вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же.
Отсюда следует закон Авогадро, известный вам из курса химии.
В равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/srednjaja-kineticheskaja-energija-molekul/
http://class-fizika.ru/10_a193.html