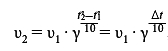Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Лекция по Химии на тему «Тепловой эффект химической реакции»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
УЧЕБНАЯ ДИСЦИПЛИНА: Химия
Тема: Тепловой эффект химической реакции. Термохимические уравнения
Ознакомьтесь с лекционным материалом.
Ответить на вопросы, решить задачи (см. приложение №1).
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется затратить энергию. Когда химическая связь образуется, энергия выделяется.
Атомы не соединялись бы между собой, если бы это не вело к «выигрышу» (то есть высвобождению) энергии. Этот выигрыш может быть большим или малым, но он обязательно есть при образовании молекул из атомов.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Когда в результате химической реакции при образовании новых связей выделяется энергии больше, чем потребовалось для разрушения «старых» связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты (рис. 1а). Реакция даже может идти со взрывом — так много энергии заключено в этом превращении. Такие реакции называются экзотермическими от латинского «экзо» — наружу (имея в виду выделяющуюся энергию).
В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются эндотермическими (от латинского «эндо» — внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании (рис. 1б).

Рис. 1а. Уравнение реакции горения метана.

Рис. 1б. Уравнение реакции между углем и водой при высокой температуре.
Рис. 1а,б. Изображение химических реакций при помощи моделей молекул:
а) экзотермическая реакция, б) эндотермическая реакция. Модели наглядно показывают, как при неизменном числе атомов между ними разрушаются старые и возникают новые химические связи.
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного моля реагента или (реже) для моля продукта реакции. Такая величина называется тепловым эффектом реакции . Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое — на 1 моль использованного кислорода, а второе — на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) — твердое, кристаллическое вещество, (водн) — растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение. Например, в реакции сгорания водорода первоначально образуется вода в виде пара (газообразное состояние), при конденсации которого может выделиться еще некоторое количество энергии. Следовательно, для образования воды в виде жидкости измеренный тепловой эффект реакции будет несколько больше, чем для образования только пара, поскольку при конденсации пара выделится еще порция теплоты.
Используется также частный случай теплового эффекта реакции – теплота сгорания . Из самого названия видно, что теплота сгорания служит для характеристики вещества, применяемого в качестве топлива. Теплоту сгорания относят к 1 молю вещества, являющегося топливом (восстановителем в реакции окисления), например:
теплота сгорания ацетилена
Запасенную в молекулах энергию (Е) можно отложить на энергетической шкале. В этом случае тепловой эффект реакции (ΔЕ) можно показать графически (рис. 2).
Рис. 2. Графическое изображение теплового эффекта (Q = ΔЕ):
а ) экзотермической реакции горения водорода;
б ) эндотермической реакции разложения воды под действием электрического тока. Координату реакции (горизонтальную ось графика) можно рассматривать, например, как степень превращения веществ (100% — полное превращение исходных веществ).
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (рис.3).
Рис. 3. Самая мощная в мире российская ракета «Энергия» перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах — водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект — это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплоты сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,18 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: «калорийность 320 ккал/100 г».
Уравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, называются термохимическими уравнениями.
Особенность термохимических уравнений заключается в том, что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую. С обычными уравнениями химических реакций так поступать, как правило, нельзя.
Допускается также почленное сложение и вычитание термохимических уравнений. Это бывает нужно для определения тепловых эффектов реакций, которые трудно или невозможно измерить в опыте.
Пример. В лаборатории чрезвычайно трудно осуществить «в чистом виде» реакцию получения метана СH4 путем прямого соединения углерода с водородом:
Но можно многое узнать об этой реакции с помощью вычислений. Например, выяснить, будет эта реакция экзо- или эндотермической, и даже количественно рассчитать величину теплового эффекта.
Известны тепловые эффекты реакций горения метана, углерода и водорода (эти реакции идут легко):
Вычтем два последних уравнения (б) и (в) из уравнения (а) Левые части уравнений будем вычитать из левой, правые — из правой. При этом сократятся все молекулы O2, СO2 и H2О. Получим:
СH4(г) — С(тв) — 2 H2(г) = (890 — 394 — 572) кДж = -76 кДж
Это уравнение выглядит несколько непривычно. Умножим обе части уравнения на (-1) и перенесем CH4 в правую часть с обратным знаком. Получим нужное нам уравнение образования метана из угля и водорода:
Итак, наши расчеты показали, что тепловой эффект образования метана из углерода и водорода составляет 76 кДж (на моль метана), причем этот процесс должен быть экзотермическим (энергия в этой реакции будет выделяться).
Почленно складывать, вычитать и сокращать в термохимических уравнениях можно только вещества, находящиеся в одинаковых агрегатных состояниях, иначе мы ошибемся в определении теплового эффекта на величину теплоты перехода из одного агрегатного состояния в другое.

Это означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества. Например:
2 H2(г) + O2(г) 2 H2О(ж) + 572 кДж (горение водорода в кислороде)
2 H2О(ж) + 572 кДж = 2 H2(г) + O2(г) (разложение воды электрическим током)
Закон Лавуазье–Лапласа является следствием закона сохранения энергии.

Это означает, что общий тепловой эффект ряда последовательных реакций будет таким же, как и у любого другого ряда реакций, если в начале и в конце этих рядов одни и те же исходные и конечные вещества.
Рассмотрим пример, поясняющий закон Гесса. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Один путь включает только одну стадию, а во второй — две стадии, с промежуточным получением кислой соли NaHSO4:
Первый путь (одностадийный):
Второй путь (двухстадийный):
а) NaOH (водн) + H2SO4 (водн) = NaНSO4 (водн) + H2O (ж) + 34,9 кДж
б) NaHSO4 (водн) + NaOH (водн) = Na2SO4 (водн) + H2O (ж) + 78,7 кДж
Согласно закону Гесса, тепловой эффект получения сульфата натрия из NaOH не зависит от способа получения. Действительно, складывая тепловые эффекты двух последовательных реакций во втором способе мы получаем тот же тепловой эффект, что и для первого способа: 34,9 кДж + 78,7 кДж = 113,6 кДж 1 . Кстати, почленное сложение двух последних уравнений дает первое уравнение реакции.
Именно эти два основных закона термохимии придают термохимическим уравнениям некоторое сходство с математическими, когда в уравнениях реакций можно переносить члены из одной части в другую, почленно складывать, вычитать и сокращать формулы химических соединений. При этом необходимо учитывать коэффициенты в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии.
http://prosto-o-slognom.ru/chimia_primery/005-termochimicheskie_uravneniya.html
http://infourok.ru/lekciya-po-himii-na-temu-teplovoj-effekt-himicheskoj-reakcii-5546611.html