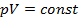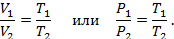Термодинамическое рабочее тело, параметры состояния. Уравнение состояния.
Термодинамическое рабочее тело – тело, посредством которого тепловая энергия превращается в механическую и наоборот. В тепловых двигателях и машинах термодинамическим рабочим телом (ТРТ) является, как правило, газ или пар, что обусловлено тем, что газы, в отличие от жидких и твёрдых тел, могут значительно изменять свой объём при изменении температуры. В реальных условиях процесс превращения теплоты в работу достаточно сложен, поэтому в рабочее тело вводят ряд упрощающих его рассмотрение допущений и используют понятие идеального газа, отвечающего следующим условиям:
- Между молекулами идеального газа отсутствуют силы взаимодействия.
- Молекулы идеального газа не имеют геометрических размеров, т.е. объём молекул бесконечно мал по сравнению с межмолекулярным пространством.
- Столкновения молекул идеального газа между собой и с элементами ТС абсолютно упругие и происходят без потерь энергии на деформацию ТС и самих молекул.
Величины, характеризующие состояние ТРТ, называют термодинамическими параметрами состояния. Основными параметрами состояния ТРТ являются параметры, которые могут быть непосредственно измерены. Применительно к идеальному газу к ним относятся:
— абсолютное давление, P, Па;
— удельный объём, v, м 3 /кг (или плотность, ρ, кг/м 3 ).
Абсолютное давление в зависимости от давления в рабочем объёме может быть больше или меньше барометрического, но не может быть меньше 0, т.е. меньше значения, соответствующего абсолютному вакууму. Следует помнить, что термодинамическим параметром состояния является абсолютное, а не манометрическое или избыточное давление.
Температура. Согласно молекулярно-кинетической теории, между средней скоростью молекул газа и абсолютной температурой существует прямо-пропорциональная зависимость:
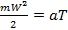
где a – коэффициент, одинаковый для всех газов. Отдельные молекулы могут иметь скорости, отличные от этого значения – как больше, так и меньше. Следует помнить, что понятие абсолютной температуры относится к среднестатистической скорости молекул, осреднённой по всей массе ТРТ.
Очевидно, что нуль абсолютной температуры соответствует нулевой средней скорости молекул, т.е. полному прекращению кинетического движения молекул, что маловероятно и труднодостижимо.
Следует отметить, что термодинамическим параметром состояния является абсолютная температура, измеренная по абсолютной температурной шкале Кельвина, а не по какой-либо иной.
Удельный объём. Если V – объём ТРТ, а G – его масса, то удельным объёмом называют объём единицы массы вещества: 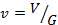
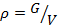
Величины p, v, T являются основными параметрами состояния, определяющими состояние тела, а их изменение непосредственно связано с тепловыми и механическими превращениями ТРТ. Параметры состояния взаимосвязаны и в общем случае при изменении одного из них изменяются и два других.
Уравнение состояния. Общая функциональная связь приведённых выше параметров в виде уравнения
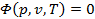 называется термодинамическим уравнением состояния вещества. Геометрически уравнение состояния можно трактовать как уравнение поверхности, которую называют термодинамической поверхностью, и любое состояние ТРТ изображается в виде точки на этой поверхности (рис.1). → → → → → → → → Для описания уравнения состояния, характерного для идеального газа, воспользуемся известными из курса физики (точнее, из молекулярно-кинетической теории газов) законами Бойля-Мариотта и Гей-Люссака. называется термодинамическим уравнением состояния вещества. Геометрически уравнение состояния можно трактовать как уравнение поверхности, которую называют термодинамической поверхностью, и любое состояние ТРТ изображается в виде точки на этой поверхности (рис.1). → → → → → → → → Для описания уравнения состояния, характерного для идеального газа, воспользуемся известными из курса физики (точнее, из молекулярно-кинетической теории газов) законами Бойля-Мариотта и Гей-Люссака. | 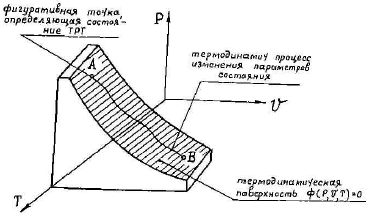 |
Согласно закону Бойля-Мариотта, произведение давления газа на его удельный объём при постоянной температуре есть величина постоянная:
Согласно закону Гей-Люссака, объём газа при постоянном давлении изменяется прямо-пропорционально температуре, а, в свою очередь, давление газа при постоянном объёме также изменяется прямо-пропорционально температуре:
Объединением этих законов получено уравнение состояния газа, согласно которому произведение абсолютного давления на удельный объём прямо-пропорционально абсолютной температуре:
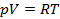
где R – постоянная, зависящая от свойств газа. Для G кг газа – pv=GRT; для моля газа – pv=μRT, где μ – вес моля газа. Поскольку μR=Rун=8480, легко найти газовую постоянную для любого газа: H2 – 8480:2=4240; O2 – 8480:32=265; CO2 – 8480:44=189; воздух – 8480:29=287.
Эти уравнения справедливы только для идеального газа и только для его равновесного состояния.
Основные параметры состояния рабочего тела.
Термодинамика. Основные понятия и определения. Теплота, работа, внутренняя энергия.
Термодинамика – это наука о свойствах энергии в различных ее видах, а также о закономерностях перехода энергии от одних тел к другим и из одного вида в другой.
Фундаментальными понятиями термодинамики являются теплота и работа.
Совокупность тел, участвующих в процессах передачи энергии, рассматриваемая в энергетическом взаимодействии с внешней средой, называется термодинамической системой.
Энергия, запасом которой обладает всякое тело, в общем случае состоит из:
· внешней энергии, присущей всему телу в целом, и
· внутренней энергии, присущей самим молекулам, из которых состоит тело.
Суммарный запас кинетической и потенциальной энергий всех молекул тела образует его внутреннюю или тепловую энергию, обозначаемую в дальнейшем буквой U.
У газов размеры молекул исчезающе малы по сравнению с расстоянием между ними и силы взаимного притяжения ничтожны (идеальные газы).
Пары в термодинамике относятся к реальным газам и их свойства изучаются с учетом сил взаимного притяжения молекул.
Основные параметры состояния рабочего тела.
Удельный объем газа – объем, занимаемый 1 кг данного газа. Так, если масса всего газа равна М кг, а полный объем V м 3 , то удельный объем его составляет

Величина, обратная удельному объему, т.е. масса газа, заключенная в 1м 3 его, называется плотностью 
Абсолютное давление газа является средним результатом ударов молекул о поверхность, ограничивающую объем, занимаемый газом. Оно представляет собой силу, отнесенную к единице площади этой поверхности и действующую со стороны газа в направлении, нормальном по отношению к ней.
Давление земной атмосферы зависит от высоты и метеорологических условий в данный момент. В среднем над уровнем моря оно равно 760 мм.рт.ст. Эта величина называется нормальным давлением.
Абсолютная температура газа является мерой интенсивности хаотического движения его молекул и измеряется в градусах. 
где m – масса одной молекулы;
w – средняя квадратичная скорость поступательного движения молекул;
Термическое уравнение состояния рабочего тела
Наиболее естественным является такое состояние газа, при котором удельный объем, давление и температура, а вместе с ними и все остальные параметры, имеют одинаковое значение во всех точках объема, занимаемого газом.
Такое термодинамическое состояние газа называется равновесным.
Всякий реальный процесс перехода газа из одного состояния в другое неизбежно связан с нарушением термодинамического равновесия, и каждое из промежуточных состояний его является неравновесным.
Каждое из промежуточных состояний газа характеризуется конкретными значениями параметров p, 

которое называется термическим уравнением состояния.
Работа изменения объема рабочего тела.
Всякое изменение объема газа сопровождается совершением работы. При расширении газ совершает работу против внешних сил, при сжатии внешние силы совершают работу над газом.
Элементарная работа газа на участке a—b:

где F – площадь поршня и, следовательно,
pF – сила, действующая на поршень.
С другой стороны, 

Суммарная работа, совершаемая газом в процессе 1–2, составит: 
Работа является функцией процесса и при одинаковых начальных и конечных состояниях газа может быть различной в зависимости от того, по какому пути совершается этот процесс.
Отсюда вытекает, что работа не является функцией состояния.
Если по завершении процесса в двигателе поршень возвращается в исходное положение, а газ – в исходное состояние, то в цилиндре осуществляется термодинамический цикл, изображаемый в 
Смеси идеальных газов.
Для всей смеси в целом основное уравнение кинетической теории газов

где 


Учитывая, что все компоненты находятся при одной и той же температуре, из уравнения Больцмана имеем: 
откуда следует закон Дальтона:

Из закона Бойля – Мариотта: 
где Vк – приведенный объем, который занял бы компонент, находясь отдельно от других компонентов при давлении и температуре смеси.
Последнее выражение можно записать в таком виде 
Составляя такие выражения для каждого из компонентов, а затем складывая их левые и правые части, получаем


Газовая смесь характеризуется своим мольным (Zк), объемным (rк) или массовым составом (mк).
Для пересчета объемного состава в массовый и наоборот введено понятие о средней (кажущейся) молекулярной массе смеси mсм .
Общая масса смеси идеальных газов


Для однородного газа 

где z1, z2 … – мольные доли компонентов смеси.
Также, среднюю молекулярную массу смеси можно выразить через молекулярные массы компонентов и их объемные доли:
Пересчет объемного состава на массовый и наоборот производится на основе следующих соотношений между объемными и массовыми долями компонентов:


а для каждого из компонентов может быть записано так:
Учитывая, что 
получаем 



Изобарный процесс


откуда видно, что изобара нагревания направлена слева направо, а изобара охлаждения – справа налево.
Аналитическое выражения первого закона термодинамики для изобарного процесса:

Согласно определению теплоемкости

поэтому 

Величина работы изменения объема газа в изобарном процессе
Изотермический процесс
Из закона Бойля – Мариотта
следует, что линия изотермы представляет собой гиперболу.
Поскольку в изотермическом процессе

т.е. внутренняя энергия не изменяется, аналитическое выражение первого закона термодинамики принимает вид
Адиабатный процесс
Первый закон термодинамики
Из этих уравнений имеем

или 

или 
а) Связь между р и J
б) Связь между Т и J


в) Связь между р и Т

окончательно
Аналитическое выражение первого закона термодинамики:


работа адиабатного процесса
Поскольку 
Политропные процессы
Политропными называются процессы, в которых теплоемкость имеет любое, но постоянное на протяжении всего процесса значение.
Уравнение политропы выводится на основе уравнений 1 закона термодинамики и теплоёмкости:

где n – показатель политропы.
Все соотношения, вытекающие из уравнения политропы, аналогичны соотношениям, вытекающим из уравнения адиабаты.
Согласно первому закону термодинамики для политропного процесса



для изохорного процесса, когда 
для изобарного процесса, когда n = 0, c = cp;
для изотермического процесса, когда n = 1, 
для адиабатного процесса, когда n = k, c = 0.
Цикл Карно и его свойства.
В цикле, предложенном С. Карно, теплота подводится и отводится по изотермам при температурах горячего источника теплоты и холодного теплоприемника.
Термический к.п.д. прямого цикла Карно

где 
для адиабат 2-3 



Окончательно 
Термический к.п.д. прямого цикла Карно тем больше, чем выше температура горячего источника теплоты и чем ниже температура холодного теплоприемника.
В обратном цикле Карно холодильный коэффициент
Водяной пар. Основные понятия и определения.
Газообразные тела (с примесью одноименной жидкости в виде взвешенных мелкодисперсных частиц или без нее) принято называть парами.
Все пары являются реальными газами и подчиняются всем присущим этим газам закономерностям, в частности закономерностям фазовых переходов.
Образование пара из одноименной жидкости происходит посредством ее испарения или кипения. Между этими двумя процессами существует принципиальное различие.
Испарение жидкости может происходить лишь с открытой поверхности и при любой температуре.
С повышением температуры жидкости процесс испарения ускоряется, т.к. средняя скорость движения молекул возрастает.
Кипение жидкости может происходить и при отсутствии открытой поверхности. Сущность его состоит в том, что образование пара происходит в основном в объеме самой жидкости.
В сосуде одновременно происходят противоположные процессы испарения жидкости и конденсации пара.

С повышением парциального давления пара скорость испарения жидкости уменьшается, а скорость обратной конденсации пара возрастает и в конечном итоге наступает момент, когда скорости обоих процессов становятся одинаковыми, а Рп устанавливается одинаковым.
Пар какого-либо вещества, находящийся в динамическом равновесии с одноименной жидкостью, называется насыщенным.
Температура и давление насыщенного пара взаимосвязаны и каждой температуре соответствует вполне определенное давление насыщения.
По мере роста температуры паровоздушной смеси содержание воздуха в ней уменьшается за счет вытеснения его паром через обратный клапан. Поэтому наступает момент, когда из сосуда удаляются последние остатки воздуха и в верхней его части остается один лишь насыщенный пар.
Этот момент отмечается тем, что давление насыщенного пара становится равным давлению окружающей среды, под которым все время находилась жидкость, а потому становится возможным кипение жидкости.
Температура, при которой давление насыщения становится равным внешнему давлению на жидкость, называется температурой кипения; она является функцией внешнего давления и с увеличением его возрастает.


Пар какого-либо вещества, не содержащий в себе одноименной жидкости и имеющий температуру кипения при данном давлении, называется сухим насыщенным.
Пар какого-либо вещества, температура, которого превышает температуру кипения при данном давлении, называется перегретым.
Состояние перегретого пара определяется значениями двух независимых параметров, в качестве которых наиболее часто используются давление и температура.
С повышением перегрева пар по своим свойствам приближается к идеальному газу.
При изобарном отводе теплоты от сухого насыщенного пара температура его не изменяется, а вместо этого начинается конденсация пара, и по всему его объему образуются мельчайшие капельки жидкости.
Насыщенный пар какого-либо вещества, содержащий в себе одноименную жидкость в виде взвешенных мелкодисперсных частиц, называется влажным насыщенным паром.
Представив себе влажный пар как механическую смесь сухого насыщенного пара и равномерно распределенной в нем жидкости, можно определить степень сухости х влажного пара как массовую долю содержащегося в нем сухого насыщенного пара.

Таким образом, состояние влажного пара определяется значениями двух независимых параметров, – давления (или температуры) и степени сухости.
Влажный пар и его параметры
Объем влажного пара можно представить как сумму объемов двух компонентов.
где х – степень сухости пара.
Первое слагаемое представляет собой объем жидкости, содержащейся в 1 кг влажного пара, а второе – объем содержащегося в нем сухого насыщенного пара.
Для превращения 1 кг кипящей воды в сухой насыщенный пар при постоянном давленииему необходимо сообщить количество теплоты, называемое теплотой парообразования:


С помощью теплоты парообразования r энтальпия влажного пара определяется следующим образом.
В процессе парообразования при Р=const
где х – степень сухости влажного пара.
ix
Энтропия влажного пара:
а для данного случая
sx 
где Тн – температура кипения при заданном постоянном давлении.
Для сухого насыщенного пара х=1, поэтому
Формула (*) может быть записана так:
sx 
Теплофикационные циклы.
Основной тепловой потерей паросиловой установки, работающей по циклу Ренкина, является теплота парообразования отработавшего пара, отдаваемая охлаждающей воде конденсатора и нигде не используемая.
В Ts–диаграмме эта потеря изображается площадью прямоугольника 2-3-8-10-2.



Из диаграммы видно, что работа 1 кгпара (и соответственно выработка механической или электрической энергии) будет меньше, чем при расширении до предельно низкого давления, и расход пара на получение того же количества электроэнергии будет больше.
Зато теплота парообразования отработавшего пара не теряется, а полезно используется.
Для оценки экономичности такого рода установок вводится понятие о степени использования тепла, под которой понимается отношение всего использованного (в виде механической и тепловой энергии) тепла к количеству тепла, затраченному на образование пара:
В цикле Ренкина степень использования тепла есть не что иное, как термический к. п. д. цикла. Следовательно, для конденсационных установок степень использования тепла может достичь лишь 52-53%.
В теоретическом цикле комбинированной выработки электроэнергии и тепла (иначе говоря – выработки электроэнергии на базе теплового потребления) степень использования тепла составляет 100% (в действительности из-за необратимости процессов расширения к. п. д. теплофикационных установок достигает 70-75%).

Паросиловые установки для комбинированной выработки электрической и тепловой энергий называются теплофикационными электростанциями или теплоэлектроцентралями (ТЭЦ).





Продукты сгорания топлива расширяются до атмосферного давления в газовой турбине 3, а затем, охладившись в противоточном регенеративном подогревателе 4 до температуры 40-50 °С, удаляются в атмосферу.

Термодинамический цикл описанной парогазовой установки представлен в Ts-диаграмме.
Он состоит из двух циклов – газового цикла (1-2-3-4-1) и парового цикла (5-6-7-8-9-10-5), причем весь процесс подогрева питательной воды по линии 8-9 осуществляется за счет регенерации тепла уходящих газов газотурбинной установки путем их охлаждения по линии 4-1.
Теплопередача. Основные понятия и определения.
Рассмотрим теплопередачу через однородную и многослойную плоские стенки.
Теплопередача включает в себя
— теплоотдачу от более горячей жидкости к стенке,
— теплопроводность в стенке,
— теплоотдачу от стенки к более холодной подвижной среде.
Заданы толщина δ плоской однородной стенки, коэффициенты теплопроводности стенки λ, температуры окружающей среды tж1 и tж2, а также коэффициенты теплоотдачи α1 и α2;
будем считать, что величины tж1, tж2, α1 и α2 постоянны и не меняются вдоль поверхности.
При заданных условиях необходимо найти тепловой поток от горячей жидкости к холодной и температуры на поверхностях стенки.
Плотность теплового потока от горячей жидкости к стенке
При стационарном тепловом режиме тот же тепловой поток пройдет теплопроводностью через твердую стенку
Тот же тепловой поток передается от второй поверхности стенки к холодной жидкости за счет теплоотдачи
Эти уравнения можно записать в виде системы
Плотность теплового потока, Вт/м 2
Обозначим
Величина k имеет ту же размерность, что и α, и называется коэффициентом теплопередачи.
Коэффициент теплопередачи k характеризует интенсивность передачи теплоты от одной жидкости к другой через разделяющую их стенку и численно равен количеству теплоты, которое передается через единицу поверхности стенки в единицу времени при разности температур между жидкостями в один градус.
Величина, обратная коэффициенту теплопередачи, называется полным термическим сопротивлением теплопередаче.



В случае многослойной стенки нужно учитывать термическое сопротивление каждого слоя:

Плотность теплового потока через многослойную стенку, состоящую из n слоев
Тепловой поток Q, Вт, через поверхность F твердой стенки
Рассмотрим однородную цилиндрическую стенку (трубу) с постоянным коэффициентом теплопроводности λ. Заданы постоянные температуры подвижных сред tж1 и tж2 и постоянные значения коэффициентов теплоотдачи на внутренней и наружной поверхностях труб α1 и α2.
Необходимо найти ql и tc. Будем полагать, что длина трубы велика по сравнению с толщиной стенки. Тогда потерями теплоты с торцов трубы можно пренебречь.
Для стационарного режима теплопередачи можно написать
Представим эти уравнения следующим образом
Обозначим
Величина kl называется линейным коэффициентом теплопередачи; измеряется в Вт/(м·К). Он характеризует интенсивность передачи теплоты от одной подвижной среды к другой через разделяющую их стенку.
Значение kl численно равно количеству теплоты, которое проходит через стенку длиной 1 м в единицу времени от одной среды к другой при разности температур между ними 1 град.
Величина Rl=1/kl, обратная линейному коэффициенту теплопередачи, называется линейным термическим сопротивлением теплопередаче:
здесь Rl измеряется в м·К/Вт.


Основные понятия конвективного теплообмена.
Понятие конвективного теплообмена охватывает процесс теплообмена при движении жидкости или газа. При этом перенос теплоты осуществляется одновременно конвекцией и теплопроводностью.
Если в единицу времени через единицу контрольной поверхности нормально к ней проходит масса жидкости 


Конвекция теплоты всегда сопровождается теплопроводностью, т.к. при движении жидкости или газа происходит соприкосновение отдельных частиц, имеющих различные температуры. В результате конвективный теплообмен описывают уравнением
При расчетах конвективного теплообмена между текущей жидкостью и твёрдой стенкой используют закон Ньютона – Рихмана:
Коэффициент теплоотдачи α зависит от большого количества факторов. В общем случае α является функцией
— формы и размеров тела,
— скорости и температуры жидкости,
— физических параметров жидкости,
Чтобы привести жидкость в движение, к ней необходимо приложить силу. Силы, действующие на какой-либо элемент жидкости, можно разделить на массовые (или объемные) и поверхностные.
Массовыми называют силы, приложенные ко всем частицам жидкости и обусловленные внешними силовыми полями (например, гравитационным или электрическим).
Поверхностные силы возникают вследствие действия окружающей жидкости или твердых тел; они приложены к поверхности контрольного объема жидкости. Такими силами являются силы внешнего давления и силы трения.
Различают свободную и вынужденную конвекцию.
В первом случае жидкость с неоднородным распределением температуры, и, как следствие, с неоднородным распределением плотности, находится в поле земного тяготения. Поэтому в ней может возникнуть свободное гравитационное движение.
Вынужденное движение объема жидкости происходит под действием внешних поверхностных сил, приложенных на его границах, за счет предварительно сообщенной кинетической энергии (например, за счет работы насоса, вентилятора, ветра).
Вынужденное движение в общем случае может сопровождаться свободным движением. Относительное влияние последнего тем больше, чем больше разница температур отдельных частиц среды и чем меньше скорость вынужденного движения.
Основные понятия и законы теплового излучения.
Газы испускают лучи не всех длин волн – селективное (избирательное) излучение
Суммарное излучение с поверхности тела по всем направлениям полусферического пространства и по всем длинам волн спектра называется интегральным излучением (Q).
Интегральный лучистый поток, излучаемый единицей поверхности по всем направлениям, называетсяплотностью интегрального излучения тела, Вт/м 2
где dQ – элементарный поток излучения, испускаемый элементом поверхности dF.
Общее количество энергии излучения, падающей на тело
Величину А называют поглощательной способностью. Она представляет собой отношение поглощенной энергии излучения ко всей энергии излучения, падающей на тело.
Величину R называют отражательной способностью. R есть отношение отраженной энергии излучения ко всей падающей.
Величину D называют пропускательной способностью. D есть отношение прошедшей сквозь тело энергии излучения ко всей энергии излучения, падающей на тело.
Абсолютно черная поверхность — если поверхность поглощает все падающие на нее лучи, т. е. А = 1, R = 0 и D = 0.
Если поверхность отражает полностью все падающие на нее лучи, то такую поверхность называют абсолютно белой.
Если поверхность правильно отражает лучи (т.е. отражение следует законам геометрической оптики), то такую поверхность называют зеркальной.
Если падающий луч при отражении расщепляется на множество лучей, идущих по всевозможным направлениям, то такое отражение называют диффузным.
Интенсивность излучения представляет собой плотность потока излучения тела для длин волн от λ до λ+dλ, отнесенная к рассматриваемому интервалу длин волн dλ.
где Isλ – спектральная интенсивность излучения абсолютно черного тела, Вт/м 3 .
Основной закон поглощения.
Коэффициент поглощения
где k — коэффициент абсорбции, или коэффициент поглощения вещества, 1/м.
Термодинамика. Основные понятия и определения. Теплота, работа, внутренняя энергия.
Термодинамика – это наука о свойствах энергии в различных ее видах, а также о закономерностях перехода энергии от одних тел к другим и из одного вида в другой.
Фундаментальными понятиями термодинамики являются теплота и работа.
Совокупность тел, участвующих в процессах передачи энергии, рассматриваемая в энергетическом взаимодействии с внешней средой, называется термодинамической системой.
Энергия, запасом которой обладает всякое тело, в общем случае состоит из:
· внешней энергии, присущей всему телу в целом, и
· внутренней энергии, присущей самим молекулам, из которых состоит тело.
Суммарный запас кинетической и потенциальной энергий всех молекул тела образует его внутреннюю или тепловую энергию, обозначаемую в дальнейшем буквой U.
У газов размеры молекул исчезающе малы по сравнению с расстоянием между ними и силы взаимного притяжения ничтожны (идеальные газы).
Пары в термодинамике относятся к реальным газам и их свойства изучаются с учетом сил взаимного притяжения молекул.
Основные параметры состояния рабочего тела.
Удельный объем газа – объем, занимаемый 1 кг данного газа. Так, если масса всего газа равна М кг, а полный объем V м 3 , то удельный объем его составляет

Величина, обратная удельному объему, т.е. масса газа, заключенная в 1м 3 его, называется плотностью 
Абсолютное давление газа является средним результатом ударов молекул о поверхность, ограничивающую объем, занимаемый газом. Оно представляет собой силу, отнесенную к единице площади этой поверхности и действующую со стороны газа в направлении, нормальном по отношению к не
Техническая термодинамика. Основные понятия и определения
Техническая термодинамика. Основные понятия и определения.
Предмет и методы технической термодинамики. Понятия термодинамической системы и рабочего тела. Основные параметры состояния, уравнение состояния идеального газа. Теплоемкость.
Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепло — и парогенераторов, тепловых машин, аппаратов и устройств.
Техническая термодинамика является одним из разделов общей термодинамики, в который, кроме технической, входят физическая и химическая термодинамика.
Физическая термодинамика – изучение процессов превращения энергии в твердых, жидких и газообразных телах, а также устанавливает общие математические зависимости между термодинамическими параметрами.
Химическая термодинамика – изучает взаимосвязь между химическими и тепловыми процессами прежде всего применительно к состоянию химического равновесия различных компонентов в реагирующих средах. Техническая термодинамика – рассматривает закономерности взаимного превращения тепловой им механической энергии, устанавливает взаимосвязи между тепловыми, механическими и химическими процессами, которые происходят в тепловых и холодильных установках, и изучает процессы, происходящие в газах и парах, которые являются основными рабочими телами в этих установках.
Одной из основных задач технической термодинамики является изыскание наиболее оптимальных способов и условий превращения тепловой энергии в механическую, и наоборот.
В технической термодинамике могут использоваться два метода изучения процессов взаимного превращения теплоты и механической работы.
1. Феноменологический – рассматривает все процессы с макроскопических позиций, не вникая в закономерности поведения носителей энергии рабочего тела.
2. Статистический метод – изучаются закономерности молекулярных и внутри молекулярных процессов.
В технической термодинамике основным методом является феноменологический или макрофизический метод.
Предметом анализа в технической термодинамике прежде всего является рабочее тело, в качестве которого чаще всего используется газы и пары. Это объясняется тем, что газы и пары обладают значительно большим коэффициентом теплового расширения, чем жидкости и твердые тела.
В термодинамике используются два понятия о газе.
Газы, в которых можно пренебречь размерами молекул и силами взаимодействия между ними, называются идеальными газами (сами молекулы принимаются за материальные точки); и наоборот, газы, в которых нельзя пренебречь размерами молекул и силами взаимодействия между ними, называются реальными газами.
Многие газы, которые используются в тепловых двигателях и холодильных машинах в качестве рабочих тел, можно считать идеальными газами, например, продукты сгорания углеводородных топлив (смеси газов), которые являются рабочим телом во всех тепловых двигателях.
Основным реальным газом, который широко используется в тепловых двигателях, является водяной пар.
При анализе термодинамических процессов используется понятие термодинамической системы. Термодинамическая система – совокупность тел, которые находятся во взаимодействии как между собой, так и с окружающей средой (цилиндр с размещенным в нем поршнем). Функционирование термодинамической системы осуществляется за счет изменения параметров рабочего тела. В технической термодинамике эти параметры называются термодинамическими параметрами системы. Так как основными рабочими телами являются газы и пары, то основными термодинамическими параметрами являются давление р, температура Т, удельный объем n (r).
1. Температура – характеризует степень нагретости рабочего тела.
Под температурой газа понимают меру средней кинетической энергии движения молекул газа.
В настоящее время применяют две температурные шкалы: термодинамическую и международную практическую.
Термодинамическая температурная шкала имеет одну воспроизводимую опытным путем постоянную точку – тройную точку воды, которая имеет значение 273,16 К или 0,01 °С (Тройной точкой называется такое состояние вещества, при котором твердая, жидкая и газообразная фаза находятся в равновесии); второй постоянной точкой служит абсолютный нуль температур.
Термодинамическую температурную шкалу называют также абсолютной шкалой.
Т- t = 273,16-0,01=273,15, откуда Т = t +273,15, [К].
Параметром состояния тела является абсолютная температура.
2. Удельный объем v – представляет собой объем единицы массы тела:
Величина, обратная удельному объему представляет собой массу единицы объема и носит название плотности: r=1/u [кг/м3].
3. Давление р – в Международной системе единиц (СИ) давление измеряется единицей Н/м2, которая называется Паскаль (Па) – давление, вызываемое силой 1 ньютон, равномерно распределенной по нормальной к ней поверхности площадью 1 м2.
Состояние однородного рабочего тела однозначно определено, если заданы любые два из указанных выше трех основных параметров. Любой третий параметр является однозначной функцией двух заданных параметров. Т. о. любые из этих трех параметров рабочего тела однозначно связаны между собой термическим уравнением состояния рабочего тела. Оно характеризует термодинамическое состояние вещества, находящегося в равновесии, т. е. когда во всей его массе устанавливается постоянство термодинамических параметров состояния. Равновесное состояние рабочего тела или т/д системы можно изобразить графически в координатах любых двух параметров состояния. Естественно, что в равновесном состоянии не происходит никаких превращений энергии. Когда в рабочем теле или в системе изменяется хотя бы один из основных параметров состояния, то говорят, что тело совершает термодинамический процесс. Т. о. термодинамическим процессом называется изменение состояния термодинамической системы во времени.
Термодинамический процесс, при котором рабочее тело или система проходит непрерывный ряд равновесных состояний, называется равновесным термодинамическим процессом.
Термодинамические процессы могут быть обратимые и необратимые. Обратимым термодинамическим процессом называют процесс, допускающий возвращение рабочего тела в первоначальное состояние без того, чтобы в окружающей среде произошли какие-либо изменения. Невыполнение этого условия делает процесс необратимым.
Также существуют и другие параметры состояния рабочего тела: энтропия s, внутренняя энергия u, энтальпия I (Н).
Так как в тепловых двигателях многие рабочие тела можно считать идеальными газами, то для анализа термодинамических процессов широко используется основные законы идеальных газов.
Основные термодинамические процессы: изохорный, изотермический, изобарный, адиабатный, политропный.
Так, если температура газа не изменяется (Т=const), то давление газа и его удельный объем связаны следующей зависимостью (закон Бойля-Мариотта):

Если давление газа остается постоянным (р=const), то соотношение между удельным объемом газа и его абсолютной температурой подчиняется закону Гей-Люссака:

Для газов, взятых при одинаковых температурах и давлениях, имеет место следующая зависимость, полученная на основе закона Авогадро:
где m — молекулярная масса газа.
Так как 
Величина mv представляет собой объем килограмм-молекулы или киломоля (кмоль) газа.
Так как в 1 м3 газа могут содержаться, в зависимости от параметров его состояния, разные количества газа, принято относить 1 м3 газа к так называемым нормальным условиям, при которых рабочее вещество находится под давлением рн=101325 Па и Тн = 273,15 К (760 мм рт. ст. 
Объем 1 кмоля всех идеальных газов равен 22,4136 м3/кмоль при нормальных условиях.
Плотность газа при нормальных условиях определяется из равенства:
Пользуясь этой формулой, можно найти удельный объем любого газа при нормальных условиях:
Характеристическое уравнение идеального газа или уравнение состояния связывает между собой основные параметры состояния — давление, объем и температуру — и может быть представлено следующими уравнениями:
где р — давление газа, Па;
V— объем газа, м3;
М — масса газа, кг;
v — удельный объем газа, м3/кг;
Vm — объем 1 кмоля газа, м3/кмоль;
R — газовая постоянная для 1 кг газа, Дж/(кг×К);
mR — универсальная газовая постоянная 1 кмоля газа, Дж/(кмоль×К).
Каждое из этих уравнений отличается от другого лишь тем, что относится к различным массам газа: первое — к М кг, второе — к 1 кг, третье — к 1 кмолю газа.
Численное значение универсальной газовой постоянной легко получить из последнего уравнения при подстановке значений входящих в него величин при нормальных условиях:

Газовую постоянную, отнесенную к 1 кг газа, определяют из уравнения:
где m — масса 1 кмоля газа в кг (численно равная молекулярной массе газа).
Пользуясь характеристическим уравнением для двух различных состояний какого-либо газа, можно получить выражение для определения любого параметра при переходе от одного состояния к другому, если значения остальных параметров известны:


Последнее уравнение часто применяют для «приведения объема к нормальным условиям», т. е. для определения объема, занимаемого газом, при р= 101 325 Па и Т= 273,15 К (р = 760 мм рт. ст. и t=0° С), если объем его при каких-либо значениях р и t известен:

В правой части уравнения все величины взяты при нормальных условиях, в левой — при произвольных значениях давления и температуры.
Уравнение можно переписать следующим образом:


Данное уравнение позволяет найти плотность газа при любых условиях, если значение его для определенных условий известно.
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость mc — кДж/(кмоль×К), массовую теплоемкость с- кДж/(кг×К) и объемную теплоемкость с’ — кДж/(м3×К).
В зависимости от давления и температуры в 1 м3 газа могут содержаться различные количества газа. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м3 его при нормальных условиях (рн= Па (760 мм. рт. ст.) и Тн = 273 К (tн = 0°С).
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
а объемная теплоемкость
Объемная и массовая теплоемкости связаны между собой зависимостью:
где rн — плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то
представляет собой среднюю теплоемкость в пределах t1 — t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса.
Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении.
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
б) массовую — при постоянном объеме (cv и cvm) и постоянном давлении (ср и срт);
в) объемную — при постоянном объеме (c¢v и c¢vm ) и постоянном давлении (с’р и с’рт).
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость:
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл.1).
Приближенные значения мольных теплоемкостей
при постоянном объеме и постоянном давлении (с=const)
http://zdamsam.ru/a18371.html
http://pandia.ru/text/78/379/1652.php