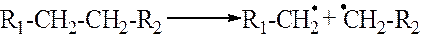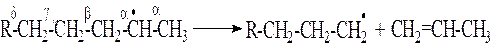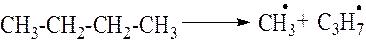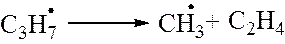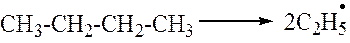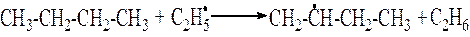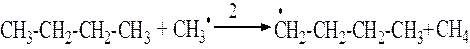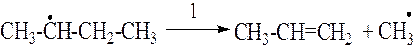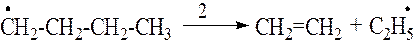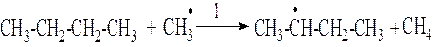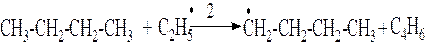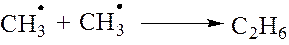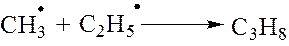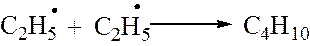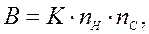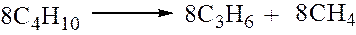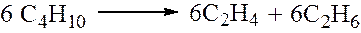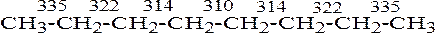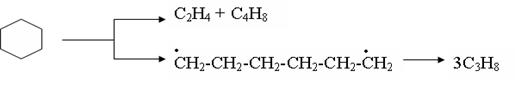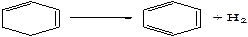Основные положения теории радикального цепного механизма реакции термического распада. Теория Райса. Температура и продолжительность процесса и давления на результаты термического крекинга
Страницы работы
Содержание работы
Основны положения теории радикального цепного механизма реакции термического распада У.В Теория РАЙСА
1. Первичный распад молекулы идет по связи –С–С– с образованием двух радикалов
2. Относительно устойчивыми радикалами являются H•, СН3•, С2Н5•. Продолжительность жизни метильного и этильного радикалов составляет соответственно 0,006 и 0,002 с. Более крупные радикалы неустойчивы и подвергаются распаду. Распад крупных радикалов происходит по связи –С–С–, находящейся в β-положении относительно атома углерода, имеющего неспаренный электрон.
Это обусловлено тем, что наличие свободного электрона вызывает усиление связей α за счет электронного взаимодействия его с электронами соседних углеродных атомов и ослабление связей β.
Распад крупных радикалов протекает до образования устойчивого радикала. При этом в результате распада образуется радикал с меньшим числом углеродных атомов и непредельный углеводород.
3. Радикалы, взаимодействуя с нейтральной молекулой, могут отрывать от нее атом водорода
Легкость отрыва атома водорода от молекулы углерода уменьшается в ряду:
третичный атом углерода > вторичный > первичный.
Скорости отрыва атома водорода от первичного, вторичного и третичного атомов углерода при 600 0 С соотносятся как 1:2:10.
4. Радикалы могут взаимодействовать между собой с образованием нейтральной молекулы углерода. Новая связь С-С образуется за счет двух неспаренных электронов, имеющихся у радикалов.
механизма термического крекинг н-бутана.
1 стадия. Зарождение цепной реакции. На этой стадии происходит распад молекул н-бутана на радикалы
2 стадия. Развитие цепной реакции. На этой стадии образовавшиеся на первой стадии радикалы реагируют с новыми молекулами н-бутана.
3. стадия. Распад радикалов. Образовавшиеся на 2й стадии радикалы подвергаются распаду по 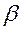
4 стадия. Передача цепи. Образовавшиеся на 3й стадии радикалы взаимодействуют с новыми молекулами н-бутана и превращаются в нейтральные молекулы (метан и этан соответственно) – коечные продукты распада исходного углеводорода наряду с С2Н4 и С3Н6, образовавшимися на 3й стадии.
Бутильные радикалы далее подвергаются распаду (см. 3ю стадию)и таким образом происходит цепная реакция распада.
5 стадия. Обрыв цепной реакции. Он заключается во взаимодействии радикалов между собой и прекращении цепной реакции.
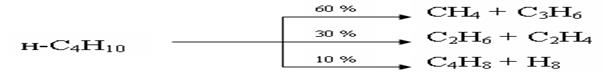
Очевидно, что распад н-бутана может протекать по двум направлениям
Относительную вероятность протекания реакции по тому или иному направлению можно определить по формуле
где К – относительная скорость отрыва водорода от первичного или вторичного атома углерода;
nH – число атомов водорода у атома углерода, от которого происходит отрыв водородного атома;
nС – число равноценных атомов углерода в молекуле.
Вероятность первой реакции равна 2*2*2=8.
Вероятность второй реакции равна 1*3*2=6.
Таким образом, 14 молекул н-бутана распадаются на 8 молекул С3Н6, 8 молекул СН4, 6 молекул С2Н4 и 6 молекул С2Н6. На основании этих данных рассчитывается теоретический состав продуктов распада н-бутана и сравнивается с экспериментальными данными. Теория радикально-цепного механизма крекинга была проверена также на примере распада н-гексана, изооктанов, н-октана и других алканов и во всех случаях было показано хорошее соответствие теории и эксперимента по составу продуктов реакции при небольших глубинах превращений исходных углеводородов.
Превращение различных углеводородов при термическом крекинге.Рассмотрим поведение углеводородов различных классов под воздействием высоких температур.Парафиновые углеводороды. Для парафинов характерен распад на низкомолекулярные углеводороды. Продуктами первичного распада парафинового углеводорода являются парафин и олефин.
Распад алканов происходит преимущественно по середине цепи, так как центральные связи С–С являются наименее прочными. Так, в н-октане энергия разрыва связей составляет, кДж/моль
Низкомолекулярные алканы наряду с распадом подвергаются в значительной степени реакциям дегидрирования с образованием соответствующих олефинов
По мере увеличения молекулярной массы углеводорода вероятность реакций дегидрирования снижается. Так, пропан при 600 0 С в равной степени превращается по двум направлениям
Нормальный бутан в тех же условиях подвергается дегидрированию уже в значительно меньшей степени
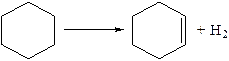
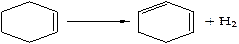
Нафтеновые углеводороды. Термическая устойчивость незамещенных нафтеновых углеводородов значительно выше, чем парафинов. Лишь в жестких условиях крекинга возможен распад кольца нафтенового углеводорода с образованием олефинов или очень неустойчивых бирадикалов, которые в свою очередь распадаются с образованием олефинов:
При жестких условиях протекает дегидрирование моноциклических нафтенов до соответствующих ароматических углеводородов. Эта реакция идет через стадию образования непредельных углеводородов
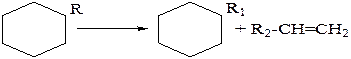
Наиболее вероятным направлением крекинга алкилированных нафтеновых углеводородов является разрыв связей С–С в боковой цепи.
При ужесточении режима может происходить полное деалкилирование углеводорода
Бутан: способы получения и химические свойства
Бутан C4H10 – это предельный углеводород, содержащий четыре атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд бутана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение бутана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
При образовании связи С–С происходит перекрывание sp 3 -гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле бутана C4H10 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |
Изомерия бутана
Структурная изомерия
Для бутана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан |
| Бутан | Изобутан |
 |  |
Для бутана не характерна пространственная изомерия.
Химические свойства бутана
Бутан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для бутана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для бутана характерны радикальные реакции.
Бутан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Бутан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании бутана образуется смесь хлорпроизводных.
| Например, при хлорировании бутана образуются 1-хлорбутан и 2-хлорбутан: Бромирование протекает более медленно и избирательно.
|