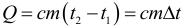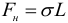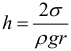Физика. 10 класс
Конспект урока
Физика, 10 класс
Урок 24. Первый закон термодинамики
Перечень вопросов, рассматриваемых на уроке:
1) закон сохранения энергии для термодинамических процессов;
2) связь изменения внутренней энергии газа с работой внешних сил и количеством теплоты, переданного термодинамической системе;
3) применение первого закона термодинамики к различным газовым процессам;
4) уравнение теплового баланса;
5) необратимость тепловых процессов.
Глоссарий по теме
Работа системы против внешних сил – это работа, которую совершает газ, преодолевая внешнее давление.
Адиабатный процесс – это процесс, протекающий в системе без теплообмена.
Необратимый процесс – Необратимым называется такой процесс, который самопроизвольно протекает только в одном направлении; в обратном направлении он протекает так, что система не проходит через те же состояния и не возвращается в исходное состояние.
Первый закон термодинамики – закон сохранения энергии для термодинамических систем.
Количество теплоты, сообщённое системе, равно сумме работы газа против внешних сил и изменения внутренней энергии системы.
Второй закон термодинамики определяет направление термодинамических процессов. Одна из формулировок второго закона: невозможен такой процесс, единственным результатом которого является переход тепла от менее нагретого тела к более нагретому телу.
Основная и дополнительная литература по теме урока:
Мякишев Г. Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 216-224.
Рымкевич А.П. Сборник задач по физике. 10-11 класс. — М.: Дрофа, 2009.- С.81-89.
Основное содержание урока
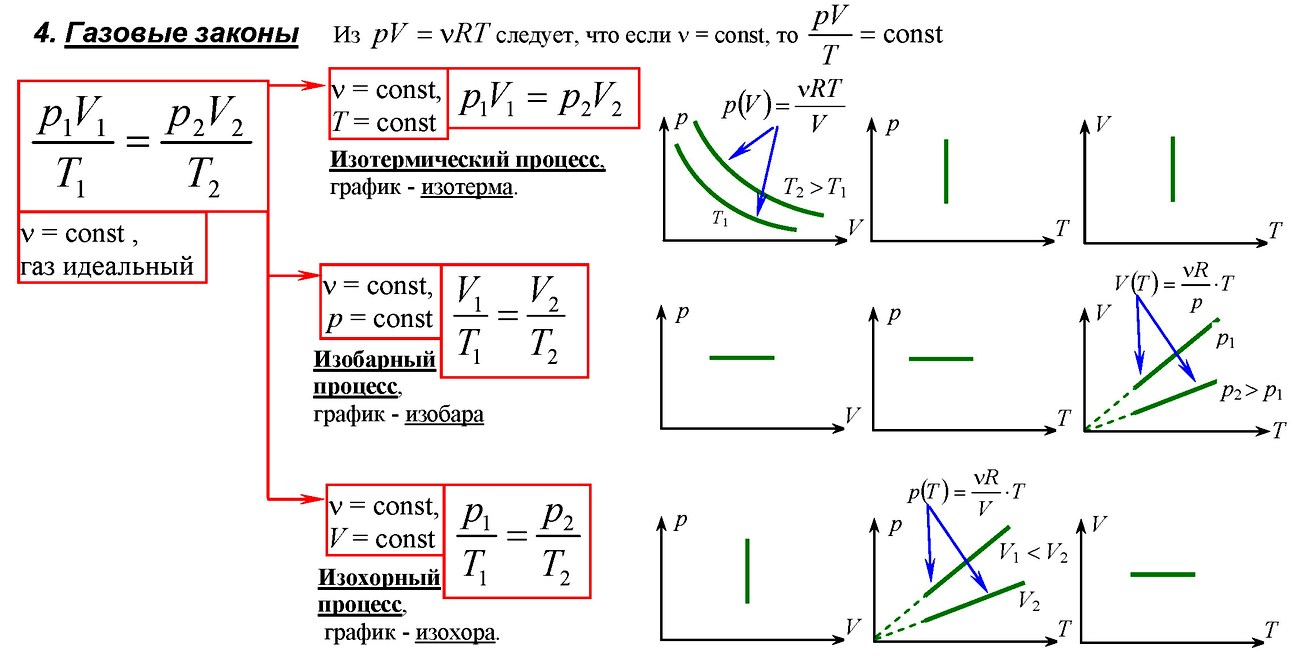
Закон сохранения энергии, записанный применительно к термодинамической системе, выглядит следующим образом:
где Q – количество теплоты, переданное системе;
A / — работа системы (газа);
∆U — изменение внутренней энергии системы (газа).
Первый закон термодинамики: сообщенное системе количество теплоты расходуется на совершение системой работы против внешних сил и изменение внутренней энергии системы. Если работу совершают внешние по отношению к системе тела, то работа газа считается отрицательной, работа внешних тел положительной и А = — A /
Тогда первый закон термодинамики лучше написать в виде ∆U = Q + А.
Применение первого закона термодинамики к изопроцессам.
- Изотермический процесс. Т = const.
Р = const; A / >0, ∆U>0
Используя уравнение Менделеева-Клапейрона, получим
Подстановка в уравнение первого закона термодинамики количества теплоты дает
Процесс, протекающий без теплообмена, т.е. Q = 0.
Тогда система может совершать работу либо за счет уменьшения внутренней энергии (газ расширяется) A / = — ∆U, либо за счет работы внешних тел над системой (происходит сжатие газа) А = ∆U.
Уравнение теплового баланса.
Если в замкнутой системе тела обмениваются энергией и работа этими телами не совершается, то суммарное изменение внутренней энергии системы равно нулю; тогда соответственно равна нулю и сумма количеств теплоты, полученных или отданных телами системы,
Первый закон термодинамики не определяет направление тепловых процессов. Необратимыми называются такие явления, которые самопроизвольно протекают только в одном направлении; в обратном направлении они протекают только при внешнем воздействии.
Формулировка второго закона термодинамики: невозможно перевести тепло от менее нагретого тела к более нагретому телу при отсутствии других одновременных изменений в обеих системах или в окружающих их телах (или невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого, к телу более нагретому).
Статистический характер второго закона термодинамики.
Состояние макроскопической системы (например, газ в баллоне) может быть реализовано огромным числом микросостояний (комбинацией в расположении молекул). Вероятность того, что первоначально находившийся в какой-либо части объёма газ весь снова соберется в какой-то момент времени в той же его части очень мала. А при очень большом числе частиц — ничтожно мала.
Вероятность обратимых процессов, наоборот, тем больше, чем меньше число частиц в системе. Поэтому справедливость второго закона термодинамики определяется достаточно большим объёмом и достаточно большим числом частиц системы. Так, например, ничтожно мала (реально равна 0) вероятность того, что спокойно висящий маятник начнет раскачиваться в результате одновременного, направленного в одну сторону удара всех молекул воздуха, до какого-то момента, двигавшихся хаотично по всем сторонам.
Направление термодинамических процессов определяется вторым законом термодинамики. Первый и второй законы термодинамики позволяют сделать заключение о невозможности создания вечного двигателя I и II рода.
Разбор тренировочных заданий
1. Гелий, находящийся в сосуде под подвижным поршнем, изотермически сжимают. Начальное давление газа p0, а его объём V0. Масса газа в сосуде остаётся неизменной. Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от объёма V газа. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца.
1.
Б) Внутренняя энергия U(V)
2.
3.
4.
Решение: В изотермическом процессе p0V0 = pV; откуда 
Из уравнения Менделеева-Клапейрона:
Правильный ответ: А – 3, Б – 4.
2. Чему равна внутренняя энергия 2 молей идеального одноатомного газа при температуре 127 0 С? R = 8,31Дж/(моль·К).
Решение: Переведём температуру в СИ:
Т = 127 + 273 = 400 К.
Формула для вычисления внутренней энергии одноатомного идеального газа:
Известно, что число молей 
U = (3/2) · (2 моля) · 8,31 (Дж/моль·К) · 400 К = 9972 Дж.
ТЕРМОДИНАМИКА
Термодинамика – раздел физики, изучающий тела, находящиеся в состоянии термодинамического равновесия и явления, сопровождающие переходы между этими состояниями.
Термодинамическое равновесие – состояние тел (или частей тела), при котором остаются постоянными все величины, характеризующие эти тела (или части тела): объёмы, давления, расположение масс и др.
Температура – единственная физическая величина, всегда одинаковая у всех тел (или частей тела), находящихся в состоянии термодинамического равновесия.
Термометр – прибор для измерения температуры. Единица температуры – 1 кельвин (1 К). Также используется 1 °С, равный 1 К.
Теплообмен – переход внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы.
Количество теплоты – физическая величина, показывающая энергию, полученную (отданную) телом при теплообмене.
Калориметр – прибор для измерения количества теплоты. Единица количества теплоты – 1 джоуль (1 Дж).
Удельная теплоемкость вещества – физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С. Единица удельной теплоёмкости – 1 Дж/(кг·°С).
Количество теплоты, полученное (отданное) телом при теплообмене, пропорционально массе тела и изменению его температуры. Коэффициент пропорциональности – удельная теплоёмкость вещества.
Превращение твёрдого тела в жидкость называют плавлением.Обратное явление называют отвердеванием. Если при этом получается кристаллическое тело, то отвердевание называют кристаллизацией.
Температура
Температурой плавления называют температуру, при которой нагреваемое кристаллическое тело тело начинает плавиться, и при этом одновременно существуют твёрдое и жидкое состояния его вещества.
Температурой кристаллизации называют температуру, при которой охлаждаемая жидкость начинает кристаллизоваться, и при этом одновременно существуют её твёрдое и жидкое состояния.
Как правило, температура кристаллизации вещества равна температуре его плавления. Температура плавления/кристаллизации вещества зависит от внешнего давления и других факторов.
Удельная теплота плавления – физическая величина, показывающая количество теплоты, необходимое для плавления или выделяющееся при кристаллизации 1 кг вещества, находящегося при температуре плавления/кристаллизации. Единица удельной теплоты плавления – 1 Дж/кг.
Количество теплоты, поглощаемое (выделяющееся) при плавлении (кристаллизации), пропорционально массе расплавившегося (кристаллизовавшегося) вещества. Коэффициент пропорциональности – удельная теплота плавления вещества.
Видами парообразования являются: испарение – парообразование, происходящее с поверхности жидкости; кипение – парообразование, происходящее по всему объёму жидкости вследствие возникновения и всплытия на поверхность пузырей пара; сублимация – парообразование, происходящее с поверхности твёрдого тела.
Температурой кипения называют температуру, при которой наблюдается кипение вещества (интенсивное парообразование по всему объёму этого вещества). Температура кипения зависит от внешнего давления и других факторов.
Удельная теплота парообразования – физическая величина, показывающая количество теплоты, необходимое для превращения в пар 1 кг вещества (как правило, при температуре кипения). Единица удельной теплоты парообразования – 1 Дж/кг.
Количество теплоты, поглощённое кипящей (или испаряющейся при постоянной температуре) жидкостью, прямо пропорционально массе образовавшегося пара. Коэффициент пропорциональности – удельная теплота парообразования вещества.
При охлаждении/кристаллизации/конденсации выделяется точно такое же количество теплоты, которое было затрачено для нагревания/плавления/парообразования вещества (если температуры и давления при прямом и обратном процессах соответствуют друг другу).Утверждение будет верным и наоборот.
Тепловые явления
Законы термодинамика
Первый закон термодинамики устанавливает равенство между изменением внутренней энергии тела и суммой полученной телом теплоты и совершённой над ним работы.
Тепловой двигатель – периодически действующее устройство, служащее для превращения внутренней энергии рабочего тела (как правило, газа или пара) в механическую энергию.
Количество теплоты, выделяющееся при полном сгорании вещества (топлива), прямо пропорционально массе сгоревшего вещества (топлива). Коэффициент пропорциональности – удельная теплота сгорания топлива.
Известно три способа теплопередачи (теплообмена) – теплопроводность, конвекция и излучение. При теплопроводности теплота проникает через вещество без его перемещения (в случае отсутствия вещества теплопроводность является нулевой). При конвекции теплота перемещается неравномерно нагретым движущимся веществом (в условиях, когда возможно возникновение архимедовой силы). При излучении теплота передаётся через пространство или вещество в виде электромагнитных волн (для излучения наличие вещества не является обязательным, в отличие от первых двух способов теплопередачи).
Второй закон термодинамики гласит, что теплообмен самостоятельно протекает только в таком направлении, что температура менее нагретого тела возрастает, а более нагретого – уменьшается.
Дополнительные материалы по теме:
Конспект темы «Термодинамика. Теория, формулы, схемы». В учебных целях использованы цитаты из пособия «Физика в таблицах и схемах / Янчевская О.В. — СПб, Литера». Рекомендуем купить указанное пособие по ссылке (переход в Интернет-магазин).
Термодинамическое уравнение физика 10 класс
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. Тогда количество теплоты (энергии) необходимое для изменения температуры некоторого тела массой m можно рассчитать по формуле:
При этом в этой формуле абсолютно не важно в каких единицах подставлена температура, так как нам важно не ее абсолютное значение, а изменение. Единица измерения удельной теплоемкости вещества: Дж/(кг∙К).
- Если t2 >t1, то Q > 0 – тело нагревается (получает тепло).
- Если t2 0 и отдает холодильнику количество теплоты Q2 3 воздуха (т.е. просто плотность водяных паров; из уравнения Клапейрона-Менделеева выражается отношение массы к объему и получается следующая формула):
где: р – парциальное давление водяного пара, М – молярная масса, R – универсальная газовая постоянная, Т – абсолютная температура. Единица измерения абсолютной влажности в СИ [ρ] = 1 кг/м 3 , хотя обычно используют 1 г/м 3 .
Относительной влажностью φ называется отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м 3 воздуха при данной температуре:
Относительную влажность можно также определить как отношение давления водяного пара р к давлению насыщенного пара р0 при данной температуре:
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100°С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. Важно знать, что температура кипения жидкости зависит от давления. В герметически закрытом сосуде жидкость кипеть не может, т.к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром.
Поверхностное натяжение
Молекулы вещества в жидком состоянии расположены почти вплотную друг к другу. В отличие от твердых кристаллических тел, в которых молекулы образуют упорядоченные структуры во всем объеме кристалла и могут совершать тепловые колебания около фиксированных центров, молекулы жидкости обладают большей свободой. Каждая молекула жидкости, также как и в твердом теле, «зажата» со всех сторон соседними молекулами и совершает тепловые колебания около некоторого положения равновесия. Однако, время от времени любая молекула может скачком переместиться в соседнее вакантное место. Такие перескоки в жидкостях происходят довольно часто; поэтому молекулы не привязаны к определенным центрам, как в кристаллах, и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
Вследствие плотной упаковки молекул сжимаемость жидкостей, то есть изменение объема при изменении давления, очень мала; она в десятки и сотни тысяч раз меньше, чем в газах.
Наиболее интересной особенностью жидкостей является наличие свободной поверхности. Жидкость, в отличие от газов, не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела, которая находится в особых условиях по сравнению с остальной массой жидкости. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости (силами, действующими на данную молекулу жидкости со стороны молекул газа (или пара) можно пренебречь). В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (то есть увеличить площадь поверхности жидкости), надо затратить положительную работу внешних сил ΔAвнеш, пропорциональную изменению ΔS площади поверхности.
Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия Ep поверхности жидкости пропорциональна ее площади:
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости на единицу при постоянной температуре. В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м 2 ) или в ньютонах на метр (1 Н/м = 1 Дж/м 2 ).
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии (любое тело всегда стремится скатиться с горы, а не забраться на нее). Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку. Сила поверхностного натяжения, действующая на участок границы жидкости длиной L вычисляется по формуле:
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. При этом высота столба жидкости в капилляре:
где: r – радиус капиляра (т.е. тонкой трубки). При полном смачивании θ = 0°, cos θ = 1. В этом случае высота столба жидкости в капилляре станет равной:
Как успешно подготовиться к ЦТ по физике и математике?
Для того чтобы успешно подготовиться к ЦТ по физике и математике, среди прочего, необходимо выполнить три важнейших условия:
- Изучить все темы и выполнить все тесты и задания приведенные в учебных материалах на этом сайте. Для этого нужно всего ничего, а именно: посвящать подготовке к ЦТ по физике и математике, изучению теории и решению задач по три-четыре часа каждый день. Дело в том, что ЦТ это экзамен, где мало просто знать физику или математику, нужно еще уметь быстро и без сбоев решать большое количество задач по разным темам и различной сложности. Последнему научиться можно только решив тысячи задач.
- Выучить все формулы и законы в физике, и формулы и методы в математике. На самом деле, выполнить это тоже очень просто, необходимых формул по физике всего около 200 штук, а по математике даже чуть меньше. В каждом из этих предметов есть около десятка стандартных методов решения задач базового уровня сложности, которые тоже вполне можно выучить, и таким образом, совершенно на автомате и без затруднений решить в нужный момент большую часть ЦТ. После этого Вам останется подумать только над самыми сложными задачами.
- Посетить все три этапа репетиционного тестирования по физике и математике. Каждый РТ можно посещать по два раза, чтобы прорешать оба варианта. Опять же на ЦТ, кроме умения быстро и качественно решать задачи, и знания формул и методов необходимо также уметь правильно спланировать время, распределить силы, а главное правильно заполнить бланк ответов, не перепутав ни номера ответов и задач, ни собственную фамилию. Также в ходе РТ важно привыкнуть к стилю постановки вопросов в задачах, который на ЦТ может показаться неподготовленному человеку очень непривычным.
Успешное, старательное и ответственное выполнение этих трех пунктов, а также ответственная проработка итоговых тренировочных тестов, позволит Вам показать на ЦТ отличный результат, максимальный из того, на что Вы способны.
Нашли ошибку?
Если Вы, как Вам кажется, нашли ошибку в учебных материалах, то напишите, пожалуйста, о ней на электронную почту (адрес электронной почты здесь). В письме укажите предмет (физика или математика), название либо номер темы или теста, номер задачи, или место в тексте (страницу) где по Вашему мнению есть ошибка. Также опишите в чем заключается предположительная ошибка. Ваше письмо не останется незамеченным, ошибка либо будет исправлена, либо Вам разъяснят почему это не ошибка.
ЗАПРЕЩЕНО использование представленных на сайте материалов или их частей в любых коммерческих целях, а также их копирование, перепечатка, повторная публикация или воспроизведение в любой форме. Нарушение прав правообладателей преследуется по закону. Подробнее.
http://uchitel.pro/%D1%82%D0%B5%D1%80%D0%BC%D0%BE%D0%B4%D0%B8%D0%BD%D0%B0%D0%BC%D0%B8%D0%BA%D0%B0/
http://educon.by/index.php/materials/phys/termodinamika