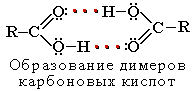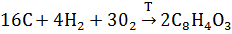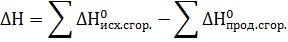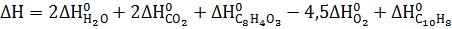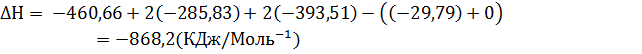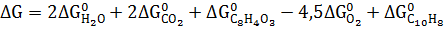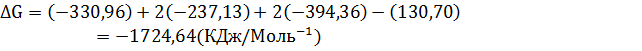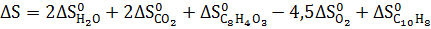Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
МИНИСТЕРСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ
ПО ДЕЛАМ ГРАЖДАНСКОЙ ОБОРОНЫ, ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ СТИХИЙНЫХ БЕДСТВИЙ
ФГБОУ ВО Ивановская пожарно-спасательная академия ГПС
МЧС России
Кафедра химии, теории горения и взрыва
Курсовая работа
дисциплина «Химия»
Тема: «Термохимические свойства вещества»
Выполнил Антонова П.С.,
факультет «Пожарная безопасность»,
Курс,
Учебная группа
Руководитель ____________________
Дата защиты: ____________________
Оценка: _________________________
____________________
(подпись руководителя)
Иваново (2015)
СОДЕРЖАНИЕ:
Введение
В настоящее время актуальной проблемой является масштабные пожары и катастрофы на промышленных, сельско-хозяйственных и топливно-энергетических объектах. Причиной этого является высокая пожарная опасность веществ и наличие этих веществ в больших количествах на объектах.
В данной ситуации структура промышленности и сельского хозяйства топливно-энергетического комплекса остается ключевым звеном всей экономической системы государства. Поэтому обеспечение устойчивого и надежного функционирования является необходимым условием энергетической безопасности как отдельных регионов, так и государства в целом. Неоспоримую роль для устойчивого и надежного функционирования топливно-энергетического комплекса оказывают хранилища газообразных и жидких углеводородов.
Хранилища газообразных и жидких углеводородов являются необходимым элементом функционирования трёх основных составляющих топливно-энергетического комплекса страны: единой системы газоснабжения, системы снабжения нефтепродуктами и системы энерго- и теплоснабжения. Создание хранилищ газонефтепродуктов проводится на основе новейших достижений науки и техники, с учётом экологической ситуации района размещения хранилищ и соблюдением правил безопасности. В наибольшей степени этим условиям отвечают подземные хранилища, создаваемые в пористых, проницаемых горных породах (для природного газа) и в отложениях каменной соли (для газообразных и жидких углеводородов), которые обеспечивают лучшую защиту окружающей среды от вредного воздействия газонефтепродуктов, имеют высокую пожаровзрывобезопасность и защищённость от воздействия всех видов современного оружия.
Умение прогнозировать поведение веществ в условиях пожара, оценить влияние тех или иных условий, при которых возможно протекание и прекращение горения, возможно на основе химических теорий.
Расчёт некоторых физико-химических свойств и состава углеводородных газов необходим , к примеру, для прогнозирования возможных ситуаций при аварийных режимах (размер зон, ограниченных нижним концентрационным пределом распространения пламени; размеры зон распространения облака горючих газов при аварии и времени достижения облаком мест расположения различных объектов; определение давления в аппаратах при высоких температурах в условиях пожара (нарастание давления, критические температуры) и др.).
Данная курсовая работа направлена на определение взрывоопасности н-амилового спирта, возможное развитие пожара при реакции вещества с кислородом и воздухом, а также определение способов тушения пожара с его участием.
Главной целью курсовой работы является исследование н-амилового спирта и его физико-химических свойств, прогнозирование развития пожара с участием данного вещества. Развитие навыков и теоретических знаний в области органической химии и использование этих знаний в данной работе.
Основные задачи выполнения КР:
§ углубить теоретические знания, полученные в процессе изучения органической химии;
§ получить практические навыки при поиске, сборе, обработке и анализе информации;
§ выработать умение логически грамотно проиллюстрировать собранную и обобщенную информацию;
§ научиться обобщать литературные сведения, устанавливать закономерности, делать выводы о проделанной работе;
§ применять на практике полученные данные.
Основная тема данной работы изучение органической химии (Органи́ческая хи́мия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза. Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. Способность углерода соединяться с большинством элементов и образовывать молекулы различного состава и строения, обусловливает многообразие органических соединений.) и основных ее классов . В данной работе рассматривается один из классов органических веществ спирты (Спирты́— органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−O−H. В номенклатуре IUPAC для соединений , в которых гидроксильная группа связана с ненасыщенным (находящемся в состоянии sp2 гибридизации атомом углерода, рекомендуются названия «енолы» (гидроксил связан с винильной C=C связью) и «фенолы» (гидроксил связан с бензольным или другим ароматическим циклом.). Н-амиловый спирт является одноатомным предельным легковоспламеняющимся веществом, используются в качестве растворителей для различных масел, жиров, смол и восков. Он применяется также как экстрагент солей урана и ниобия. Сложные эфиры н-амиловых спиртов являются растворителями, пластификаторами поливинилхлорида и ацетилцеллюлозы, в парфюмерии — душистыми веществами, в кулинарии — как фруктовые эссенции.
Основная часть
1.Проанализируйте строение молекулы н-амилового спирта, есть в его составе функциональная группа? Какие свойства она придает? К какому классу соединения относится вещество? Приведите его ближайшие изомеры и гомологи.
Н-амиловый спирт (Spiritus amylicus) — 
Н-амиловые спирты обладают всеми свойствами, присущими спиртам (заменяем C5H11 на радикал R):
1. образование алкоголятов с щелочными металлами 
2. образование сложных эфиров с неорганическими и органическими кислотами

Функциональной группой спиртов и фенолов является одновалентная гидроксильная группа — ОН, связанная с углеводородным радикалом. В составе н-амилового спирта есть функциональная группа — гидроксильная ОН. Атом кислорода входящий в гидроксильную группу имеет частичный отрицательный заряд и две неподеленные электронные пары ,что дает возможность молекулам спирта образовывать водородные связи. Н-амиловые спирты используются в качестве растворителей для различных масел, жиров, смол и восков. Они применяются также как экстрагенты солей урана иниобия.
Наибольшее значение имеет изоамиловый спирт (CH3)2CHCH2CH2OH — основной компонент сивушного масла, из которого его и получают.
Н-амиловые спирты являются бесцветными жидкостями с неприятным запахом.
В воде растворяются 1-пентанол, 3-метил-1-бутанол и 2-метил-2-бутанол.
Гомологи́ческий ряд — ряд химических соединений одного структурного типа, отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность.
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства
Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
Министерство Российской Федерации
По делам гражданской обороны, чрезвычайным ситуациям
И ликвидации последствий стихийных бедствий
ФГБОУ ВО Ивановская пожарно-спасательная академия государственной противопожарной службы
Кафедра химии, теории горения и взрыва
Курсовая работа
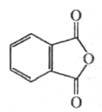
Тема: «Термохимические свойства фталевого ангидрида»
11 курса 114 учебной группы
факультета пожарной безопасности
Руководитель: научный сотрудник
НИО УНК «Государственный надзор»
майор внутренней службы
Дата защиты: _______________
ИВАНОВО 2015
СОДЕРЖАНИЕ:
Введение
В Советском Союзе в соответствии с ГОСТ 7119—54 вырабатывают три сорта товарного фталевого ангидрида, отличающихся друг от друга главным образом содержанием основного вещества. По ГОСТ 7119—54 дистиллированный продукт должен содержать не менее 99,7% фталевого ангидрида для первого сорта и не менее 99,2% — для второго. Это основные виды товарной продукции. В продукте сорта технический содержание фталевого ангидрида составляет не менее 99%. Его, как правило, получают непосредственно из конденсаторов без последующей дистилляции. Кроме того, вырабатывается реактивный фталевый ангидрид (ГОСТ 5869—51) двух марок чистый для анализа и чистый. Марки различаются содержанием фталевого ангидрида и примесей. Во фталевом ангидриде — реактиве регламентируется содержание хлоридов и сульфатов тяжелых металлов сероводородной группы (металлы IV и V групп периодической системы элементов). Технические условия на фталевый ангидрид по ГОСТ 7119—54 и ГОСТ 5869—51.
Фталевый ангидрид катализатор представляющий собой модификацию контакта, применяемого для получения ангидрида фталевой кислоты. Однако условия окисления очень отличаются от условий окисления нафталина, так как бензол значительно устойчивее против окисления.
Вследствие жестких условий процесса снижается выход малеинового ангидрида, составляющий 50—60% от теоретического, тогда как выход фталевого ангидрида достигает 86—88%.
Производство фталевого ангидрида из о-ксилола требует в качестве первой ступени концентрирования о-ксилола в сырье путем выделения его из смеси других ароматических углеводородов, содержащих в молекуле восемь
атомов углерода. Это может быть достигнуто путем фракционной перегонки ароматической фракции 
Также известно, что бензол окисляется в малеиновый ангидрид при условиях, сходных с условиями, применяемыми при производстве фталевого ангидрида . Таким образом, частичный разрыв кольца почти неизбежен, но, по-видимому, после того как уже образовался фталевый ангидрид, кольцо менее чувствительно к атаке, чем ранее. Высказано предположение, что каталитическое окисление толуола происходит при помощи атомарного кислорода, выделяемого катализатором в результате прохождения через ряд стадий гидроксилирования на поверхности катализатора. В условиях, применяемых для получения фталевого ангидрида, бензиловый спирт не был обнаружен в продуктах окисления, но его можно выделить при более высоких давления. Сырой фталевый ангидрид можно выделить из потока, выходящего из реактора, различными путями, включая конденсацию в виде твердого осадка в больших сосудах, охлаждаемых воздухом, или при промывании водой содержащих фталевый ангидрид газов, выходящих из реактора. В последнем случае ангидрид гидратируется в кислоту, которая осаждается из раствора, образуя водную суспензию. Фталевый ангидрид очень высокой степени чистоты получается при помощи стандартных методов перегонки. Очищенное вещество кристаллизуется в виде бесцветных игл. В продаже он обычно появляется в виде чешуек, которые получаются при обычном осаждении из расплавленного дистиллята.
Очень важное направление в применении головных погонов заключается в том, что их каталитически восстанавливают в спирты, которые переводят в нейтральные эфиры фталевой кислоты обработкой фталевым ангидридом. Последние являются важными растворителями и смягчителями для промышленности пластмасс, обладающими высокой устойчивость к холоду (например, Е. В. 242 и Е. О. 356 завода фирмы Дойче Гидрирверке в Родлебене)
Главным направлением использования фталевого ангидрида является применение его сложных эфиров в качестве пластификаторов и в виде алкидных смол для поверхностных покрытий. Новым направлением, обещающим быстрое развитие, является использование его в виде полиэфиров для высокопрочных пластмасс. Производство фталевого ангидрида в США возросло с менее чем 3200 тп в 1930 г. до более 90 700 тп в 1950 г. Проектируемая производительность на 1954 г. устанавливается 170 097тп.
Масштабы производства требуют обеспечения соответствующих больших и устойчивых источников сырья, т. е. нафталина или о-ксилола. В прежние годы более 90% фталевого ангидрида производилось из нафталина, но поставки последнего во время второй мировой войны были совершенно недостаточными, а возможность получать его в дальнейшем в количествах, достаточных для удовлетворения проектируемого производства фталевого ангидрида, неясна. Здесь сказываются многие экономические, политические и технологические факторы, которые рассматриваются в других работах и выходят за рамки настоящего труда. Хотя все сказанное выше справедливо и применительно к о-ксилолу, но это сырье можно получать в больших количествах из нефти при помощи различных процессов ароматизации. Вследствие низких антидетонационных свойств он не применяется для авиационного бензина, поэтому возможности использования о-ксилола для производства фталевого ангидрида будут, по-видимому, весьма велики даже в периоды наибольшего напряжения национальной, экономики.
Основная часть
1.Проанализируйте строение молекулы фталевого ангидрида, есть в его составе функциональная группа? Какие свойства она придает? К какому классу соединения относится вещество? Приведите его ближайшие изомеры и гомологи.
Фталевый ангидрид (ангидрид 1,2-бензолдикарбоно-вой к-ты),
Молекулярная масса М=148,12;
Фталевый ангидрид : бесцветные орто-ромбичные кристаллы; легко возгоняется, т. пл. 130,8 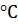
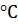
Обладает свойствами ароматических соединений. При нагревание с моно атомными спиртами в присутствие 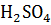
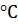
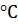
Фталевый ангидрид легко реагирует с фенолами и их производными. Так, реакция с фенолом в присутствие 
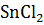
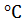
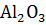
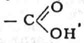
Функциональная группа:
Карбоксил (карбоксильная группа)—одновалентная группа СООН, присутствие которой определяет принадлежность органического соединения к карбоновым кислотам.
Карбоксильная группа, карбоксил, — одновалентная группа
Характерная для карбоновых кислот. Состоит из карбонильной и
гидроксильной (-ОН) групп (отсюда назв.: карб + оксил)
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами)поляризации связи О-Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
R-COOH = R-COO − + H + Растворимость в воде и высокие температуры кипения кислот
обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Строение карбоксильной группы:
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
Атом водорода карбоксильной группы отделяется от нее в миллион раз легче, чем от гидроксильной группы фенола. Поэтому всякое органическое вещество, содержащее карбоксильную группу, обладает ярко выраженными кислотными свойствами. Такие вещества носят назв. Если вместо гидроксильной группы присоединить к ней просто атом водорода, то получится альдегидная группа. Альдегиды, которые могут таким путем образовываться из той или иной карбоновой кислоты, получают свое название от названия соответствующей кислоты карбоновых кислот Взгляните еще раз на формулу карбоксильной группы. Вы увидите, что у атома углерода еще остается одна свободная валентная связь, к которой может присоединиться какой-нибудь другой атом. Если это будет атом водорода, то получится муравьиная кислота.
Карбоксильная группа может быть присоединена к углеводородной цепочке любой длины. Однако почти во всех таких соединениях, встречающихся в природе, общее число атомов углерода оказывается четным. Например, в молекуле уксусной кислоты — два атома углерода. Есть карбоновые соединения с четырьмя, шестью, восемью и так далее атомами углерода, их может быть больше двадцати. А аналогичных соединений с нечетным числом атомов углерода в природе почти не бывает.
Изомеры Фталевого ангидрида:
3,6- Парабензолкарбоновой кислоты
Вывод:
Проанализировав строение молекулы фталевого ангидрида я узнал: что фталевый ангидрид представляет собой бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях.
Проявляет свойства ароматических соединений. Со спиртами при нагревании в присутствии серной кислоты образует сложные моно- и диэфиры, с многоатомными спиртами — полиэфиры (алкидные смолы). Фталевый ангидрид является исходным реагентом для получения различных производных фталевой кислоты: её сложных эфиров, фталимида, фталонитрила. Фталевый ангидрид является сырьём для производства глифталевых и пентафталевых красителей производных флуоресцеина, родамина и антрахинона, лекарственных средств. Фталевый ангидрид ядовит, раздражает кожу и слизистые оболочки глаз и носа, способствует заболеванию бронхиальной астмой.
Запишите термодинамическое уравнение реакции образования вещества из простых веществ.
Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента.
Фталевый ангидрид состоит из таких простых веществ как углерод, кислород, водород.
Вывод: данное термодинамическое уравнение из простых веществ возможно.
3. Рассчитайте 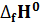
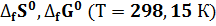
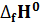  | 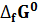 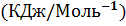 |  (Дж* (Дж* 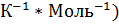 | |
| С10Н8 Нафталин | -29,79 | 130,70 | 360,56 |
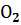 Кислород Кислород | 205,138 | ||
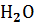 Вода Вода | -285,83 | -237,13 | 69,91 |
 Оксид углерода Оксид углерода | -393,51 | -394,36 | 213.74 |
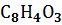 Фталевый ангидрид Фталевый ангидрид | -460,66 | -330,96 | 179,49 |
Термодинамические свойства веществ. Таблица 1.
Ответ:
Дано: Решение:
q =22000 кДж/кг Q=q*m
m=300 кг Q= 22000*300 = 66* 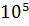
Ответ: Q=66* 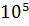
Не нашли, что искали? Воспользуйтесь поиском:
http://mydocx.ru/12-13443.html
http://vikidalka.ru/2-148503.html