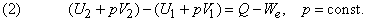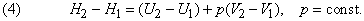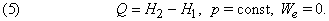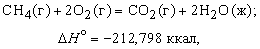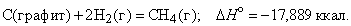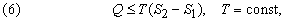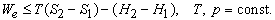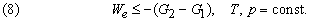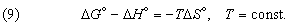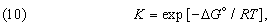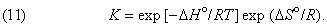ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА, рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы (в том числе электрические и магнитные), сопровождающиеся тепловыми эффектами, подчиняется фундаментальным принципам (началам) термодинамики. Химическая термодинамика определяет, в первую очередь, условия (такие, как температура и давление) протекания химических реакций и равновесных состояний, которых они достигают. Анализ тепловых явлений базируется на трех фундаментальных принципах, подтвержденных данными многочисленных наблюдений. См. также ТЕРМОДИНАМИКА.
Первое начало термодинамики.
Первое начало термодинамики по существу выражает закон сохранения энергии. Для системы, окруженной замкнутой границей, через которую не происходит переноса вещества, справедливо соотношение
где U1 и U2 – энергии системы в состояниях 1 и 2; Q – теплота, полученная от внешних источников; W – работа, совершенная системой над внешними телами в процессе, посредством которого система переходит из состояния 1 в состояние 2. Если процесс – химическая реакция, то обычно ее проводят в таких условиях, чтобы можно было отделить энергию химического превращения от энергии, связанной с одновременными изменениями температуры или давления. Поэтому энергию (теплоту) химической реакции обычно определяют в условиях, в которых продукты находятся при тех же температуре и давлении, что и реагенты. Энергия химической реакции тогда определяется теплотой Q, полученной от окружающей cреды или переданной ей. Измерение Q может быть проведено с помощью калориметра подходящего типа. Реакцию можно было бы провести, например, в металлическом сосуде, погруженном в теплоизолированный объем воды, изменение температуры которой (обычно на несколько градусов) соответствует теплоте реакции. Для количественных измерений калориметр обычно градуируют с помощью независимого электронагревателя или проведения в сосуде химической реакции, теплота которой известна.
Медленные реакции особенно трудны для калориметрических измерений, поскольку нужны сложные меры предосторожности для защиты калориметра от теплообмена с окружающей средой. Так называемый адиабатический калориметр целиком погружается в изотермическую оболочку с независимым нагревом, температура которой во время опыта поддерживается как можно более близкой к температуре внутри калориметра. Реакции, высвобождающие теплоту (отрицательная Q в уравнении (1)), называются экзотермическими, а реакции, в процессе которых теплота поглощается, – эндотермическими.
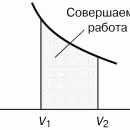
Как показывает уравнение (1), внутренняя энергия реагирующей системы определяется не только количеством высвобожденной или поглощенной теплоты. Она также зависит от того, сколько энергии система затрачивает или приобретает посредством произведенной работы. При постоянном давлении p полная работа, совершенная системой, описывается выражением p (V2 – V1) +We, где первый член – работа расширения, связанная с изменением объема от V1 до V2 , а We – дополнительная, или т.н. «полезная», работа, совершенная системой помимо работы расширения. Если работа совершается над системой, то оба члена имеют отрицательный знак. Поэтому уравнение (1) можно преобразовать к виду
Вводят вспомогательную меру энергии системы Н, определяемую общим соотношением
Если давление постоянно (обычно в качестве стандартного берется давление 1 атм), то изменение функции Н, называемой энтальпией системы, отличается от изменения ее внутренней энергии на величину работы расширения:
За исключением газофазных систем, это отличие пренебрежимо мало по сравнению с типичными тепловыми эффектами реакций. Однако для общего случая из формулы (2) следует, что теплота Q , измеренная при постоянном давлении и We = 0 (обычное условие протекания химической реакции, если она не происходит, например, в аккумуляторе или гальваническом элементе), равна изменению энтальпии системы:
В любом случае, поскольку разность H2 – H1, как и U2 – U1 , определяется, согласно первому началу термодинамики, исключительно начальным и конечным состояниями системы и не зависит от способа перехода из начального состояния в конечное, суммарное количество теплоты, поглощенное в процессе химического превращения при постоянных температуре и давлении (при We = 0), зависит только от исходных реагентов и конечных продуктов и не зависит от того, через какие промежуточные стадии протекает реакция.
Этот вывод был сделан Г.И.Гессом в 1840 на основе экспериментальных фактов еще до классических опытов Джоуля, продемонстрировавших эквивалентность теплоты и других форм энергии. Гесс показал, что теплота реакции, протекающей через несколько последовательных стадий, равна алгебраической сумме теплот отдельных промежуточных реакций. Закон Гесса, как отметил Г.Гельмгольц в 1847, служит прямым экспериментальным подтверждением применимости закона сохранения энергии к энергетике химических реакций. В пределах ограничений, налагаемых уравнением (5), этот закон был многократно подтвержден многочисленными дальнейшими исследованиями.
Термохимические уравнения.
Теплота, высвобождаемая или поглощаемая конкретной химической реакцией, пропорциональна степени превращения реагентов, определяемой по количеству любого из расходуемых либо образующихся продуктов. Изменение внутренней энергии или энтальпии реагирующей системы определяют по химическому уравнению реакции. Например, сгорание смеси газообразных метана и кислорода описывается термохимическим уравнением
Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом D H ° обозначается изменение энтальпии в химическом превращении при стандартных давлении 1 атм и температуре 298 K (25 ° С) (знак градуса в верхнем индексе H указывает, что данная величина относится к веществам в стандартных состояниях (при p = 1 атм и T = 298 K)). Химическая формула каждого вещества в таком уравнении обозначает вполне определенное количество вещества, а именно его молекулярную массу, выраженную в граммах. Молекулярная масса получается сложением атомных масс всех элементов, входящих в формулу, с коэффициентами, равными числу атомов данного элемента в молекуле. Молекулярная масса метана равна 16,042, и, согласно предыдущему уравнению, при сгорании 16,042 г (1 моля) метана получаются продукты, энтальпия которых на 212,798 ккал меньше энтальпии реагентов. В соответствии с уравнением (5) такое количество теплоты высвобождается, когда 1 моль метана сгорает в кислороде при постоянном давлении 1 атм. Соответствующее уменьшение внутренней энергии системы в ходе реакции составляет 211,615 ккал. Разница между D H ° и D U ° равна – 1,183 ккал и представляет работу p (V2 – V1), совершаемую, когда 3 моля газообразных реагентов сжимаются при давлении 1 атм до 1 моля газообразного диоксида углерода и 2 молей жидкой воды.
Стандартная теплота образования.
Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или) более простых веществ, внутренняя энергия или энтальпия системы меняется на определенную величину, называемую теплотой образования данного вещества. Теплота образования может быть определена различными способами, в том числе прямыми калориметрическими измерениями и путем косвенного расчета (на основе закона Гесса) из теплоты реакции, в которой участвует данное вещество. При проведении расчетов пользуются стандартными (при p = 1 атм и T = 298 K) теплотами образования веществ, входящих в уравнение реакции. Например, стандартную теплоту (энтальпию) образования метана можно вычислить с помощью термохимического уравнения
Хотя эта реакция практически неосуществима при 25 ° С, стандартная теплота образования метана косвенно рассчитывается по измеренным теплотам сгорания метана, водорода и графита. На основе закона Гесса устанавливается, что теплота реакции равна разности между теплотами сгорания веществ, указанных в левой части уравнения, и теплотами сгорания веществ, указанных в правой части уравнения реакции (взятых с соответствующими знаками и стехиометрическими коэффициентами).
Помимо использования термохимических данных для решения проблем практического использования тепловой энергии, они широко применяются при теоретической оценке энергий химических связей. Этот вопрос подробно рассмотрен Л.Полингом в книге Природа химической связи (The Nature of the Chemical Bond, 1960).
Второе начало термодинамики.
Второе начало термодинамики по существу определяет однонаправленность переноса теплоты в разнообразных процессах, происходящих спонтанно при определенных условиях, а именно – направление переноса теплоты от тел с высокой температурой к телам с низкой температурой. Второе начало термодинамики может быть сформулировано следующим образом: не может быть спонтанного общего переноса теплоты от тел менее нагретых к телам более нагретым.
Перенос теплоты Q от источника с температурой Т можно охарактеризовать величиной Q/T. Для любого спонтанного процесса переноса теплоты, при котором источник с температурой Т1 отдает количество теплоты Q1, а в результате переноса система с температурой Т2 получает количество теплоты Q2, справедливо неравенство Клаузиуса Q1/Т1 Ј Q2 /Т2 . Таким образом, для того чтобы мог происходить перенос теплоты, Т1 должна быть больше Т2. Для перехода системы из одного состояния в другое более общая формулировка второго начала термодинамики гласит, что направление переноса теплоты определяется условием
где S2 – S1 – разность энтропий системы в двух состояниях. Если скомбинировать это условие с уравнениями (2) и (3), получим соотношение, имеющее важное значение для описания химической реакции при постоянных температуре и давлении:
Если ввести функцию состояния системы
то формулировка второго начала термодинамики примет следующую форму:
Это значит, что для системы, находящейся при постоянных температуре и давлении, могут происходить только такие переходы из одного состояния в другое, для которых полезная работа We не превышает определенной максимальной величины, равной разности D G двух значений G. Если G1 > G2, то переход из состояния 1 в состояние 2 (скажем, от реагентов к продуктам) может происходить самопроизвольно даже при We = 0. Если G2 > G1, то переход из состояния 1 в состояние 2 может быть осуществлен только за счет внешней полезной работы; это значит, что работа We должна быть отрицательной величиной, как, например, электрическая энергия, затрачиваемая при электролитическом разложении воды. Если G1 = G2, то система находится в равновесии.
Функция G называется гиббсовой энергией, или изобарно-изотермическим потенциалом. Разнообразными методами было показано, что величина D G ° , «стандартная гиббсова энергия образования», по аналогии со стандартной энтальпией образования может быть определена для химических соединений относительно элементов из данных по химическим равновесиям и химическим процессам. Стандартная гиббсова энергия образования D G ° , характеризующая какую-либо химическую реакцию, может быть установлена с помощью таблиц стандартных гиббсовых энергий образования путем вычитания суммы их значений для реагентов из суммы значений для продуктов. Значения D G ° для чистых химических элементов при 25 ° С и давлении 1 атм принимаются равными нулю.
Стандартная гиббсова энергия химической реакции по существу является мерой того, насколько реагенты и продукты далеки от равновесия друг с другом при данной температуре и стандартном давлении 1 атм. Согласно второму началу термодинамики, все самопроизвольные изменения системы и ее окружения стремятся привести их в конечное состояние равновесия. Следовательно, именно изменение гиббсовой энергии, а не изменение энтальпии или внутренней энергии определяет возможность протекания химической реакции. В частности, от изменения гиббсовой энергии в ходе химической реакции зависит разность потенциалов между электродами химических источников тока.
Стандартное изменение гиббсовой энергии связано со стандартным изменением энтальпии, согласно (7), соотношением
Можно показать, что функциональная связь между D G ° для данной химической реакции и константой равновесия К, определяемой законом действующих масс, имеет вид
где R – универсальная газовая постоянная, равная 1,987 Ч 10 — 3 ккал/(K Ч моль). С учетом формулы (9) это соотношение можно представить в эквивалентной форме:
Таким образом, константа равновесия состоит из двух множителей, один из которых содержит энтальпию реакции (или, при определенных условиях, внутреннюю энергию реакции), а другой – энтропию.
Важное следствие общей термодинамической теории состоит в том, что можно вывести уравнение, связывающее зависимость D G ° (и следовательно, К) от температуры со значением D H ° . Поэтому можно точно установить направление и равновесное состояние химической реакции при одной температуре из известных данных по химическому равновесию при другой температуре. В частности, изменение D G ° с температурой пропорционально величине D H ° и имеет противоположный знак. Так, все эндотермические реакции ( D H ° положительна) ускоряются (большая отрицательная величина D G ° и большее значение К) с ростом температуры. Соответственно все экзотермические реакции замедляются с ростом температуры.
Третье начало термодинамики.
Еще один важный принцип химической термодинамики был установлен в первой четверти 20 в. В.Нернстом. Он экспериментально установил, что, когда температура приближается к абсолютному нулю, стандартные энтропии D S ° для многих химических реакций стремятся к нулю. Поскольку этот результат не следует из первого и второго начал термодинамики, он получил название третьего начала термодинамики. Оно не имеет столь же общего характера, как первые два начала, однако большинство очевидных исключений или аномалий получило удовлетворительное объяснение с учетом особенностей кристаллического строения конкретных веществ.
Значение принципа Нернста состоит в том, что зависимость энтропии реакции от температуры может быть выведена, согласно термодинамической теории, исключительно из данных по теплоемкости для отдельных участвующих в реакции веществ. Это значит, что, если известно значение D S ° при какой-либо одной температуре (при T = 0 D S ° = 0), значения энтропии реакции при других температурах вычисляются исключительно из тепловых измерений. Аналогично этому, величина D H ° может быть получена из калориметрических данных путем непосредственного измерения теплоты данной реакции либо косвенно, путем измерения теплот других реакций и применения закона Гесса. Следовательно, подстановка полученных значений D H ° и D S ° в уравнение (9) или (11) дает гиббсову энергию или константу химического равновесия исключительно из тепловых измерений. Это позволяет предвидеть направление и равновесное состояние химической реакции еще до того, как найден способ ее проведения.
Для практического применения третьего начала термодинамики требуются точные результаты измерений теплоемкости вплоть до самых низких доступных температур, желательно до температуры жидкого гелия (около 4 К). Это направление термодинамических исследований химических явлений стимулировали криогенные исследования, выполненные в последние десятилетия. См. также ФИЗИКА НИЗКИХ ТЕМПЕРАТУР.
Исаев С.И. Курс химической термодинамики. М., 1975
Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М., 1975
Еремин Е.Н. Основы химической термодинамики. М., 1978
Термодинамика и кинетика химических процессов. Л., 1981
Глазов В.М., Павлова Л.М. Химическая термодинамика и фазовые равновесия. М., 1988
Конспект лекции на тему «Химическая термодинамика»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ЛЕКЦИЯ № 4 ПОНЯТИЕ О ХИМИЧЕСКОЙ ТЕРМОДИНАМИКЕ
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Термодинамика – это наука, изучающая превращения одних видов энергии в другие. Изучением этих превращений, применительно к химическим реакциям и физико-химическим процессами занимается химическая термодинамика.
Химические процессы могут протекать с поглощением или выделением энергии, причем эта энергия может поглощаться или выделяться в виде теплоты, света, электричества. Чаще всего это тепловая энергия. Раздел химии, изучающий тепловые эффекты химических реакций, называется термохимией.
Количество тепла, которое может выделяться или поглощаться в химическом процессе, называется тепловым эффектом реакции Q. Тепловой эффект реакции выражается в КДж/моль. В зависимости от знака Q различают экзотермические и эндотермические реакции.
Экзотермические реакции протекают с выделением теплоты (Q>0). В них внутренняя энергия реагирующих частиц переходит в тепловую энергию окружающей среды.
Эндотермические реакции с поглощением теплоты (Q
Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями. В термохимических уравнениях указывается фазовое состояние реагирующих и образующихся веществ, а стехиометрические коэффициенты могут быть дробными.
Выделение теплоты при взаимодействии различных веществ указывает на то, что эти вещества еще до реакции в скрытой форме обладали определенным запасом энергии. Такая форма энергии, высвобождающаяся в ходе химических реакций и физических процессах, называется внутренней энергией U . Внутренняя энергия U выражается в КДж/моль. Внутренняя энергия складывается из потенциальной и кинетической энергии частиц, образующих данное вещество или систему. U = E кин + E потен
Кинетическая энергия — это энергия поступательного, вращательного и колебательного движения ядер и электронов в атомах.
Потенциальная энергия обусловливается силами отталкивания и притяжения между частицами, входящими в состав ядер, атомов, молекул. Внутренняя энергия зависит от природы вещества, массы, температуры. Она является мерой кинетической энергии и объема, от которого зависит потенциальная энергия, т.е. U = f ( V , T ). Определить или рассчитать абсолютную величину U невозможно, т.к. нельзя перевести систему в состояние лишенное энергии, но можно определить изменение ∆ U в любом процессе.
Например, если некоторая система за счет поглощения теплоты Q переходит из состояния 1 в состояние 2, то эта теплота расходуется на изменение внутренней энергии системы ∆ U и на совершение работы против внешних сил (в химических реакциях под А против внешних сил подразумевают А против внешнего давления) А: Q = ∆ U + А . Где ∆ U = U 2 – U 1 , А = р ∆ V , где р -давление, ∆ V изменение объема

Приведенное уравнение выражает закон сохранения энергии.
При изохорном процессе V = const , следовательно А = 0, не совершается никакая работа, тогда тепловой эффект равен изменению внутренней энергии: QV = ∆ U .
При изобарном процессе р = const А = р ( V 2 – V 1 ). Тогда математическое выражение для теплового эффекта химической реакции примет вид:
Где Н2 – энтальпия системы в конечном состоянии
Н1 – энтальпия системы в начальном состоянии
тогда ∆Н – изменение энтальпии.
Т.о. энтальпия – это термодинамическая величина, определяющая энергию необходимую для перевода системы из одного состояния в другое и учитывающая изменение внутренней энергии и совершаемую работу. Энтальпия, как и все термодинамические величины, является функцией состояния, т.к. ее изменение определяется только начальным и конечным состоянием системы и не зависит от путей перехода.

Для экзотермических реакций ∆Н 0, для эндотермических ∆Н > 0, Q
Для сравнения термодинамических величин различных процессов изменение Н и U относят к стандартным условиям (Т = 298 0 К, Р = 101,3 КПа). Изменение энтальпии при образовании в стандартных условиях 1 моля химического соединения из устойчивых простых веществ называется стандартной энтальпией образования ∆Н 0 298 КДж/моль. Энтальпии образования устойчивых простых веществ (Н2, О3, Са) условно приняты равными 0.
Термохимические расчеты осуществляются на основании закона Гесса и 2-х следствий из него.
Закон Гесса: Тепловой эффект химической реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от числа и характера промежуточных стадий.
Классическая термодинамика изучает обратимые процессы, отсюда
1-е следствие: Энтальпия образования химического соединения равна по абсолютной величине и противоположна по знаку энтальпии разложения этого соединения: ∆Н обр. = — ∆Н разл.
2-е следствие: Изменение энтальпии химической реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Для реакции общего вида
а А + b B = с С + d D ,
где а, b , с, d – стехиометрические коэффициенты
А, B – исходные вещества,
С, D – продукты реакции,
математическое выражение 2-е следствия из закона Гесса будет иметь вид:
∆Н х.р. = (с ∆Н 0 298С + d ∆Н 0 298 D ) – (а ∆Н 0 298А + b ∆Н 0 298 B )
Можно было бы предположить, что самопроизвольно протекают только те реакции, в которых энтальпия системы уменьшается. Однако известны экзотермические реакции, не протекающие при высоких температурах и эндотермические реакции, происходящие при небольших температурах. Следовательно, возможность самопроизвольного протекания процесса определяется не только изменением энтальпии, но и другой термодинамической величиной, которая называется энтропией.
Энтропия S (Дж /моль К) характеризует стремление системы перейти из более упорядоченного состояния в менее упорядоченное состояние и является количественной характеристикой степени неупорядоченности системы.
Энтропия является функцией состояния и ее изменение подчиняется 2-му следствию из закона Гесса. Для термохимических расчетов изменение энтропии приводят к стандартным условиям. Энтропия в этих условиях называется стандартной и обозначается S 0 298 .
В отличие от энтальпии энтропия простых веществ не равна 0; ее абсолютные значения можно определить экспериментально; энтропия зависит от температуры.
Т.о. система самопроизвольно может переходить в термодинамически более устойчивое состояние 2-мя способами:
1 – уменьшением энтальпии (количественно характеризуется энтальпийным фактором ∆Н),
2 – увеличением энтропии (количественно характеризуется энтропийным фактором Т∆ S ).
В состоянии термодинамического равновесия оба эти фактора компенсируют друг друга и тогда справедливо равенство: ∆Н = Т∆ S , на основании, которого можно рассчитать температуру, при которой установится равновесие: Т = ∆Н / ∆ S .
Возможность самопроизвольного протекания процесса в прямом или обратном направлении определяется разностью ∆Н — Т∆ S . Чем больше эта разность, тем выше вероятность протекания процесса. Поэтому эту разность называют движущей силой процесса или изменением энергии Гиббса и обозначают ∆G (КДж/моль), т.е. ∆G = ∆Н — Т∆ S .
Энергия Гиббса зависит от природы веществ, их количества и температуры. Абсолютную величину энергии Гиббса определить нельзя, но можно определить ее изменение в каком либо процессе, т.е. ∆G является функцией состояния, и к ней применимо второе следствие из закона Гесса. Для сравнения ∆G различных процессов, ∆G приводят к стандартным условиям.
Изменение энергии Гиббса при образовании в стандартных условиях 1 моля химического вещества из устойчивых простых веществ называется стандартной энергией Гиббса и обозначается ∆G 0 298. Размерность этой величины КДжмоль -1 .
Стандартные энергии Гиббса простых веществ принимаются равными 0.
Характер изменения стандартной ∆G 0 298 при химических реакциях позволяет судить о возможности протекания процесса в прямом или обратном направлении.
При ∆G = 0 система находится в состоянии термодинамического равновесия
При ∆G > 0 процесс самопроизвольно протекает в обратном направлении
Т.о. условием самопроизвольного протекания процесса является уменьшение ∆G системы.
Зависимость направленности процессов от соотношения ∆Н и Т∆ S
Из уравнения ∆G = ∆Н — Т∆ S , видно, что самопроизвольно протекают любые реакции (∆G S > 0). При других сочетаниях ∆Н и ∆ S возможность протекания реакции определяется соотношением энтропийного и энтальпийного факторов.
При низких температурах Т∆ S принимает небольшие значения Þ при условии ∆Н > Т∆ S самопроизвольно могут протекать экзотермические реакции.
При высоких температурах, при которых множитель Т∆ S велик, самопроизвольно могут протекать эндотермические реакции, если ∆Н S .
Строение атома, химическая связь
Основные положения квантовой механики. Квантово-механическая модель атома. Атомная орбиталь. Характеристика энергетического состояния электрона системой квантовых чисел. Принцип Паули. Принцип минимума энергии. Основное и возбужденное состояние атома. Периодический закон и Периодическая система Д.И. Менделеева в свете квантовой теории строения атома. S-, р-, d-, f- элементы. Понятие об энергии ионизации, сродстве к электрону, электроотрицательности.
Метод валентных связей. Механизм образования ковалентной химической связи. Валентность, максимальная валентность. Понятие о гибридизации атомных орбиталей. Геометрия молекул. Полярность и поляризуемость связи. Метод молекулярных орбиталей. Водородная связь. Роль водородной связи в процессах ассоциации, растворения, в биологических процессах.
Тесты по темам КСР
Химическая термодинамика
1. Химическая термодинамика определяет:
а) тепловые эффекты различных химических и физико – химических процессов;
б) вероятность самопроизвольного протекания химического процесса в том или ином направлении;
в) скорость протекания химического процесса;
г) условия, при которых химическая реакция будет находиться в состоянии равновесия.
2. Изучение протекания химических реакций с позиции термодинамики не требует сведений о:
а) строении молекул веществ, участвующих в реакции;
б) механизме протекающей реакции;
в) начальном и конечном состоянии системы;
г) внешних условиях, в которых находится система.
3. Под термодинамической системой подразумевают:
а) набор свойств изучаемого объекта;
б) окружающий нас внешний мир;
в) избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от внешней среды определенной границей или поверхностью раздела;
г) реакционный сосуд, в котором протекает химическая реакция, вместе с окружающей его внешней средой.
4. Внешней средой по отношению к термодинамической системе является:
а) та часть пространства, в котором осуществляется изучаемый процесс;
б) окружающая ее граница раздела, например, стенки реакционного сосуда;
в) все то, что находится вне поверхности раздела системы;
г) совокупность молекул, атомов или ионов химических веществ, участвующих в реакции.
5. Поверхность раздела термодинамической системы:
а) всегда бывает реальной;
б) является механически жесткой, т.е. неспособной изменять свои размеры;
в) может быть воображаемой или условной;
г) может быть проницаемой и теплопроводной.
6. Изолированные системы обмениваются с внешней средой:
а) только веществом;
б) только энергией;
в) как веществом, так и энергией;
г) не способны обмениваться ни тем ни другим.
7. Закрытые системы обмениваются с внешней средой:
а) только веществом;
б) только энергией;
в) как веществом, так и энергией;
г) не способны обмениваться ни тем ни другим.
8. Открытые системы обмениваются с внешней средой:
а) только веществом;
б) только энергией;
в) как веществом, так и энергией;
г) не способны обмениваться ни тем ни другим.
9. К открытым системам относятся:
б) растительные и животные клетки;
в) герметический реакционный сосуд, в котором протекает химическая реакция;
г) любое животное, насекомое или растение.
10. В зависимости от своего состава термодинамические системы бывают:
в) однокомпонентные или простые;
г) многокомпонентные или сложные.
11. Примером простой системы является:
а) сосуд с водой, в котором плавают кусочки льда;
б) земная атмосфера;
в) сосуд, полностью заполненный определенной органической жидкостью;
г) любой водный раствор вещества.
12. Примером сложной термодинамической системы является:
а) трехфазная система «лед – вода – пар»;
б) земная атмосфера;
в) любой водный раствор того или иного вещества;
г) реакционный сосуд, в котором одновременно присутствуют как исходные, так и конечные вещества.
13. Гомогенной термодинамической системой является:
а) земная атмосфера;
б) любой водный раствор того или иного вещества;
в) человеческий организм;
г) совокупность воды, льда и водяных паров.
14. Гетерогенной термодинамической системой является:
а) совокупность двух неограниченно смешивающихся жидкостей;
б) любые металлические сплавы;
в) человеческий организм;
г) совокупность двух несмешивающихся между собой жидкостей.
15. Фазой называется:
а) определенное агрегатное состояние вещества;
б) любое индивидуальное вещество в многокомпонентной системе;
в) совокупность всех однородных по составу и свойствам частей гетерогенной системы;
г) любая часть системы, отделенная от других ее частей определенной поверхностью раздела.
16. Гомогенные системы:
а) могут быть только однокомпонентными;
б) могут быть как однокомпонентными, так и многокомпонентными;
в) всегда состоят из одной фазы;
г) могут состоять из нескольких фаз.
17. Гетерогенные системы:
а) не могут быть однокомпонентными;
б) не могут состоять из одной фазы;
в) всегда являются многокомпонентными;
г) могут быть как однокомпонентными, так и многокомпонентными.
18. Макроскопическим параметром термодинамической системы является:
а) ее температура;
в) совокупность значений размеров и положений в пространстве всех составляющих систему частиц;
г) совокупность значений скоростей движения всех кинетически активных частиц системы.
19. К микроскопическим параметрам системы относятся:
а) ее геометрические размеры, например, объем;
б) величина ее внутренней энергии;
в) совокупность значений масс всех составляющих ее частиц;
г) совокупность значений скоростей движения всех кинетически активных частиц системы.
20. Примером экстенсивного термодинамического параметра является:
а) масса термодинамической системы;
б) объем термодинамической системы;
в) температура термодинамической системы;
г) величина внутренней энергии системы.
21. Примером интенсивного термодинамического параметра является:
а) масса термодинамической системы;
б) объем термодинамической системы;
в) давление в гомогенной термодинамической системе;
г) плотность в гомогенной термодинамической системе.
22. Стационарное состояние характерно:
а) только для изолированных систем;
б) для любой термодинамической системы;
в) для открытых термодинамических систем;
г) для закрытых термодинамических систем.
23. Равновесное состояние системы характерно:
а) только для изолированных систем;
б) для любой термодинамической системы;
в) для открытых термодинамических систем;
г) для закрытых термодинамических систем.
24. Равновесным является такое состояние системы, при котором:
а) все ее термодинамические параметры остаются неизменными и отсутствует обмен энергией и веществом с внешней средой;
б) наблюдается равноценный в обе стороны обмен энергией или веществом с внешним миром;
в) только с внешней средой отсутствует обмен энергией в том или ином направлении;
г) ее качественный состав остается неизменным.
25. Любое термодинамическое состояние системы может быть выражено:
а) только набором значений ее макроскопических параметров;
б) только набором значений ее микроскопических параметров;
в) как набором значений макроскопических параметров, так и набором значений микроскопических параметров;
г) в зависимости от вида системы либо только набором микроскопических параметров, либо только набором макроскопических параметров
26. Термодинамическим процессом называется:
а) изменение во времени значений одного или нескольких микроскопических параметров системы;
б) переход системы из одного равновесного состояния в другое;
в) изменение во времени значений одного или нескольких макроскопических параметров системы;
г) сохранение во времени неизменными численные значения макроскопических параметров системы.
27. Процессы, для протекания которых не требуется оказание на систему внешнего воздействия, называются:
28. Реальные процессы, протекающие в природе и в организме человека, с точки зрения термодинамики могут быть:
а) термодинамически обратимыми и равновесными;
г) термодинамически необратимыми и неравновесными.
29. Внутренняя энергия системы:
а) является суммой потенциальной и кинетической энергий всех составляющих ее частиц;
б) может быть легко охарактеризована абсолютным численным значением;
в) остается неизменной в ходе совершения термодинамического процесса;
г) является составной частью полной или общей энергии системы.
30. При протекании термодинамических процессов внутренняя энергия системы:
а) всегда остается неизменной;
б) всегда уменьшается;
в) всегда увеличивается;
г) может как уменьшаться, так и увеличиваться.
31. Между внешней средой и термодинамической системой обмен энергией может осуществляться:
а) за счет передачи теплоты;
б) за счет совершения работы;
в) только за счет изменения размеров и объема системы;
г) только за счет неупорядоченного, хаотического движения структурных единиц веществ, входящих в состав системы и внешней среды.
32. Работа расширения, совершающаяся внутренними силами системы против внешних сил:
а) всегда считается положительной;
б) всегда считается отрицательной;
в) может быть как положительной, так и отрицательной;
г) всегда равна нулю.
33. Работа сжатия, совершающаяся внешними силами против внутренних сил системы:
а) всегда считается положительной;
б) всегда считается отрицательной;
в) может быть как положительной, так и отрицательной;
г) всегда равна нулю.
34. При совершении системой работы расширения ее внутренняя энергия:
а) остается неизменной;
б) может как уменьшаться, так и увеличиваться;
35. При совершении над системой внешними силами работы сжатия ее внутренняя энергия:
а) остается неизменной;
б) может как уменьшаться, так и увеличиваться;
36. Адиабатными системами называются системы, в которых процесс обмена энергией с внешней средой:
а) может осуществляться только в форме теплоты;
в) может осуществляться как в форме теплоты, так и за счет совершения работы;
г) может осуществляться только за счет совершения работы.
37. Термодинамический процесс, протекающий при постоянном объеме, называется:
38. Термодинамический процесс, протекающий при постоянном давлении, называется:
39. Согласно первому закону термодинамики:
а) производимая системой работа всегда больше, чем теплота, затраченная на ее производство;
б) производимая системой работа всегда равна теплоте, затраченной на ее производство;
в) производимая системой работа всегда меньше, чем теплота, затраченная на ее производство;
г) возможен двигатель, совершающий сколь угодно долго работу, без подведения энергии извне.
40. В изохорных процессах:
а) объем системы остается неизменным;
б) не совершается работа расширения или сжатия системы;
в) поглощенная или выделенная системой теплота равна изменению ее внутренней энергии;
г) совершается работа расширения или сжатия системы.
41. В изобарных процессах:
а) объем системы изменяется;
б) совершается только работа расширения;
в) совершается работа расширения или сжатия системы;
г) выделившаяся или поглощенная теплота не может быть определена только за счет изменения внутренней энергии системы.
42. Энтальпия по своему численному значению:
а) равна внутренней энергии системы;
б) больше внутренней энергии системы на величину работы расширения, совершенной при изменении объема системы от 0 до V;
в) меньше внутренней энергии системы на величину работы сжатия, совершенную при изменении объема системы от V до 0;
г) может как совпадать с внутренней энергией, так и отличаться от нее в ту или другую сторону.
43. Тепловой эффект химической реакции, протекающей при постоянном объеме:
а) всегда равен 0;
б) определяется изменением внутренней энергии системы;
в) определяется изменением энтальпии системы;
г) определяется работой, совершенной внешними силами над системой.
44. Тепловой эффект химической реакции, протекающей при постоянном давлении:
а) всегда равен 0;
б) определяется изменением внутренней энергии системы;
в) определяется изменением энтальпии системы;
г) определяется работой, совершенной внешними силами над системой.
45. Энтальпия системы определяется соотношением:
46. Термохимическим является следующее уравнение химической реакции:
47. Термодинамической формой записи уравнения химической реакции является:
48. Термохимией называется:
а) раздел физической химии, изучающий влияние температуры на направление протекания химической реакции;
б) раздел физической химии, изучающий влияние температуры на скорость протекания химической реакции;
в) раздел физической химии, изучающий влияние температуры на скорость установления химического равновесия;
г) раздел химической термодинамики, изучающий тепловые эффекты химических реакций.
49. Выражение: «Тепловой эффект химической реакции не зависит от пути ее осуществления, а определяется только начальным и конечным состоянием системы» является формулировкой:
а) первого начала термодинамики;
б) второго начала термодинамики;
в) закона сохранения энергии;
50. Стандартными условиями в термодинамике являются:
а) t = 0 0 C и р = 273 кПа;
б) t = 25 0 C и р = 120 кПа;
в) Т = 298К и р = 101,325 кПа;
г) t = 25 0 C и р = 101325 Па.
51. Согласно следствию из закона Гесса, тепловой эффект химической реакции равен:
а) сумме теплот образования конечных веществ за вычетом суммы теплот образования исходных веществ с учетом их стехиометрических коэффициентов;
б) сумме теплот образования исходных веществ за вычетом суммы теплот образования конечных с учетом их стехиометрических коэффициентов;
в) сумме теплот образования конечных и исходных веществ с учетом их стехиометрических коэффициентов;
г) сумме теплот образования конечных веществ с учетом их стехиометрических коэффициентов.
52. Теплота образования простого вещества:
а) определяется опытным путем;
б) равна тепловому эффекту химической реакции, в ходе которой образуется 1 моль этого вещества;
в) принята равной нулю;
г) может быть рассчитана теоретически.
53. Согласно следствию из закона Гесса, тепловой эффект химической реакции равен:
а) сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания конечных веществ с учетом их стехиометрических коэффициентов;
б) сумме теплот образования исходных веществ за вычетом суммы теплот образования конечных с учетом их стехиометрических коэффициентов;
в) сумме теплот образования конечных и исходных веществ с учетом их стехиометрических коэффициентов;
г) сумме теплот образования конечных веществ с учетом их стехиометрических коэффициентов.
54. Закон Гесса и следствия из него позволяют:
а) рассчитать тепловой эффект реакции, если известны теплоты образования конечных и исходных веществ;
б) определить механизм химической реакции;
в) рассчитать тепловой эффект процессов, которые практически измерить невозможно;
г) рассчитать теоретически теплоты образования сложных веществ, которые невозможно получить из соответствующих простых веществ.
55. Для экзотермической реакции:
а) ∆Н(химической реакции) > 0;
б) ∆Н(химической реакции) 0;
б) ∆Н(химической реакции) 0;
б) ∆S 0 могут самопроизвольно протекать:
а) только в области высоких температур;
б) только в области низких температур;
г) при любом значении Т.
69. Процессы, для которых ∆Н>0и ∆S>0 могут самопроизвольно протекать:
а) только в области высоких температур;
б) только в области низких температур;
г) при любом значении Т.
70. Процессы, для которых ∆Н 0;
в) ∆G 0, а ∆S 3 , ∆G образования вещества можно рассчитать по уравнению:
81. На смещение химического равновесия обратимой реакции может оказать влияние:
а) изменение температуры;
б) изменение давления;
в) изменение концентрации исходных или конечных веществ;
г) добавление катализатора.
82.На смещение равновесия обратимой реакции всегда оказывает влияние:
а) изменение давления;
б) изменение температуры;
в) изменение концентрации исходных веществ;
г) добавление катализатора.
83. Химическое равновесие смещается вправо, когда:
а) скорость прямой реакции становится больше скорости обратной реакции;
б) скорость прямой реакции становится меньше скорости обратной реакции;
в) скорость обратной реакции становится больше скорости прямой реакции;
г) скорость обратной реакции становится меньше скорости прямой реакции.
84. При увеличении давления равновесие реакции 2NO + O2 « 2NO2 сместится:
85. Для смещения химического равновесия обратимой реакции 4HCl(газ) + О2 (газ) « 2Cl2(газ) + 2Н2О(газ) + Q влево необходимо:
а) уменьшить температуру;
б) уменьшить давление;
в) уменьшить концентрацию исходных веществ;
г) уменьшить концентрацию продуктов реакции.
86. Куда сместится равновесие обратимой реакции 2NO + O2 « 2NO2 при добавлении катализатора?
87. При наступлении химического равновесия:
а) скорости прямой и обратной реакций становятся равными;
б) прямая и обратная реакции прекращаются;
в) концентрации исходных веществ и продуктов реакции становятся равными;
г) концентрации исходных веществ и продуктов реакции остаются неизменными.
88. При понижении давления химическое равновесие обратимой реакции 3Н2 + N2 « 2 NH3 + Q сместится:
89. Для смещения равновесия обратимой реакции 2SO2(газ) + O2(газ) « 2SO3(газ) вправо необходимо:
а) увеличить давление;
б) уменьшить давление;
в) добавить катализатор;
г) уменьшить концентрацию SO3.
90. Для каких обратимых реакций увеличение давления сместит химическое равновесие вправо?
91. Для смещения влево равновесия обратимой реакции 2SO2(газ) + O2(газ) « 2SO3(газ) + Q необходимо:
а) увеличить концентрацию SO2;
б) увеличить температуру;
в) уменьшить температуру;
г) уменьшить концентрацию О2.
92. Для каких реакций уменьшение давления смещает химическое равновесие влево:
93. В момент наступления химического равновесия при протекании реакции 2А(г) + В(г) ↔ С(г) концентрации веществ были, соответственно, равны: 0,1 моль/дм 3 ; 0,2 моль/дм 3 ; 0,8 моль/дм 3 . Величина константы равновесия реакции равна:
94. В момент наступления химического равновесия при протекании реакции 2А(г) + В(г) ↔ 2С(г) концентрации веществ были, соответственно, равны: 0,5 моль/дм 3 ; 1,5 моль/дм 3 ; 2,5 моль/дм 3 . Исходная концентрация вещества А равна:
95. В каком случае и увеличение давления, и понижение температуры смещает химическое равновесие вправо?
96. В каком случае увеличение давления смещает химическое равновесие вправо, а увеличение температуры – влево?
97. При повышении температуры в системе 3Н2 (газ) + N2 (газ) «
« 2 NH3(газ) + Q, находящейся в состоянии равновесия:
а) скорость прямой реакции увеличится;
б) скорость обратной реакции уменьшится;
в) скорость обратной реакции увеличится;
г) равновесие сместится влево.
98. В течение промежутка времени от начала обратимой реакции до момента наступления химического равновесия:
а) скорость прямой реакции возрастает, а обратной – уменьшается;
б) скорость прямой реакции уменьшается, а обратной – возрастает;
в) концентрации исходных и конечных веществ уменьшаются;
г) концентрации исходных веществ уменьшаются, а конечных продуктов – возрастают.
99. Практический выход продуктов в обратимой реакции определяется:
а) только скоростью протекания прямой реакции;
б) временем от начала ее протекания до наступления равновесия;
в) величиной константы равновесия;
г) только скоростью протекания обратной реакции.
100. Во сколько раз скорость прямой реакции станет меньше скорости обратной реакции при уменьшении давления в равновесной системе: 2А(г) + В(г)↔ С(г) в 3 раза?
http://infourok.ru/konspekt-lekcii-na-temu-himicheskaya-termodinamika-5198647.html
http://lektsii.org/9-53678.html