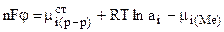Термодинамика гальванического элемента.
Пусть в электрохимическом элементе протекает реакция вида:
Работа, производимая элементом при растворении 1 моля вещества М, определяется произведением величины заряда q = n 
A = n 
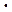
где Е — ЭДС гальванического элемента, В.
Если элемент работает обратимо в условиях р = const, то
A = n 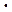
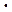

Из (9.2) очевидно, что Е определяется величиной А. Дифференцируя (9.2):
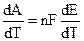
и подставляя (9.3) в уравнение Гиббса — Гельмгольца (4.72):
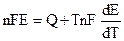
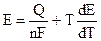
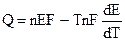
Уравнения (9.5) — это уравнения Гиббса — Гельмгольца для гальванического элемента.
Тепловой эффект химической реакции, происходящей в гальваническом элементе в соответствии с (9.5) может быть представлен в виде:
где Q’ — часть теплового эффекта химической реакции.
В соответствии с (9.5):
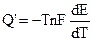
Итак, если при работе гальванического элемента энергия выделяется в окружающую среду (Q’ > 0), то 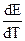
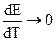
В соответствии с системой знаков, принятой в термохимии Q’ = -q, поэтому:
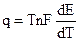
где q = T 
Величина 
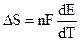
Работа химической реакции, протекающей в гальваническом элементе, связана с изменением активностей ионов в растворе, поэтому применение уравнения изотермы химической реакции дает:
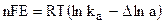
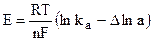
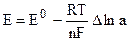
где 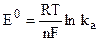
Для гальванического элемента Даниэля — Якоби, в котором протекает реакция
Zn + Cu 2+ = Zn 2+ + Cu,
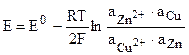
Активность чистых металлов постоянна и принимается единичной, поэтому ЭДС элемента Даниэля — Якоби равна
Определение термодинамических характеристик электрохимических цепей
Лабораторная работа № 1
Определение термодинамических характеристик электрохимических цепей.
Система, состоящая из двух электродов, помещенных в раствор электролита, которая при соединении электродов вне электролита каким-либо металлическим проводником создает во внешней цепи электрический ток, называется гальваническим (или электрохимическим) элементом.
Условная запись (схема) гальванического элемента
Для описания гальванических элементов применяется условная запись, в соответствии с которой сначала указывается материал одного из электродов, далее – раствор, в который помещен этот электрод, затем раствор, в который погружен второй электрод, и, наконец, материал другого электрода. Электроды отделяются от раствора сплошной вертикальной линией, а растворы разделяются либо двумя вертикальными линиями, когда считают, что на границе растворов нет скачка потенциала, либо пунктирной линией, когда таким скачком пренебречь нельзя. Так, медно-цинковый элемент может быть записан следующим образом:
где знаки + и – указывают полярность электродов; c1 и c2 – концентрации растворов.
При большой разнице между c1 и c2, когда нельзя пренебречь скачком потенциала на границе двух растворов, этот элемент записывают в другом виде:
(-)Zn½ZnSO4
В тех же случаях, когда хотят указать только участвующие в электродных реакциях ионы, запись упрощают:
Для обратимо работающего гальванического элемента ток всегда должен идти слева направо, а на концах быть один и тот же металл.
Устройство медно-цинкового гальванического элемента (элемента Даниэля-Якоби) показано на рисунке.
Рисунок — Медно-цинковый элемент (элемент Даниэля-Якоби):
1 – пористая диафрагма; 2 – цилиндрический электрод из листового цинка; 3 – медный электрод.
При замыкании электродов через внешнюю цепь на медном электроде пойдет процесс восстановления меди:
а на цинковом электроде – процесс окисления цинка:
Электроны, остающиеся на электроде при реакции окисления, будут перетекать во внешней цепи от цинка к меди, где будут участвовать в процессе восстановления меди. В растворе при работе гальванического элемента ток будет переноситься ионами меди и цинка, движущимися к цинковому электроду, и сульфат-ионами, движущимися к медному электроду.
Равновесные потенциалы медного и цинкового электродов связаны с активностями ионов меди и цинка в растворе уравнением Нернста:
Электродвижущая сила (ЭДС) гальванического элемента. Стандартная ЭДС
Разность равновесных потенциалов электродов гальванического элемента называется электродвижущей силой этого элемента. Для элемента Даниэля-Якоби это можно выразить:

где 
Стандартная ЭДС обратимо работающего гальванического элемента равна разности стандартных потенциалов отдельных электродов гальванического элемента, причем, так как ЭДС всегда положительная величина, от положительного потенциала отнимается отрицательный потенциал.
Вывод уравнения Нернста для гальванического элемента
Если в электрохимической системе обратимо и изотермически протекает следующая реакция:

при 
и обратимая ЭДС ( ЕP, T) системы определяется как:
В то же время изменение энергия Гиббса реакции определяется формулой:
и так как 
где 
В состоянии равновесия при данных давлении и температуре 
Если активности всех компонентов равны единице (аi=1), то 


где Ка — константа равновесия реакции. Из этого следует, что:
Если аi = 1, то 
где Е0 — стандартная ЭДС. Полученное после подстановки уравнение называется уравнением Нернста:


Обратимые и необратимые гальванические элементы
Гальванические элементы могут быть обратимыми и необратимыми. Гальванический элемент является обратимым, если токообразующая реакция в элементе может быть обращена в противоположном направлении при приложении к нему извне ЭДС, превышающей собственную ЭДС элемента на бесконечно малую величину. Примером обратимых гальванических элементов может служить элемент Даниэля-Якоби (если пренебречь переходом ионов через границу растворов):
В этом элементе при его работе будет иметь место реакция:
Zn + CuSO4 ® Cu + ZnSO4
Если к элементу приложить внешнюю ЭДС, противоположно направленную относительно ЭДС элемента, то в нем будет идти реакция:
Cu + ZnSO4 ® CuSO4+ Zn,
т. е. в отличие от токообразующей реакции в элементе медь начнет растворяться, а цинк – выделяться из раствора.
Примером необратимого элемента может служить цепь:
В этом элементе при его работе будет идти процесс:
Zn + CuSO4 ® ZnSO4+Cu
Если приложить к нему внешнюю противоположно направленную ЭДС, то будет происходить процесс растворения меди на медном электроде и ее выделение на цинковом, т. е. этот процесс не будет обратным процессу при работе такого гальванического элемента.
Термодинамические характеристики гальванического элемента
Работа какого-либо обратимого процесса при определенных ограничениях, налагаемых на условия осуществления процесса, например при постоянстве температуры и давления, будет максимальной полезной работой, поэтому термодинамический расчет ЭДС возможен только в случае обратимых гальванических элементов. Зависимость максимальной полезной работы химической реакции в гальваническом элементе от температуры можно связать с уравнениями Гиббса-Гельмгольца:
Максимальная полезная работа электрохимической реакции равна
Подставляя в уравнения Гиббса-Гельмгольца вместо DG и DF их значения, выраженные через ЭДС, можно получить эти уравнения в форме, связывающей ЭДС с тепловым эффектом реакции и температурой:
где ¶Е/¶T – температурный коэффициент, который показывает во сколько раз изменяется ЭДС при увеличении температуры на 1 К.
Или, учитывая, что — DН=Qp – тепловой эффект реакции при постоянном давлении, а — DU=Qv — тепловой эффект реакции при постоянном объеме, можно получить уравнения Томсона, являющиеся частным случаем уравнений Гиббса-Гельмгольца:
В том случае, когда ЭДС гальванического элемента не зависит от температуры, т. е. (¶Е/¶T)р=0 или (¶Е/¶T)v=0, эти уравнения переходят в:
Если ¶Е/¶T > 0, то 
Термодинамика гальванического элемента
Пусть в электрохимическом элементе протекает реакция вида:
Работа, производимая элементом при растворении 1 моля вещества М, определяется произведением величины заряда q = n 

A = n 

где Е — ЭДС гальванического элемента, В.
Если элемент работает обратимо в условиях р = const, то
A = n 

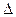
Из (9.2) очевидно, что Е определяется величиной А. Дифференцируя (9.2):

и подставляя (9.3) в уравнение Гиббса — Гельмгольца (4.72):


Уравнения (9.5) — это уравнения Гиббса — Гельмгольца для гальванического элемента.
Тепловой эффект химической реакции, происходящей в гальваническом элементе в соответствии с (9.5) может быть представлен в виде:
где Q’ — часть теплового эффекта химической реакции.
В соответствии с (9.5):
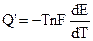
Итак, если при работе гальванического элемента энергия выделяется в окружающую среду (Q’ > 0), то 

В соответствии с системой знаков, принятой в термохимии Q’ = -q, поэтому:

где q = T 
Величина 

Работа химической реакции, протекающей в гальваническом элементе, связана с изменением активностей ионов в растворе, поэтому применение уравнения изотермы химической реакции дает:



где 
Для гальванического элемента Даниэля — Якоби, в котором протекает реакция
Zn + Cu 2+ = Zn 2+ + Cu,

Активность чистых металлов постоянна и принимается единичной, поэтому ЭДС элемента Даниэля — Якоби равна

Электродные потенциалы.
При переходе одного моля ионов из раствора на металл[5] (или обратно) совершается работа nF 





где 

Величина 


Величина стандартного потенциала, как уже указывалось ранее, служит мерой тенденции металла посылать ионы в раствор, т. е. той величиной, которую Нернст назвал электролитической упругостью растворения.
Если концентрация электролита m выражена в молях на 1 кг растворителя, то 


Наконец, если раствор сильно разбавлен, то для приближенных вычислений активность считается равной концентрации.

Знание значений электродных потенциалов позволяет рассчитать ЭДС гальванического элемента:

где 
На первый взгляд могло бы казаться, что величину потенциала электрода относительно раствора найти легко. Однако современная наука не знает путей ни для измерения, ни для вычисления абсолютных величин отдельных электродных потенциалов. Незнание абсолютных величин и знаков отдельных электродных потенциалов ни в какой степени не отражается на дальнейших выводах, и не лишает их универсальности, так как реально измеряемыми величинами являются лишь разности потенциалов. Можно выбрать какой-нибудь, но всегда один и тот же электрод и условно считать его потенциал равным нулю. По ряду веских причин в качестве нулевого всегда берут потенциал стандартного водородного электрода с давлением Н2 в 1,01 
Чаще всего, однако, потенциалы электродов измеряются не непосредственно против водородного, а против вспомагательного электрода, например каломельного или хлорсеребряного, потенциал которого относительно стандартного водородного надежно определен.
В таблице 9.1 даны величины стандартных потенциалов ряда электродов в воде при 25 0 С, главным образом по данным новых точных измерений. Число значащих цифр отвечает достоверности величин потенциалов.
Таблица 9.1. Стандартные электродные потенциалы в водных растворах при 25 0 С.
| Электрод | Электродная реакция |  , В , В | Электрод | Электродная реакция |  , В , В |
| Li + / Li | Li + + e — = Li | -3,04 | Ni 2+ / Ni | Ni 2+ + 2e — = Ni | -0,24 |
| Rb + / Rb | Rb + + e — = Rb | -2,92 | Sn 2+ / Sn | Sn 2+ + 2e — = Sn | -0,136 |
| K + / K | K + + e — = K | -2,92 | Pb 2+ / Pb | Pb 2+ + 2e — = Pb | -0,126 |
| Ba 2+ / Ba | Ba 2+ + 2e — = Ba | -2,90 | Fe 3+ / Fe | Fe 3+ + 3e — = Fe | -0,036 |
| Ca 2+ / Ca | Ca 2+ + 2e — = Ca | -2,87 | H + / H2(Pt) | H + + e — =  H2 H2 | 0,000 |
| Na + / Na | Na + + e — = Na | -2,713 | Cu 2+ / Cu | Cu 2+ + 2e — = Cu | +0,337 |
| Mg 2+ / Mg | Mg 2+ +2e — = Mg | -2,38 | Cu + / Cu | Cu + + e — = Cu | +0,52 |
| Al 3+ / Al | Al 3+ + 3e — = Al | -1,66 | Hg2 2+ / Ag |  Hg2 2+ + e — = Ag Hg2 2+ + e — = Ag | +0,798 |
| Mn 2+ / Mn | Mn 2+ +2e — = Mn | -1,18 | Ag + / Ag | Ag + + e — = Ag | +0,799 |
| Zn 2+ / Zn | Zn 2+ + 2e — = Zn | -0,763 | Hg 2+ / Hg | Hg 2+ + 2e — = Hg | +0,854 |
| Cr 3+ / Cr | Cr 3+ + 3e — = Cr | -0,74 | Br — / Br2(Pt) | Br2 + 2e — = 2Br — | +1,066 |
| Fe 2+ / Fe | Fe 2+ + 2e — = Fe | -0,44 | Cl — / Cl2(Pt) | Cl2 + 2e — = 2Cl — | +1,359 |
| Cd 2+ / Cd | Cd 2+ +2e — = Cd | -0,402 | Au 3+ / Au | Au 3+ + 3e — = Au | +1,500 |
| Co 2+ / Co | Co 2+ + 2e — = Co | -0,27 | F — /F2(Pt) | F2 + 2e — = 2F — | +2,870 |
Положительные величины 

С помощью электрохимического ряда напряжений (табл. 9.1) можно установить характер электродных реакций, знак и величину ЭДС и в том случае, если потенциалы электродов элемента отличаются от стандартных. При этом ЭДС равна разности электродных потенциалов, каждый из которых вычисляется с помощью 
Стандартный потенциал 
http://pandia.ru/text/80/353/3320.php
http://allrefrs.ru/3-13296.html