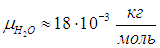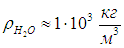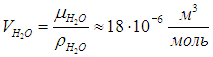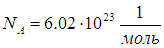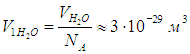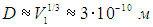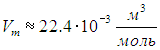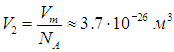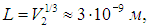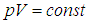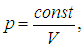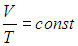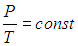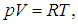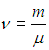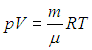Термодинамика и молекулярная физика уравнение менделеева клапейрона
Уравнение Менделеева-Клапейрона — уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT , где R — универсальная газовая постоянная,
R = 8,31 Дж/(моль . К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT,
где NА — число Авогадро, k — постоянная Больцмана.
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров — давление, объем или температура — остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.
Изотермический процесс — процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля — Мариотта.
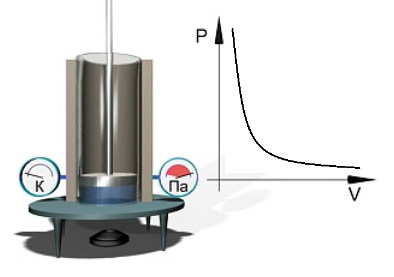
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой — термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
Изобарный процесс — процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
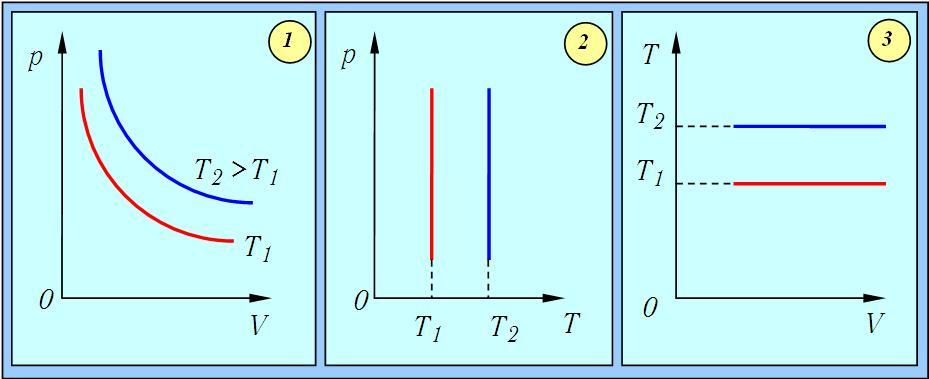
Изохорный процесс — процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Итак, из закона pV = (М/m) . RT выводятся следующие законы:
p = const => V/T = const — закон Гей — Люссака .
V= const => p/T = const — закон Шарля
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление — это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.
Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов.
В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA?
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23
PV 7,95 . 10 -4 . 3 . 10 -2
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
1.2. Уравнение Клапейрона—Менделеева
В этом разделе мы знакомимся с уравнением состояния идеального газа.
Идеальный газ — это настолько разреженный газ, что взаимодействием между его молекулами можно пренебречь.
Эксперименты показали, что при условиях не слишком отличающихся от нормальных (температура порядка сотен кельвинов, давление порядка одной атмосферы) свойства реальных газов близки к свойствам идеального газа.
Пример. На примере водяного пара покажем, что при обычных условиях свойства реальных газов близки к свойствам идеального. По таблице Менделеева можно определить массу моля Н20:
Плотность воды в жидком состоянии
Отсюда можно найти объем одного моля воды:
Один моль любого вещества содержит одно и то же число молекул (число Авогадро):
Получаем отсюда объем V1, приходящийся на одну молекулу воды:
В конденсированном состоянии молекулы располагаются вплотную друг к другу, то есть в сущности V1 есть объем молекулы воды, откуда следует оценка ее линейного размера (диаметра):
С другой стороны, известно, что объем Vm одного моля любого газа при нормальных условиях равен
Поэтому на одну молекулу водяного пара приходится объем
Это значит, что газ можно нарезать мысленно на кубики с длиной ребра
и в каждом таком кубике окажется одна молекула. Иными словами, L — среднее расстояние между молекулами водяного пара. Мы видим, что L на порядок превосходит размер D молекулы. Аналогичные оценки получаются и для других газов, так что с хорошей точностью можно считать, что молекулы не взаимодействуют друг с другом, и при нормальных условиях газ идеален.
Как уже говорилось, уравнение состояния, имеющее вид, позволяет выразить один термодинамический параметр через два других. Конкретный вид этого уравнения зависит от того, какое вещество и в каком агрегатном состоянии рассматривается. Уравнение состояния идеального газа объединяет ряд экспериментально установленных частных газовых законов. Каждый из них описывает поведение газа при условии, что изменяются лишь два параметра.
1. Закон Бойля — Мариотта. Описывает процесс в идеальном газе при постоянной температуре.
Изотермический процесс — это термодинамический процесс, протекающий при постоянной температуре.
Закон Бойля — Мариотта гласит:
Для данной массы газа при постоянной температуре Т = const произведение давления газа на занимаемый им объем является постоянной величиной
Графически изотермический процесс в различных координатах изображен на рис. 1.7.
Показанные на рис. 1.7-1 кривые представляют собой гиперболы
располагающиеся тем выше, чем выше температура газа.
Экспериментальное исследование закона Бойля — Мариотта можно выполнить с помощью установки, показанной на рис. 1.8. В цилиндре, находящемся при постоянной температуре (что видно из показаний термометра), при перемещении поршня изменяется объем газа. Давление газа измеряется с помощью манометра. Результаты измерений давления и объема газа представляются на диаграмме p = p(V).
Рис. 1.8. Экспериментальное изучение изотермического процесса в газе
2. Закон Гей-Люссака. Описывает тепловое расширение идеального газа при постоянном давлении.
Изобарный процесс — это процесс, протекающий при постоянном давлении.
Закон Гей-Люссака гласит:
Объем данной массы определенного газа при постоянном давлении пропорционален его абсолютной температуре
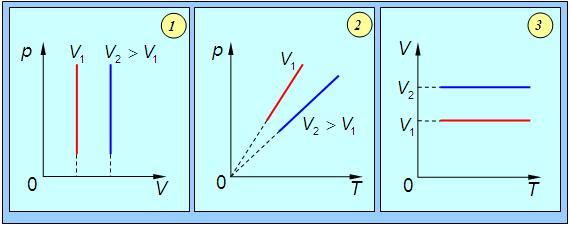
Графически изобарный процесс в различных координатах показан на рис. 1.9.
Рис. 1.9. Изобарный процесс в газе: 1 — в координатах p – V; 2 — в координатах V – T; 3 — в координатах P – T
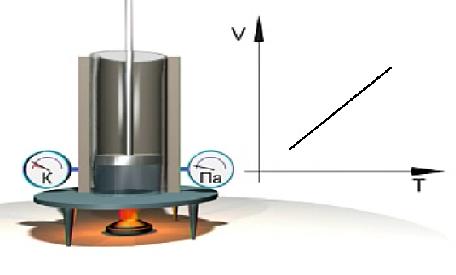
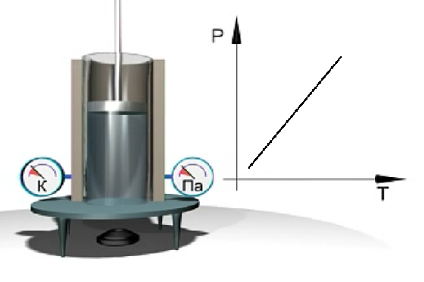
Экспериментальное изучение закона Гей-Люссака можно выполнить с помощью установки, показанной на рис. 1.10. В цилиндре газ нагревается с помощью горелки. Давление газа в процессе нагревания остается неизменным, что видно из показаний манометра. Температура газа измеряется с помощью термометра. Результаты измерений давления и температуры газа представляются на диаграмме V = V(Т).
Рис. 1.10. Экспериментальное изучение изобарного процесса в газе
3. Закон Шарля. Описывает изменение давления идеального газа с ростом температуры при постоянном объеме.
Изохорный процесс — это процесс, протекающий при постоянном объеме.
Закон Шарля гласит:
Давление данной массы определенного газа при постоянном объеме пропорционально термодинамической температуре
Графически изохорный процесс в различных координатах показан на рис. 1.11.
Рис.1.11. Изохорный процесс в газе: 1 — в координатах p – V; 2 — в координатах p – T; 3 — в координатах V – T
Экспериментальное исследование закона Шарля можно выполнить с помощью установки, показанной на рис. 1.12. В цилиндре газ занимает постоянный объем (поршень неподвижен). При нагревании давление газа увеличивается, а при охлаждении уменьшается. Величина давления измеряется с помощью манометра, а температура газа — с помощью термометра. Результаты измерений давления и температуры газа представляются на диаграмме p=p(Т).
Рис. 1.12. Экспериментальное изучение изохорного процесса в газе
Если объединить рассмотренные частные газовые законы, то получим уравнение состояния идеального газа (для одного моля)
в которое входит универсальная газовая постоянная R = 8,31 Дж/(моль· К). При одних и тех же значениях объема и температуры системы давление газа пропорционально числу молей вещества
Поэтому для произвольной массы газа m уравнение состояния идеального газа (1.6) примет вид
Это уравнение называют уравнением Клапейрона — Менделеева.
Опытные газовые законы. Закон Менделеева-Клапейрона
В основе молекулярной физике лежит ряд эмпирических (опытных) законов. Данные законы основаны на многолетних наблюдениях и особого вывода для них нет. До введения самих законов, познакомимся с понятием состояния идеального газа. Так, под состоянием идеального газа понимается совокупность термодинамических параметров, характеризующих газ в данный момент:
- — давление газа,
- — объём газа,
- — температура газа,
- — масса газа.
Если данные параметры изменяются, мы будем говорить об изменении состоянии идеального газа.
- закон Авогадро
Закон Авогадро гласит, что для любых газов, взятых при одинаковых давлениях и температурах, содержится одинаковое количество молекул. Также есть несколько следствий из этого закона: одинаковое количество молей разных газов при одинаковых условиях (давление и температура), занимают одинаковый объём (молярный объём). Для нас главный вывод данного закона состоит в том, что для любого газа, химическое количество которого равен 1 моль, количество молекул в нём равно штук — постоянная Авогадро.
- закон Бойля — Мариотта
Закон Бойля -Мариотта гласит, что при условии постоянства массы (химического количества) и температуры газа, произведение давления газа на его объём постоянно:
Альтернативная форма записи:
- где
- , — давление газа в первом и втором состоянии соответственно,
- , — объём газа в первом и втором состоянии соответственно.
Таким образом, при наших условиях, уравнение (2) связывает два любых состояния идеального газа.
- закон Гей — Люссака
Закон Гей — Люссака гласит, что при условии постоянства массы (химического количества) и давления газа, отношение объёма газа к его температуре постоянно:
Альтернативная форма записи:
- где
- , — объём газа в первом и втором состоянии соответственно,
- , — температура газа в первом и втором состоянии соответственно.
Таким образом, при наших условиях, уравнение (4) связывает два любых состояния идеального газа.
Закон Шарля гласит, что при условии постоянства массы (химического количества) и объёма газа, отношение давления газа к его температуре постоянно:
Альтернативная форма записи:
- где
- , — давление газа в первом и втором состоянии соответственно,
- , — температура газа в первом и втором состоянии соответственно.
Таким образом, при наших условиях, уравнение (6) связывает два любых состояния идеального газа.
- закон Дальтона
Закон Дальтона несколько выбивается из логики предыдущих опытных законов, т.к. он описывает не отдельный газ, а составной (так называемую смесь газов). Итак, для смеси газов: суммарное давление смеси газов равно сумме парциальных давлений каждого из его компонентов:
- где
- — давление смеси газов,
- — парциальные (одиночные) давления каждого из газов в отдельности.
На основании введённых опытных законов можно получить общее соотношение, совмещающее все параметры, характеризующие газ (уравнение Менделеева-Клапейрона):
- где
- — давление газа,
- — объём газа,
- — химическое количество газа,
- — температура газа,
- м *кг*с *К *Моль — газовая постоянная.
Соотношение (8), оно же уравнение Менделеева-Клапейрона, одно из самых важных во всём курсе термодинамики и молекулярной физики. Исходя из этого соотношения, можно получить все газовые законы (1), (3), (5).
Вывод: для большинства задач молекулярной физики газ переводят из одного состояния во второе (может и дальше), каждое из этих состояний можно описать соотношением (8), а потом, разрешив получившуюся систему уравнений, найти ответ.
Вывод: соотношения (1) — (6) несомненно убыстряют решение задачи, однако уравнение (8) срабатывает в любом случае (предлагаю использовать только его).
Вывод: единственным общим соотношением для смеси газов является соотношение (7).
http://online.mephi.ru/courses/physics/molecular_physics/data/course/1/1.2.1.html
http://www.abitur.by/fizika/teoreticheskie-osnovy-fiziki/termodinamika-i-molekulyarnaya-fizika/opytnye-gazovye-zakony-zakon-mendeleeva-klapejrona/