Особенности термохимических уравнений.
Тепловые эффекты химических реакций
Тепловой эффект реакции —количество теплоты, которое выделяется или поглощается системой в результате протекания химической реакции. Это может быть DН (Р,Т = const) или DU (V,T = const).
Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается (DН 0),называются эндотермическими.
Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее велечену (DН) обычно относят к 1 моль вещества и выражают в кДж/моль.
Обычно функции системы определяют при стандартных условиях, в которые, кроме параметров стандартного состояния, входит стандартная температура T = 298,15 К (25°C). Часто температуру указывают в виде нижнего индекса ( 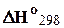
Термохимические уравнения
Термохимические уравнения реакций — уравнения, в которых указан тепловой эффект, условия реакций и агрегатные состояния веществ. Обычно в качестве теплового эффекта указывается энтальпия реакции. Например,
Тепловой эффект можно записать в уравнении реакции:
В химической термодинамике первая форма записи употребляется чаще.
Особенности термохимических уравнений.
1.Тепловой эффект зависит от массы реагирующего вещества, поэ-
тому его обычно рассчитывают на один моль вещества. В связи с этим в термохимических уравнениях можно использовать дробные коэффициенты. Например, для случая образования одного моля хлороводорода термохимическое уравнение записывается так:
или Н2 + Cl2 = 2HСl, DH 0 298 = -184 кДж.
2. Тепловые эффекты зависят от агрегатного состояния реагентов; оно указывается в термохимических уравнениях индексами: ж — жидкое, г — газообразное, т — твердое или к – кристаллическое, р – растворенное.
3.С термохимическими уравнениями можно производить алгебраические действия (их можно складывать, вычитать, умножать на любые коэффициенты вместе с тепловым эффектом).
Термохимические уравнения более полно, чем обычные, отражают происходящие при реакции изменения — они показывают не только качественный и количественный состав реагентов и продуктов, но и количественные превращения энергии, которыми данная реакция сопровождается.
Дата добавления: 2016-07-05 ; просмотров: 7791 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Тепловые эффекты химических реакций. Термодинамические и термохимические уравнения реакций

QV = ΔU + р ΔV = ΔU
Т.е. теплота, подводимая к системе при постоянном объеме равна изменению внутренней энергии.
QV = ΔU –это математическое выражение первого закона термодинамики в изохорном процессе.
Однако чаще химические реакции проводят в открытых сосудах, т.е. при практически постоянном атмосферном давлении. В нашем примере мы можем ставить на поршень гирьки, чтобы сохранить постоянное давление, тогда тепло, подводимое к системе при постоянном давлении Qp (читается «ку пэ») расходуется на изменение внутренней энергии и на совершение работы расширения:
Полученное выражение можно упростить, если воспользоваться термодинамической функцией, которая называется энтальпией. Ее обозначают Н (читается «аш») и определяют, как:
Таким образом, теплота, подводимая к системе при постоянном давлении равна изменению энтальпии: Qp = ΔH
∆H = ∆U + p∆V или Qp = ΔH — это математическое выражение первого закона термодинамики в изобарном процессе.
Рассматривая нашу систему, состоящую из газа, находящегося в цилиндре с поршнем, легко заметить, что энтальпия равна общей энергии расширенной системы (физический смысл энтальпии), т.е. сумме внутренней энергии и потенциальной энергии поднятого поршня.
Абсолютное значение энтальпии той или иной системы, так же как и абсолютное значение внутренней энергии определить невозможно. Однако практически важно знать не столько величину энтальпии, сколько разность значения этой функции в исходном и конечном состоянии.
Тепловой эффект химической реакции измеряется при стандартных условиях. Стандартными значениями энтальпии (и вообще термодинамических величин) считают значения, соответствующие температуре 298,15 К и давлению 101,3 кПа (1 атм). Вещество в этих условиях находится в стандартном состоянии, которое отмечается верхним индексом «0» и нижним «298» (ΔН о 298).
Различают стандартные энтальпии образования и стандартные энтальпии сгорания вещества.
ΔН о f 298 – стандартнаяэнтальпияобразования – это энтальпия образования 1 моля данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при стандартных условиях. f – первая буква от английского слова «formation» – образование. Стандартные энтальпии образования простых веществ обычно равны нулю.
ΔН о сгор. 298 – стандартная энтальпия сгорания – это энтальпия окисления 1 моля данного вещества кислородом с образованием высших оксидов соответствующих элементов при стандартных условиях. Стандартные энтальпии сгорания высших оксидов равны нулю.
Внутреннюю энергию и энтальпию, как правило, выражают в килоджоулях на моль (кДж/моль) исходного или полученного вещества.
Тепловые эффекты химических реакций измеряются с помощью специальных приборов – калориметров. Простейший калориметр – теплоизолированный сосуд с водой, снабженный мешалкой и особо точным термометром. Контейнер, в котором протекает исследуемый процесс (например, химическая реакция), помещают в калориметр и регистрируют изменение температуры. Зная теплоемкость калориметра, рассчитывают количество выделившейся теплоты. Для определения теплоты сгорания обычно используют толстостенный стальной сосуд – калориметрическую колбу. Стандартные энтальпии сгорания и образования табулированы (см. приложение таблица 2).
Исторически сложились две системы отсчета: термохимическая (обычно используемая в школе) и термодинамическая. Уравнения реакций, в которых указаны тепловые эффекты (Q), называются термохимическими. Уравнения реакций, в которых указано изменение энтальпии (ΔН), называются термодинамическими.
Отличия этих уравнений от обычных уравнений. В этих уравнениях коэффициенты перед соединениями читаются как числа моль (а не молекулы), в них могут ставиться дробные коэффициенты и указывается агрегатное состояние вещества (если оно может находиться в разных формах). Например,
Н2(г) + ½ О2(г) = Н2О(г), ΔН = -241,8 кДж/моль – это термодинамическое уравнение; Ст + ½ О2(г) = СО(г) + Q – это термохимическое уравнение. С термодинамическими и термохимическими уравнениями можно производить алгебраические действия: сложение, вычитание, умножение на число.
Объект исследования в термодинамике – термодинамическая система, а термохимии – окружающая среда. Отсюда разная система знаков.
Термодинамическая система отделяется от окружающей среды поверхностью раздела. Если реакция экзотермическая, мы говорим, что тепло выделяется в окружающую среду (Q > 0), тогда теплосодержание термодинамической системы, определяемое как ΔН, уменьшается (ΔН 0).
| Объект исследования | Экзотерми- ческая реакция | Эндотермическая реакция | |
| Термохимия | Окружающая среда | Q > 0 | Q 0 |
Физический смысл первого закона термодинамики. Первый закон термодинамики дает нам один из критериев самопроизвольности: самопроизвольному протеканию реакции способствует уменьшение энергии. Если реакция экзотермическая, то говорят, что энтальпийный фактор способствует протеканию прямой реакции (ΔН 0).
http://chemege.ru/termochemistry/
http://lektsii.org/17-20366.html