Энергетика химических процессов. Закон Гесса
Материалы портала onx.distant.ru
Тепловой эффект процесса
Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды.
Для лабораторных и промышленных процессов наиболее типичен изобарный режим (Р=const). Поэтому обычно рассматривают тепловой эффект при Р,Т = const, т.е. изменение энтальпии процесса ΔН.
Следует отметить, что абсолютные значения энтальпии Н определить не представляется возможным, так как не известна абсолютная величина внутренней энергии.
Для экзотермической реакции (Q > 0) ΔН 0.
Термохимические уравнения
Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическими уравнениями.
В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; S(ромб), S(монокл), С(графит), С(алмаз) и т.д.
Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения.
Закон Гесса
Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса.
Следствия из закона Гесса
- Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов).
- Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов).
Стандартные термодинамические величины
Стандартные термодинамические величины – это такие величины, которые относятся к процессам, все ингредиенты которых находятся в стандартных состояниях.
Стандартным состоянием вещества, находящегося в конденсированной фазе (кристаллической или жидкой), является реальное состояние вещества, находящегося при данной температуре и давлении 1 атм.
Следует подчеркнуть, что стандартное состояние может иметь место при любой температуре.
Обычно тепловой эффект (изменение энтальпии) реакции приводится для температуры 25 о С (298,15 К) и давления 101,325 кПа (1 атм), т.е. указывается стандартная энтальпия ΔН о 298.
Стандартные энтальпии образования и сгорания
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества присутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Например , ΔН o f,298(Н2О(ж)) = — 285,83 кДж/моль соответствует изменению энтальпии в процессе
при Т = 298,15 К и Р = 1 атм.
Стандартная энтальпия образования простых веществ равна нулю по определению (для наиболее устойчивых их модификаций при данной температуре).
Стандартной энтальпией сгорания ΔН o сгор,298 называют энтальпию сгорания вещества (обычно 1 моль), находящегося в стандартном состоянии с образованием СО2(г), Н2О(ж) и других веществ, состав которых должен быть специально указан. Все продукты сгорания также должны находиться в стандартном состоянии.
Примеры решения задач
Задача 1. Используя справочные термодинамические данные вычислить ΔН o 298 реакции:
Решение. Решим задачу, используя оба следствия из закона Гесса. Ниже для исходных веществ и продуктов реакции приведены значения энтальпий образования и сгорания в кДж/моль (энтальпия сгорания сероводорода до SO2(г) и H2O(ж)):
| Вещество | H2S(г) | O2(г) | SO2(г) | H2O(ж) |
| ΔН o f,298 | -20,60 | 0 | -296,90 | -285,83 |
| ΔН o сгор,298 | -562,10 | 0 | 0 | 0 |
Cогласно первому следствию закона Гесса энтальпия этой реакции ΔН о х.р. равна:
В соответствии со вторым следствием закона Гесса получаем:
ΔН о х.р.,298 = 2ΔН о сгор,298(H2S(г)) = 2(-562,10) = — 1124,20 кДж.
Задача 2. Вычислите ΔН о 298 реакции N2(г) + 3H2(г) = 2NH3(г), используя следующие данные:
Определите стандартную энтальпию образования NH3(г).
Решение. Поскольку с термохимическими уравнениями можно производить все алгебраические действия, то искомое уравнение получится, если:
- разделить на два тепловой эффект первого уравнения и изменить его знак на противоположный, т.е:
- умножить на 3/2 второе уравнение и соответствующую ему величину δН o , изменив ее знак на противоположный:
Таким образом, тепловой эффект реакции N2(г) + 3H2(г) = 2NH3(г) равен:
Δ Н о 298 = (- ΔН о 1/2) + (- 3/2·ΔН о 2) = 765,61 + (- 857,49) = — 91,88 кДж.
Поскольку в рассматриваемой реакции образуется 2 моль NH3(г), то
ΔН о f,298(NH3(г)) = — 91,88/2 = — 45,94 кДж/моль.
Задача 3. Определите энтальпию процесса
если при 298,15 К энтальпия растворения CuSO4(к) в n моль Н2О с образованием раствора CuSO4(р-р, nH2O) равна –40, а энтальпия растворения CuSO4·5H2O(к) с образованием раствора той же концентрации равна +10,5 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о 1 = ΔН о 2 + ΔН о х (по закону Гесса). Отсюда получаем:
ΔН о х = ΔН о 1 – ΔН о 2 = – 40,0 – 10,5 = -50,5 кДж.
Другой вариант решения.
По закону Гесса: ΔН о 1 = ΔН о х+ ΔН о 3, т.е. при сложении уравнений (2) и (3) получим уравнение (1).
Задача 4. Вычислите энтальпию образования химической связи С= С в молекуле этилена, если его стандартная энтальпия образования равна 52,3 кДж/моль, энтальпия возгонки графита составляет 716,7 кДж/моль, энтальпия атомизации водорода равна +436,0 кДж/моль, энтальпия образования связи С–Н равна –414,0 кДж/моль.
Решение. Составляем цикл Гесса:
ΔН о (С = С) = 52,3 — 2·716,7 — 2·436,0 + 4·414,0 = — 597,1 кДж/моль.
Задачи для самостоятельного решения
1. Составьте уравнение реакции, для которой ΔН о соответствует стандартной энтальпии образования ВaCl2·2H2O(к).
ЗАКОН ГЕССА И ЕГО СЛЕДСТВИЯ: РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Закон Гесса (1840 г.) представляет собой частный случай закона сохранения энергии. Он позволяет определить тепловой эффект химического взаимодействия, используя данные о состояниях веществ только в начале и в конце процесса. Для этого применяется так называемая формула закона Гесса, оформленная в виде формулировки следствия из него.
Итак, что же из себя представляет закон, о котором идет речь? Как, пользуясь им, можно проводить вычисления?
Экзотермические и эндотермические реакции
Основной категорией химического процесса, с которой закон Гесса имеет дело, является тепловой эффект – главный объект термохимии.
Тепловым эффектом Q считают теплоту, либо подающуюся в систему, либо выделяющуюся из нее в ходе химического взаимодействия.
Так, если теплота подается в систему (то есть поглощается из внешней среды), то процесс является эндотермическим. Если теплота, наоборот, уходит из системы в окружающую среду, то процесс является экзотермическим.
Каждая реакция отображается с помощью уравнения. Если в уравнении указан тепловой эффект химического процесса, то такое уравнение называется термохимическим. В нем обязательно записываются либо агрегатные состояния веществ, определяющие общее состояние системы, либо их аллотропные модификации (в случае простых веществ).
Обозначения агрегатных состояний записываются нижним индексом в скобках рядом с химической формулой вещества.
Например, для экзотермического процесса:
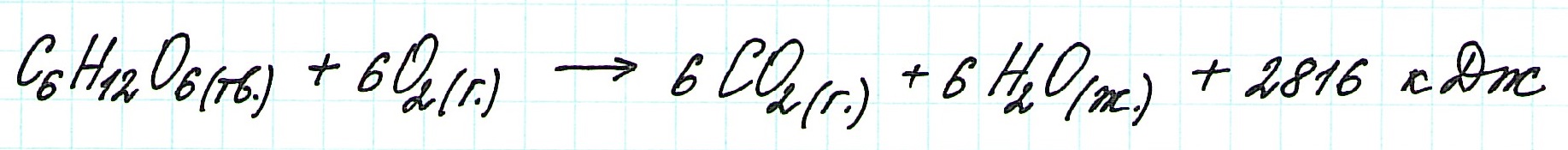

— (тв.) – твердое, или (к.) – кристаллическое;
Тепловой эффект Q реакции и изменение энтальпии ΔН имеют одинаковые численные значения, а по знаку противоположны:
В связи с этим приведенные выше уравнения можно записать так:
Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
Закон Гесса констатирует:
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Таким образом, результат реакции совершенно не зависит как от пройденного пути, так и от количества промежуточных стадий. Важными оказываются состояния веществ: начальное и конечное.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
Запишем термохимические уравнения реакций, о которых идет речь:
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Следствие из закона Гесса: вычисление энтальпии реакции
Чаще всего в вычислениях применяется не сам закон Гесса, а следствие из него. Оно позволяет вычислить как изменение энтальпии реакции, так и энтальпию образования любого из участников химического взаимодействия.
Следствие утверждает, что

А если учесть коэффициенты, то так:
Для вычислений обычно применяют стандартные энтальпии образования, так как именно в стандартных состояниях вещества наиболее устойчивы:
Стандартные теплоты (энтальпии) образования являются табличными величинами.
Задача 1. Используя данные таблицы стандартных термодинамических величин , вычислите изменение энтальпии для реакции:
Решение:
Задача 2.
Решение:
Задача 3. 
Тепловой эффект в термодинамическом уравнении относят к 1 молю образующегося вещества. С учетом этого запишем уравнение реакции следующим образом:
Следовательно, для данной реакции термохимическое уравнение будет выглядеть так:
В дополнение ко всему сказанному отметим, что некоторые тепловые эффекты реакций, идущих при стандартном давлении, меняются с температурой. Однако эти изменения незначительны. Поэтому при выполнении термодинамических вычислений для нестандартных условий можно использовать стандартные величины теплот образования. Появится в итоге небольшая ошибка, что вполне допускается.
Таким образом, закон Гесса, а также следствие из него позволяют проводить расчеты, в основе которых лежат тепловые явления химических процессов.
Далее будут рассмотрены случаи, в которых используется формула закона Гесса для расчета таких термодинамических величин, как энтропия и энергия Гиббса.
Закон Гесса и следствия из него. Применение закона Гесса для расчета изменения энтальпии химической реакции
а) В основе термохимических расчетов лежит закон, открытый русским ученым Г. И. Гессом в 1840 г. Закон гласит: тепловой эффект реакции зависит от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода (из начального состояния в конечное).
Или иначе: тепловое эффект реакции равен алгебраической сумме тепловых эффектов всех его промежуточных стадий:
Следствия из закона Гесса:
1. Если в результате последовательных химических реакций система приходит в состояние, полностью совпадающее с исходным (круговой процесс), то сумма тепловых эффектов этих реакций будет равна нулю.
2. Тепловой эффект реакций (ΔНх.р.) равен сумме теплот образования (или ΔНобр.) конечных веществ (ΔНконеч. в-в) за вычетом суммы теплот образования исходных веществ (ΔНисх. в-в):
б) Наиболее важное для практики следствие закона Гесса: — энтальпия химической реакции равна разности между суммой энтальпий образования продуктов реакции минус и суммой энтальпийи образования исходных веществ (реагентов). 
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например HCl(р-р) + NaOH(р-р) = NaCl(р-р) + Н2Ож может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H + и OH – : H + (р-р) + OH – (р-р) = Н2Ож (2.7) Уравнение (2.7) — это уравнение реакции нейтрализации. Оно справедливо для всех реакций между сильной кислотой и сильным основанием, а следовательно и энтальпия этих реакцийодно и тоже для будет одна и та же.Табличные значения энтальпий образования ( 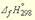




Стандартная энтропия веществ. Изменение энтропии при изменении агрегатного состояния вещества. Расчет изменения стандартной энтропии химической реакции. Влияние температуры на величину свободной энергии Гиббса и константу равновесия
а) Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Энтропия связана с термодинамической вероятностью соотношением:
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль –1 ∙K –1 . Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии *) термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло). Здесь ΔS ° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1. Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 4.1 приведены стандартные энтропии S ° некоторых веществ.
|



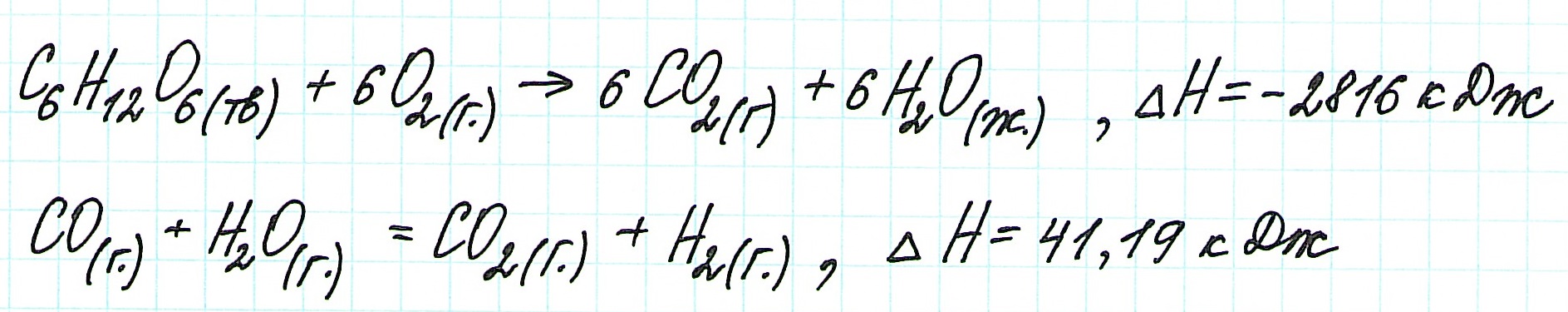


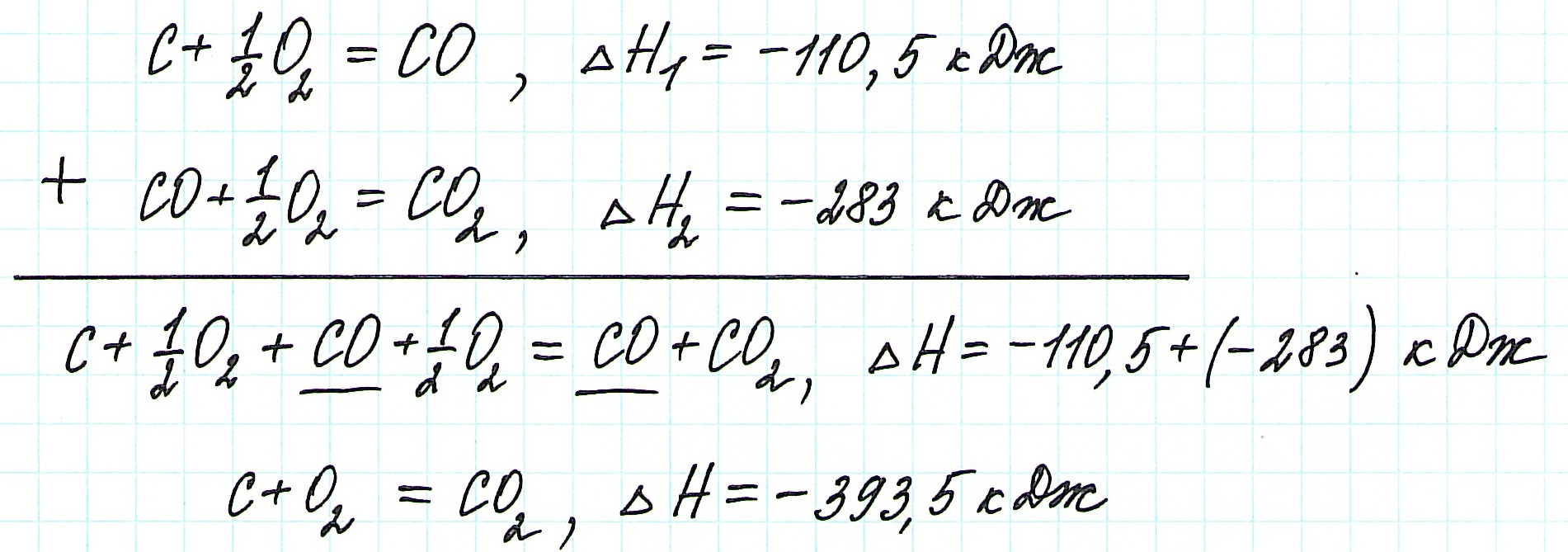
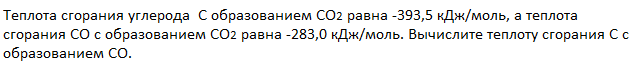
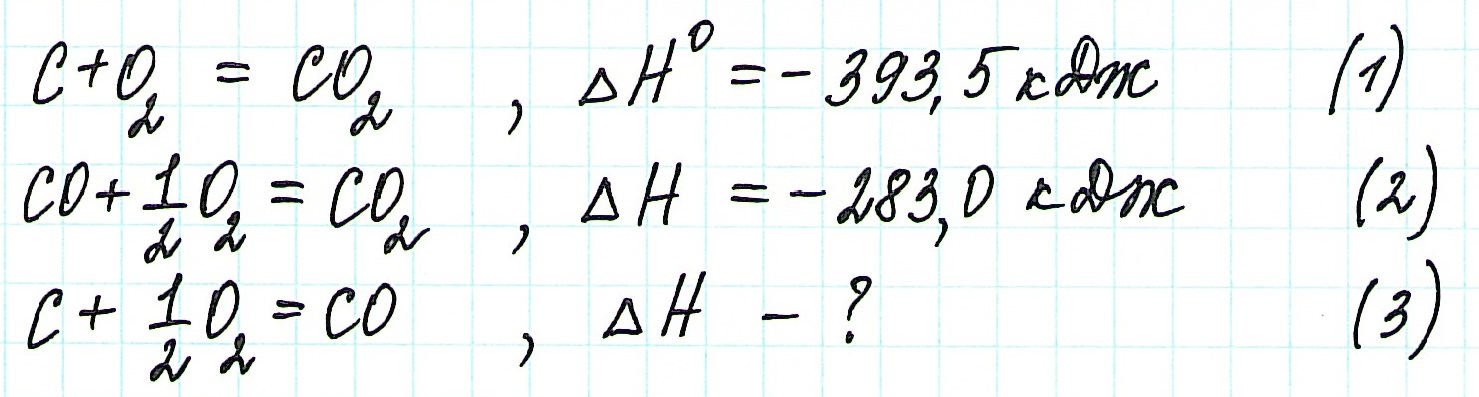
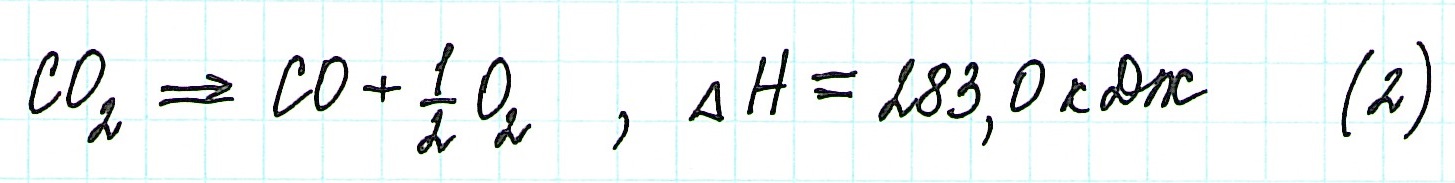
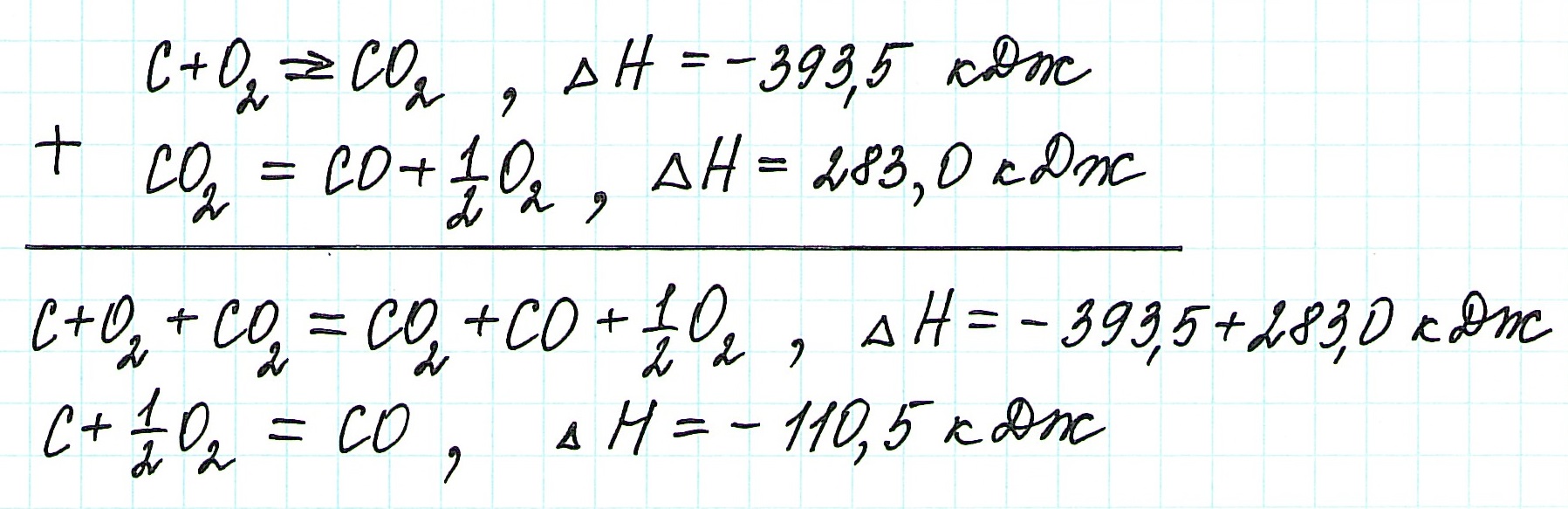

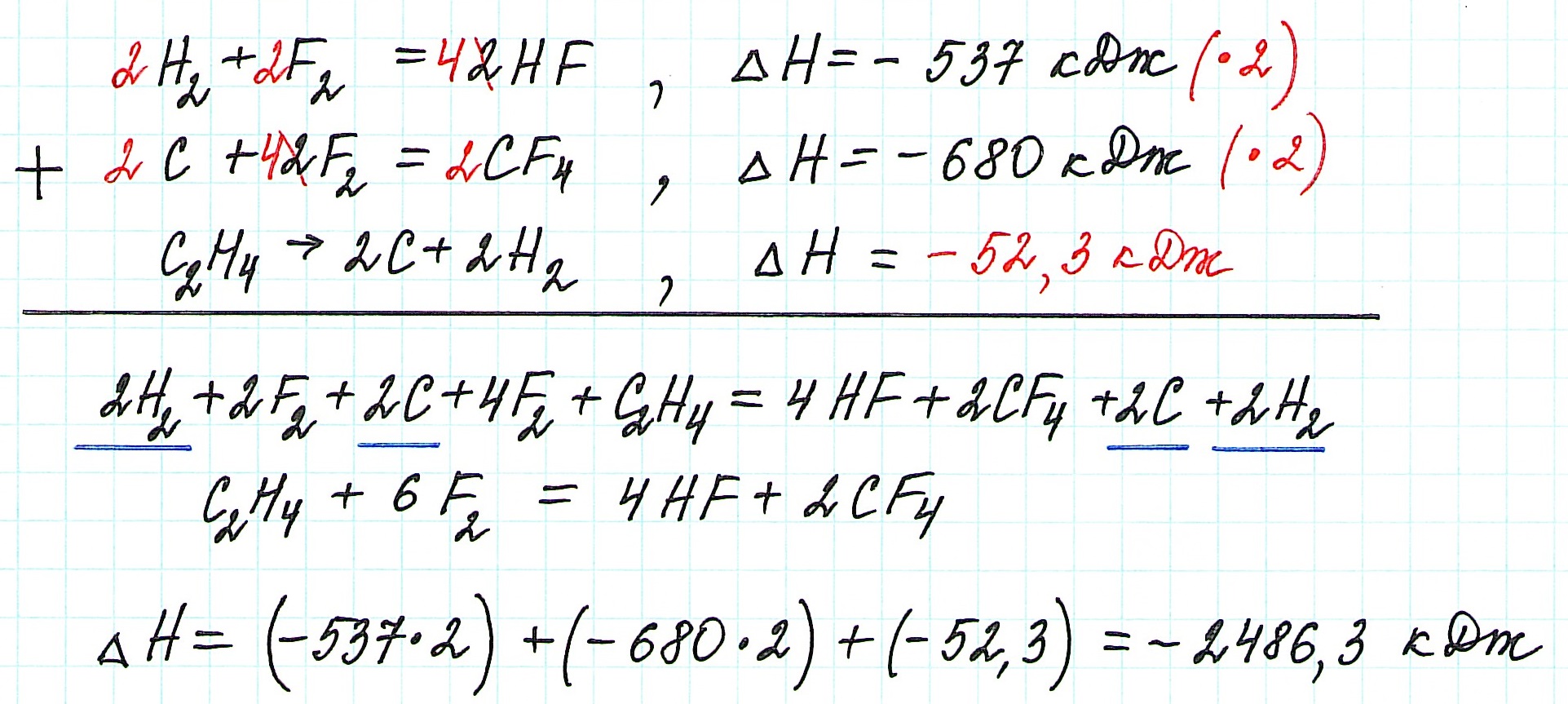










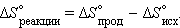
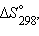 (Дж∙моль –1 ∙K –1 )
(Дж∙моль –1 ∙K –1 )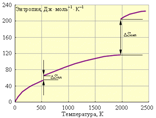

 — отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R —универсальная газовая постоянная.
— отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R —универсальная газовая постоянная.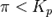
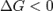 — реакция идёт в прямом направлении, слева направо;
— реакция идёт в прямом направлении, слева направо;
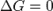 — реакция достигла равновесного состояния;
— реакция достигла равновесного состояния;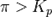
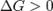 — реакция идёт в обратном направлении.
— реакция идёт в обратном направлении.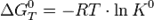
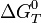 имеет наибольшую по модулю отрицательную величину.
имеет наибольшую по модулю отрицательную величину.