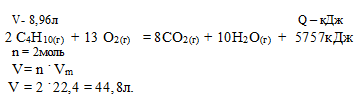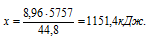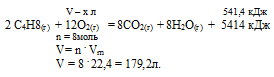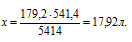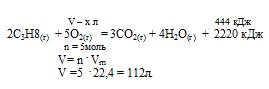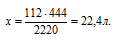Вычислить тепловой эффект реакции получения гидроксида кальция
1. Вычислить тепловой эффект реакции получения гидроксида кальция
СаО(т) + Н2О(ж) = Са(ОН)2(т), если теплота образование СаО(т) равна +635701,5Дж/моль, теплота образования Н2О(ж) +285835,5 Дж/моль и теплота образования Са(ОН)2 +986823 Дж/моль.
Тепловой эффект реакции
СаО (т) + Н2О (ж) = Са(ОН)2(т) по первому следствию закона Гесса, будет равен теплоте образования Са(ОН)2(т) минус теплота образования Н2О(ж) и теплота образования (СаО(т)):
+1 моль• ΔfН 0 298(Н2О (ж)))=1 моль*986823 Дж/моль — (1 моль* 635701,5 Дж/моль +
+ 1 моль*285835,5 Дж/моль)= 65 286 Дж.
2. Вычислите изменения энергии Гиббса в реакции димеризации диоксида азота при стандартной температуре, при 0 и 100ºС. Сделать вывод о направлении процесса.
При стандартной температуре 298 К изменение энтальпии в реакции
2NO2(г)
Δ rН 0 298 =1 моль* 9660 Дж/моль – 2 моль*33800 Дж/ моль = — 57940 Дж
Изменение температуры равно
–2 моль*234 Дж/моль*К = — 164 Дж/К
Зависимость энергии Гиббса реакции от температуры описывается уравнением
При стандартной температуре
ΔrG 0 298=ΔH 0 298– TΔS 0 298 = — 57940 Дж – (298 К*(-164 Дж/К)) = -9068 Дж/моль
Отрицательное значение энергии Гиббса реакции говорит о том, что смещении равновесия вправо (самопроизвольный процесс), т.е. в сторону образования диоксида азота.
ΔrG 0 273 = -57940 Дж + 273К* 164 Дж/К = -13168 Дж/моль
Более высокое отрицательное значение ΔG273 по сравнению с ΔG 0 298 свидетельствует о том, что при 273 К равновесие еще больше смещено в сторону прямой реакции.
При 100ºС (373 К)
ΔrG373 = -57940 Дж + 373К*164 Дж/К = 3232 Дж/моль.
Положительная величина ΔG373 указывает на изменение направления реакции: равновесие смещено влево, т.е. в сторону распада димера N2O4 (реакция невозможна). Ответ: при 0ºС (273 К) ΔrG273= -13168 Дж/моль, реакция протекает самопроизвольно; при 100ºС (373 К) ΔrG373= 3232 Дж/моль, реакция невозможна.
3. Составьте термохимическое уравнение горения метана СН4 и рассчитайте объем воздуха, необходимый для сжигания 1моль метана, если известно, что при сгорании 5,6 л метана выделяется 220 кДж теплоты, содержание кислорода в воздухе равно 20%.
Рbv28231 Методика решения задач по физической химии (1) (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Ответ. Энергия связи С–Н в метане
составляет 414,325 кДж/моль.
Задача 5. (Региональный (III) этап 2002 г., 10-й класс.)
Теплота образования химического соединения – это тепловой эффект химической реакции образования 1 моль этого вещества из простых веществ, взятых в наиболее устойчивом состоянии при давлении 1,01•105 Па и температуре 25 °С.
1. Исходя из этого определения, напишите термохимические уравнения реакций, тепловой эффект которых будет равен теплоте образования газообразного аммиака [Qобр (NH3 (г.))], углекислого газа [Qобр (CO2 (г.))], жидкой воды [Qобр (H2O (ж.))] и мочевины [Qобр (NH2–CO–NH2 (тв.))].
2. На основании этих уравнений выведите формулу расчета Qx реакции (Х):
NH3 (г.) + CO2 (г.) —> (NH2)2CO (тв.) + H2O (ж.) + Qx, (Х)
через теплоты образования участвующих в реакции веществ.
3. Следствием из какого закона является выведенная вами формула?
4. Рассчитайте тепловой эффект реакции (Х), исходя из данных таблицы:
5. Какое количество теплоты выделится при образовании мочевины (уравнение Х), если исходные объемы аммиака и углекислого газа (н. у.) равны соответственно 8,96 и 17,38 л? Выход в реакции считать за 100%.
1. Запишем термохимические уравнения, тепловые эффекты которых равны соответствующим теплотам образования:
1,5H2 (г.) + 0,5N2 (г.) = NH3 (г.) + Qобр (NH3 (г.)), (1)
С (гр.) + О2 (г.) = СО2 (г.) + Qобр (CO2 (г.)), (2)
N2 (г.) + 2H2 (г.) + С (гр.) + 0,5O2 (г.) = (NH2)2CO (тв.) + Qобр (NH2–CO–NH2 (тв.)), (3)
H2 (г.) + 0,5O2 (г.) = H2O (ж.) + Qобр (H2O (ж.)). (4)
2. Термохимическое уравнение, тепловой эффект которого надо определить:
2NH3 (г.) + CO2 (г.) = (NH2)2CO (тв.) + H2O (ж.) + Qx. (Х)
Уравнение (Х) получим, сложив уравнения (3) и (4) и вычтя из этой суммы уравнение (2) и удвоенное уравнение (1):
Qx = Qобр (NH2–CO–NH2 (тв.) + Qобр (H2O (ж.)) – Qобр (CO2 (г.)) – 2Qобр (NH3 (г.)).
3. Это следствие из закона Гесса (определение теплового эффекта реакции через теплоты образования участвующих в реакции веществ).
4. Qx = 333,2 + 285,8 – 393,5 – 2•46,2 = 133,1 кДж.
5. 

Очевидно, что CO2 дан в избытке, следовательно, расчет надо проводить исходя из количества аммиака.
При взаимодействии веществ, данных в условии задачи, выделится
Задача 6. (Региональный (III) этап 2004 г., 10-й класс.)
Для устойчивого горения пиротехнической смеси (KClO3 + C) без доступа воздуха необходимо, чтобы на 1 г этой смеси исходных веществ выделялось не менее 1,5 кДж теплоты.
Энтальпия сгорания угля равна –394 кДж/моль.
Энтальпия реакции: KClO3 = KCl + 1,5O2 равна –48 кДж/моль KClO3.
Вычислите минимальную массу (г) угля (допустимо считать его чистым углеродом), которую нужно добавить к 100 г хлората калия для устойчивого горения смеси.
Термохимическое уравнение реакции горения угля:
C (гр.)+ O2 (г.) = CO2 (г.)+ 394 кДж.
При сгорании 1 моль (соответственно 12 г) углерода выделяется 394 кДж теплоты.
Пусть надо взять х г угля, тогда масса пиротехнической смеси будет составлять:
При горении х г углерода выделяется (394•х/12) кДж.
При разложении 100 г KClO3 выделяется (48•100/122,5) кДж.
Отсюда следует, что при горении смеси массой m = (100 + х) выделится:
((394•х/12) + (48•100/122,5)) кДж.
По условию для устойчивого горения необходимо, чтобы на 1 г смеси выделялось не менее 1,5 кДж. Из получившегося уравнения:
[(394•х /12) +(48•100/122,5)]/(100 + х) = 1,5
находим, что х = 3,54 г.
Ответ. К 100 г хлората калия
необходимо добавить 3,54 г угля.
Задача 7. (Региональный (III) этап 2002 г., 11-й класс.)
Теплотой сгорания вещества, в состав которого входят С, Н, N и О, называется тепловой эффект реакции сгорания 1 моль этого вещества в избытке кислорода до СО2 (г.), Н2О (ж.) и N2 (г.), приведенных к начальным (в данном случае к стандартным) условиям эксперимента. Даны стандартные теплоты сгорания мочевины и аммиака: 631,9 кДж/моль и 382,5 кДж/моль соответственно.
1. Запишите термохимические уравнения, тепловые эффекты которых равны соответственно теплотам сгорания мочевины и аммиака.
2. Исходя из уравнений, полученных в п.1, определите тепловой эффект реакции образования мочевины из аммиака и углекислого газа в расчете на 1 моль аммиака.
3. Вычислите значение стандартной теплоты образования мочевины, если теплоты сгорания водорода и графита равны соответственно 285,8 и 393,5 кДж/моль.
4. Вычислите тепловой эффект полного гидролиза мочевины.
5. Напишите систематическое и еще одно тривиальное название мочевины. К какому классу соединений относится мочевина?
1. Исходя из определения теплоты сгорания, можно записать следующие термохимические уравнения реакций:
(NH2)2CO (тв.) + 1,5O2 (г.) = N2 (г.) + CO2 (г.) +2H2O (ж.) + 631,9 кДж,
NH3 (г.) + 0,75O2 (г.) = 0,5N2 (ж.) + 1,5H2O (ж.) + 382,5 кДж.
2. Термохимическое уравнение реакции образования мочевины из аммиака и углекислого газа в расчете на 1 моль аммиака получается комбинацией предыдущих уравнений с учетом коэффициентов:
Qx = (–0,5)631,9 + 382,5= 66,55 кДж.
Тепловой эффект реакции образования мочевины из 1 моль аммиака составляет 66,55 кДж.
3. Термохимические уравнения реакций горения графита и водорода:
С (гр.) + O2 (г.) = CO2 (г.) + 393,5 кДж,
H2 (г.) + 0,5O2 (г.) = H2O (ж.) + 285,8 кДж.
И в той, и в другой реакции из 1 моль исходного вещества образуется 1 моль продукта реакции. Следовательно, теплота сгорания графита численно равна теплоте образования оксида углерода(IV), а теплота сгорания водорода численно равна теплоте образования воды:
Qобр (CO2 (г.)) = 393,5 кДж/моль,
Qобр (H2O (ж.)) = 285,8 кДж/моль.
Воспользуемся уравнением сгорания мочевины:
(NH2)2CO (тв.) + 1,5O2 (г.) = N2 (г.) + CO2 (г.) + 2H2O (ж.) + 631,9 кДж.
Qобр (CO2 (г.)) + 2Qобр (H2O (ж.)) – Qобр ((NH2)2CO (тв.)) = 631,9 кДж.
Qобр ((NH2)2CO (тв.)) = 393,5 + 2•285,8 – 631,9 = 333,2 кДж/моль.
4. Уравнение реакции гидролиза мочевины:
(NH2)2CO (г.) + H2O (ж.) = CO2 (г.) + 2NH3 (г.).
Этот процесс является обратным процессу синтеза мочевины, поэтому для вычисления его теплового эффекта можно воспользоваться данными, полученными при ответе на вопрос 2. Поскольку в процессе гидролиза получается 2 моль аммиака, то вычисленный в ответе на вопрос 2 тепловой эффект надо умножить на два и взять с обратным знаком: –133,1 кДж.
5. Карбамид, диамид угольной кислоты. Класс соединения: амид.
Задача 8. (Региональный (III) этап 2003 г., 11-й класс.)
Ниже приведены данные о процессах.
Образование 36 г H2O (г.) из простых веществ
Выделяется 484 кДж
Полное сгорание 18 г CH3COOH (ж.) до CO2 (г.) и H2O (ж.)
Выделяется 268,2 кДж
Полное сгорание 18,4 г C2H5OH (ж.) до CO2 (г.) и H2O (ж.)
Выделяется 558,8 кДж
Образование 52,8 г CH3COOC2H5 (ж.) в ходе реакции этерификации
Выделяется 3 кДж
Испарение 9 г H2O (ж.)
Поглощается 22 кДж
1. На основании приведенных данных напишите термохимические уравнения, тепловые эффекты которых соответствуют:
• стандартной теплоте образования H2O (г.);
• стандартной теплоте сгорания CH3COOH (ж.);
• стандартной теплоте сгорания C2H5OH (ж.);
• тепловому эффекту реакции этерификации (в расчете на 1 моль эфира).
2. Рассчитайте тепловой эффект реакции этилового эфира уксусной кислоты с водородом на палладиевом катализаторе (в расчете на 1 моль эфира).
1. Стандартные теплоты образования относятся к количеству образуемого вещества, равному одному молю.

следовательно, для написания требуемого термохимического уравнения количество выделившейся в реакции теплоты надо разделить на два:
H2 (г.) + 0,5O2 (г.) = H2O (г.) + 242 кДж. (1)
Стандартная теплота сгорания – тепловой эффект сгорания в кислороде 1 моль вещества до CO2 (г.) и H2O (ж.) (а также N2 (г.), SO2 (г.) и т. д.).

Qсгор(СH3СООН) (ж.) = 268,2/0,3 = 894 кДж/моль;
CH3COOH (ж.) + 2О2 (г.) = 2CO2 (г.) + 2H2O (ж.) + 894 кДж. (2)

Qсгор(С2H5OН) (ж.) = 558,8/0,4 = 1397 кДж/моль;
C2H5OH (ж.) + 3О2 (г.) = 2CO2 (г.) +3H2O (ж.) + 1397 кДж. (3)

Q = 3/0,6 = 5 кДж/моль;
C2H5OH (ж.) + CH3COOH (ж.) = CH3COOC2H5 (ж.) + H2O (ж.) + 5 кДж. (4)
2. Взаимодействие эфира с водородом на палладиевом катализаторе:
CH3COOC2H5 (ж.) + 2H2 (г.) = 2C2H5OH (ж.) + Qx. (5)
Для вычисления неизвестного теплового эффекта воспользуемся законом Гесса. Пользуясь термохимическими уравнениями как алгебраическими выражениями, необходимо так скомбинировать уравнения (1)–(4), чтобы получить уравнение (5). При этом после данной комбинации должны остаться только слагаемые уравнения (5). Из анализа термохимических уравнений (1)–(4) следует, что для вычисления теплового эффекта Qx необходимо учесть тепловой эффект испарения воды, потому что оперировать формулами веществ как обычными членами математических уравнений можно только если эти вещества находятся в одинаковых состояниях.
Расчеты по термохимическим уравнениям реакций
Задача 1.5.
При сгорании 8,96 л (н.у.) бутана согласно термохимическому уравнению:
2С4Н10 + 13О2 = 8СО2 + 10Н2О + 5757 кДж выделилось:
1) 1151,4 кДж; 2) 2302,8кДж; 3) 4605,6 кДж; 4) 575,7кДж.
Дано: объем ацетилена: V(С4Н10) = 8,96 л.
Найти: количество выделившейся теплоты.
Р е ш е н и е:
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
8,96 л бутана дают х кДж (по условию)
44,8 л бутана дают 5757 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 1.
Ответ: № 1.
Задача 1.6
При полном сгорании некоторого количества бутена выделилось 541,4 кДж. При этом согласно термохимическому уравнению:
2С4Н8 + 12О2 = 8СО2 + 8Н2О + 5414 кДж объем образовавшегося СО2 (н.у.) составил:
1) 4,48 л; 2) 8,96 л; .3) 17,92 л; 4) 22,4 л.
Дано: Количество выделившейся теплоты: Q = 541,4 кДж.
Найти: объем углекислого газа (н.у.): V (CO2) = ?
Р е ш е н и е :
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления объема углекислого газа составляем пропорцию:
х л бутена дают 444 кДж (по условию)
179,2 л бутана дают 5414 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
Ответ: V(CO2) = 17,92л.
Задача 1.7
При сгорании порции пропана выделилось 444 кДж теплоты. Согласно термохимическому уравнению:
С3Н8 + 502 = ЗСО2 + 4Н2О + 2220 кДж, объем (н.у.) затраченного кислорода равен:
1)44,8 л; 2) 17,92 л; 3) 22,4 л; 4) 11,2 л.
Дано: Количество выделившейся теплоты: Q = 444 кДж.
Найти: объем углекислого газа (н.у.): V (O2) = ?
Р е ш е н и е :
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Для вычисления объема углекислого газа составляем пропорцию:
х моль кислорода требуется для получения 444 кДж (по условию)
5 моль кислорода требуется для получения 2220 кДж (по уравнению)
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 3.
Ответ: V(O2) = 22,4л.
http://pandia.ru/text/82/004/90439-3.php
http://buzani.ru/zadachi/ege-khimiya/949-termokhimicheskie-uravneniya-zadacha-1-5-1-7