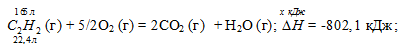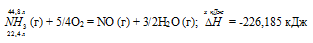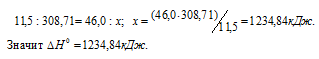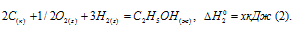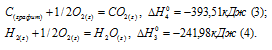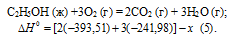Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
При образовании 560 мл (н.у.) газообразного аммиака в соответствии с уравнением N2(г) + 3H2(г) = 2NH3(г) + Q выделилось 1,15 кДж теплоты. Чему равен тепловой эффект этой реакции?
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Рbv28231 Методика решения задач по физической химии (1) (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Ответ. Энергия связи С–Н в метане
составляет 414,325 кДж/моль.
Задача 5. (Региональный (III) этап 2002 г., 10-й класс.)
Теплота образования химического соединения – это тепловой эффект химической реакции образования 1 моль этого вещества из простых веществ, взятых в наиболее устойчивом состоянии при давлении 1,01•105 Па и температуре 25 °С.
1. Исходя из этого определения, напишите термохимические уравнения реакций, тепловой эффект которых будет равен теплоте образования газообразного аммиака [Qобр (NH3 (г.))], углекислого газа [Qобр (CO2 (г.))], жидкой воды [Qобр (H2O (ж.))] и мочевины [Qобр (NH2–CO–NH2 (тв.))].
2. На основании этих уравнений выведите формулу расчета Qx реакции (Х):
NH3 (г.) + CO2 (г.) —> (NH2)2CO (тв.) + H2O (ж.) + Qx, (Х)
через теплоты образования участвующих в реакции веществ.
3. Следствием из какого закона является выведенная вами формула?
4. Рассчитайте тепловой эффект реакции (Х), исходя из данных таблицы:
5. Какое количество теплоты выделится при образовании мочевины (уравнение Х), если исходные объемы аммиака и углекислого газа (н. у.) равны соответственно 8,96 и 17,38 л? Выход в реакции считать за 100%.
1. Запишем термохимические уравнения, тепловые эффекты которых равны соответствующим теплотам образования:
1,5H2 (г.) + 0,5N2 (г.) = NH3 (г.) + Qобр (NH3 (г.)), (1)
С (гр.) + О2 (г.) = СО2 (г.) + Qобр (CO2 (г.)), (2)
N2 (г.) + 2H2 (г.) + С (гр.) + 0,5O2 (г.) = (NH2)2CO (тв.) + Qобр (NH2–CO–NH2 (тв.)), (3)
H2 (г.) + 0,5O2 (г.) = H2O (ж.) + Qобр (H2O (ж.)). (4)
2. Термохимическое уравнение, тепловой эффект которого надо определить:
2NH3 (г.) + CO2 (г.) = (NH2)2CO (тв.) + H2O (ж.) + Qx. (Х)
Уравнение (Х) получим, сложив уравнения (3) и (4) и вычтя из этой суммы уравнение (2) и удвоенное уравнение (1):
Qx = Qобр (NH2–CO–NH2 (тв.) + Qобр (H2O (ж.)) – Qобр (CO2 (г.)) – 2Qобр (NH3 (г.)).
3. Это следствие из закона Гесса (определение теплового эффекта реакции через теплоты образования участвующих в реакции веществ).
4. Qx = 333,2 + 285,8 – 393,5 – 2•46,2 = 133,1 кДж.
5. 

Очевидно, что CO2 дан в избытке, следовательно, расчет надо проводить исходя из количества аммиака.
При взаимодействии веществ, данных в условии задачи, выделится
Задача 6. (Региональный (III) этап 2004 г., 10-й класс.)
Для устойчивого горения пиротехнической смеси (KClO3 + C) без доступа воздуха необходимо, чтобы на 1 г этой смеси исходных веществ выделялось не менее 1,5 кДж теплоты.
Энтальпия сгорания угля равна –394 кДж/моль.
Энтальпия реакции: KClO3 = KCl + 1,5O2 равна –48 кДж/моль KClO3.
Вычислите минимальную массу (г) угля (допустимо считать его чистым углеродом), которую нужно добавить к 100 г хлората калия для устойчивого горения смеси.
Термохимическое уравнение реакции горения угля:
C (гр.)+ O2 (г.) = CO2 (г.)+ 394 кДж.
При сгорании 1 моль (соответственно 12 г) углерода выделяется 394 кДж теплоты.
Пусть надо взять х г угля, тогда масса пиротехнической смеси будет составлять:
При горении х г углерода выделяется (394•х/12) кДж.
При разложении 100 г KClO3 выделяется (48•100/122,5) кДж.
Отсюда следует, что при горении смеси массой m = (100 + х) выделится:
((394•х/12) + (48•100/122,5)) кДж.
По условию для устойчивого горения необходимо, чтобы на 1 г смеси выделялось не менее 1,5 кДж. Из получившегося уравнения:
[(394•х /12) +(48•100/122,5)]/(100 + х) = 1,5
находим, что х = 3,54 г.
Ответ. К 100 г хлората калия
необходимо добавить 3,54 г угля.
Задача 7. (Региональный (III) этап 2002 г., 11-й класс.)
Теплотой сгорания вещества, в состав которого входят С, Н, N и О, называется тепловой эффект реакции сгорания 1 моль этого вещества в избытке кислорода до СО2 (г.), Н2О (ж.) и N2 (г.), приведенных к начальным (в данном случае к стандартным) условиям эксперимента. Даны стандартные теплоты сгорания мочевины и аммиака: 631,9 кДж/моль и 382,5 кДж/моль соответственно.
1. Запишите термохимические уравнения, тепловые эффекты которых равны соответственно теплотам сгорания мочевины и аммиака.
2. Исходя из уравнений, полученных в п.1, определите тепловой эффект реакции образования мочевины из аммиака и углекислого газа в расчете на 1 моль аммиака.
3. Вычислите значение стандартной теплоты образования мочевины, если теплоты сгорания водорода и графита равны соответственно 285,8 и 393,5 кДж/моль.
4. Вычислите тепловой эффект полного гидролиза мочевины.
5. Напишите систематическое и еще одно тривиальное название мочевины. К какому классу соединений относится мочевина?
1. Исходя из определения теплоты сгорания, можно записать следующие термохимические уравнения реакций:
(NH2)2CO (тв.) + 1,5O2 (г.) = N2 (г.) + CO2 (г.) +2H2O (ж.) + 631,9 кДж,
NH3 (г.) + 0,75O2 (г.) = 0,5N2 (ж.) + 1,5H2O (ж.) + 382,5 кДж.
2. Термохимическое уравнение реакции образования мочевины из аммиака и углекислого газа в расчете на 1 моль аммиака получается комбинацией предыдущих уравнений с учетом коэффициентов:
Qx = (–0,5)631,9 + 382,5= 66,55 кДж.
Тепловой эффект реакции образования мочевины из 1 моль аммиака составляет 66,55 кДж.
3. Термохимические уравнения реакций горения графита и водорода:
С (гр.) + O2 (г.) = CO2 (г.) + 393,5 кДж,
H2 (г.) + 0,5O2 (г.) = H2O (ж.) + 285,8 кДж.
И в той, и в другой реакции из 1 моль исходного вещества образуется 1 моль продукта реакции. Следовательно, теплота сгорания графита численно равна теплоте образования оксида углерода(IV), а теплота сгорания водорода численно равна теплоте образования воды:
Qобр (CO2 (г.)) = 393,5 кДж/моль,
Qобр (H2O (ж.)) = 285,8 кДж/моль.
Воспользуемся уравнением сгорания мочевины:
(NH2)2CO (тв.) + 1,5O2 (г.) = N2 (г.) + CO2 (г.) + 2H2O (ж.) + 631,9 кДж.
Qобр (CO2 (г.)) + 2Qобр (H2O (ж.)) – Qобр ((NH2)2CO (тв.)) = 631,9 кДж.
Qобр ((NH2)2CO (тв.)) = 393,5 + 2•285,8 – 631,9 = 333,2 кДж/моль.
4. Уравнение реакции гидролиза мочевины:
(NH2)2CO (г.) + H2O (ж.) = CO2 (г.) + 2NH3 (г.).
Этот процесс является обратным процессу синтеза мочевины, поэтому для вычисления его теплового эффекта можно воспользоваться данными, полученными при ответе на вопрос 2. Поскольку в процессе гидролиза получается 2 моль аммиака, то вычисленный в ответе на вопрос 2 тепловой эффект надо умножить на два и взять с обратным знаком: –133,1 кДж.
5. Карбамид, диамид угольной кислоты. Класс соединения: амид.
Задача 8. (Региональный (III) этап 2003 г., 11-й класс.)
Ниже приведены данные о процессах.
Образование 36 г H2O (г.) из простых веществ
Выделяется 484 кДж
Полное сгорание 18 г CH3COOH (ж.) до CO2 (г.) и H2O (ж.)
Выделяется 268,2 кДж
Полное сгорание 18,4 г C2H5OH (ж.) до CO2 (г.) и H2O (ж.)
Выделяется 558,8 кДж
Образование 52,8 г CH3COOC2H5 (ж.) в ходе реакции этерификации
Выделяется 3 кДж
Испарение 9 г H2O (ж.)
Поглощается 22 кДж
1. На основании приведенных данных напишите термохимические уравнения, тепловые эффекты которых соответствуют:
• стандартной теплоте образования H2O (г.);
• стандартной теплоте сгорания CH3COOH (ж.);
• стандартной теплоте сгорания C2H5OH (ж.);
• тепловому эффекту реакции этерификации (в расчете на 1 моль эфира).
2. Рассчитайте тепловой эффект реакции этилового эфира уксусной кислоты с водородом на палладиевом катализаторе (в расчете на 1 моль эфира).
1. Стандартные теплоты образования относятся к количеству образуемого вещества, равному одному молю.

следовательно, для написания требуемого термохимического уравнения количество выделившейся в реакции теплоты надо разделить на два:
H2 (г.) + 0,5O2 (г.) = H2O (г.) + 242 кДж. (1)
Стандартная теплота сгорания – тепловой эффект сгорания в кислороде 1 моль вещества до CO2 (г.) и H2O (ж.) (а также N2 (г.), SO2 (г.) и т. д.).

Qсгор(СH3СООН) (ж.) = 268,2/0,3 = 894 кДж/моль;
CH3COOH (ж.) + 2О2 (г.) = 2CO2 (г.) + 2H2O (ж.) + 894 кДж. (2)

Qсгор(С2H5OН) (ж.) = 558,8/0,4 = 1397 кДж/моль;
C2H5OH (ж.) + 3О2 (г.) = 2CO2 (г.) +3H2O (ж.) + 1397 кДж. (3)

Q = 3/0,6 = 5 кДж/моль;
C2H5OH (ж.) + CH3COOH (ж.) = CH3COOC2H5 (ж.) + H2O (ж.) + 5 кДж. (4)
2. Взаимодействие эфира с водородом на палладиевом катализаторе:
CH3COOC2H5 (ж.) + 2H2 (г.) = 2C2H5OH (ж.) + Qx. (5)
Для вычисления неизвестного теплового эффекта воспользуемся законом Гесса. Пользуясь термохимическими уравнениями как алгебраическими выражениями, необходимо так скомбинировать уравнения (1)–(4), чтобы получить уравнение (5). При этом после данной комбинации должны остаться только слагаемые уравнения (5). Из анализа термохимических уравнений (1)–(4) следует, что для вычисления теплового эффекта Qx необходимо учесть тепловой эффект испарения воды, потому что оперировать формулами веществ как обычными членами математических уравнений можно только если эти вещества находятся в одинаковых состояниях.
http://www.soloby.ru/487519/%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B8-%D0%B3%D0%B0%D0%B7%D0%BE%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D0%BD%D0%BE%D0%B3%D0%BE-%D1%81%D0%BE%D0%BE%D1%82%D0%B2%D0%B5%D1%82%D1%81%D1%82%D0%B2%D0%B8%D0%B8-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D0%B5%D0%BC-%D0%B2%D1%8B%D0%B4%D0%B5%D0%BB%D0%B8%D0%BB%D0%BE%D1%81%D1%8C
http://pandia.ru/text/82/004/90439-3.php