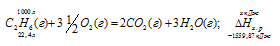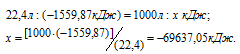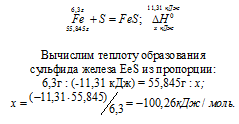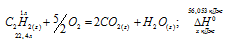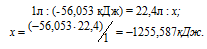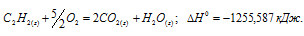Правильный расчет теплового эффекта реакций и теплот образования веществ
Тепловой эффект реакции
Задание 95.
Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 15/2О2(г) = 6СО2(г) + 3Н2О(г); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования бензола равна +33,9 кДж. Ответ: —3135,58 кДж.
Решение:
∆H°С6Н6(парообр.) = +33,9 кДж/моль;
∆H°С6Н6(г) = +82,9 кДж/моль;
∆H°Н2О = -241,98 кДж/моль;
∆H°СО2 = -393,51 кДж/моль;
(С6Н6(ж) → (С6Н6(г); ∆H = +33,9 кДж;
ΔН = ?
Зная мольную теплоту парообразования и мольную теплоту образования газообразного бензола, рассчитаем мольную теплоту образования жидкого бензола из соотношения:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Ответ: ΔН = -3136 кДж.
Задание 96.
Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моля этана С2Н6(г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м 3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж.
Решение:
Уравнение реакции горения этана имеет вид:
С2Н6 (г) + 31/2O2 = 2СО2(г) + 3Н2О (ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Рассчитаем теплоту, выделяющуюся при сжигании 1м 3 этана из пропорции:
Ответ: . Q = 69637,05 кДж.
Теплота образования вещества
Задание 97.
Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Ответ: —46,19 кДж/моль.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном дав-лении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
4NH3(г) + 3O2 (г) = 2N2(г) + 6Н2O(ж); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Отсюда вычислим теплоту образования NH3:
4 


4 
4

Ответ: –46,19 кДж/моль.
Задание 98.
При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа ЕеS. Ответ: —100,26 кДж/моль.
Решение:
Уравнение реакции имеет вид:
Ответ: —100,26 кДж/моль.
Задание 99.
При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксида углерода. Вычислите теплоту образования С2Н2(г). Ответ. 226,75 кДж/моль.
Решение:
Уравнение реакции горения ацетилена имеет вид:
Рассчитаем теплоту, выделяющуюся при сжигании 1моль ацетилена из пропорции:
Термохимическое уравнение реакции горения ацетилена будет иметь вид:
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:




Ответ: 226,75 кДж/моль.
Задание 100.
При получении молярной массы эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. Ответ: –635,6 кДж.
Решение:
Так как молярная масса эквивалента гидроксида кальция равна 1/2M(Са(ОН)2), то при по-лучении 1моль его выделится 65,06 кДж теплоты (2 . 32,53 = 65,06).
Термохимическое уравнение получения гидроксида кальция из СаО(к) и Н2О(ж) будет иметь вид:
СаО(к) + Н2О(ж) = Са(ОН)2(к); 
Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Отсюда вычислим теплоту образования С2Н2:





Термохимическое уравнение получения аммиака из простых веществ имеет вид N2(г)+3H2(г)=2NH3(г)+95кДж Какое количество теплоты выделится при получении 840 мл (н
Термохимическое уравнение получения аммиака из простых веществ имеет вид $N_ <2(г)>+ 3H_ <2(г)>= 2NH_ <3(г)>+ 95 кДж$ Какое количество теплоты выделится при получении 840 мл (н. у.) аммиака? (Запишите число с точностью до сотых.) Ответ в (кДж).
Получению двух молей аммиака соответствует выделение 95 кДж теплоты.
Получению 0.84/22.4 = 0.0375 моль соответствует х кДж теплоты.
Термохимическое уравнение получения аммиака из простых веществ имеет вид N 2(…
Термохимическое уравнение получения аммиака из простых веществ имеет вид
Какое количество теплоты выделится при получении 840 мл (н. у.) аммиака? (Запишите число с точностью до сотых, кДж.)
Объект авторского права ООО «Легион»
Вместе с этой задачей также решают:
В соответствии с термохимическим уравнением реакции
$2Cl_2O_ <7(г)>= 2Cl_ <2(г)>+ 7O_ <2(г)>+ 570 кДж$
в реакцию вступил оксид хлора(VII) массой 3,66 г. Рассчитайте количество выдели…
Согласно термохимическому уравнению реакции
выделилось 15 кДж теплоты. Сколько граммов оксида кальция вступило в реакцию? (Ответ приведите с…
Какой объём (н. у.) кислорода потребуется для полного сгорания 34 л (н. у.) метана? (Ответ приведите с точностью до целых.) Ответ в (л).
Какой объём кислорода необходим для окисления 46 л оксида серы(IV) в оксид серы(VI)? Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.) Ответ в (…
http://ege-today.ru/ege/himiya/3650/
http://examer.ru/ege_po_himii/2022/zadanie_27/task/rt3c6