Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e07b512ccfa7160 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Примеры решения типовых задач. Задача 1.Термохимическое уравнение реакции
Задача 1.Термохимическое уравнение реакции
Газообразный этиловый спирт можно получить при взаимодействии этилена и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив его тепловой эффект. Сколько теплоты выделится, если в реакцию вступило 10 л этилена при н.у.?
Решение:Составим термохимическое уравнение реакции:
Согласно следствия закона Гесса:
Подставляем значения DН из таблицы:
DНхр = -235,31 – 52,28 – (-241,84) = -45,76кДж
Один моль этилена (н.у.) занимает объем 22,4 л. Исходя из следствия закона Авогардо, можно составить пропорцию:
10 л С2Н4¾DНхр DНхр =20.43 кДж
Если в реакцию вступило 10 л С2Н4, то выделяется 20,43кДж теплоты.
Задача 2. Определение энтальпии реакции
Определить изменение энтальпии химической реакции и ее тепловой эффект.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Решение:
По справочнику определим энтальпии образования компонентов.
ΔH 0 (NaOH) = -426 кДж/моль.
ΔH 0 (H2SO4) = -813 кДж/моль.
ΔH 0 (H2O) = -285 кДж/моль.
ΔH 0 (Na2SO4) = -1387 кДж/моль.
По следствию из закона Гесса определим изменение энтальпии реакции:
ΔHх.р. = [ΔH(Na2SO4) + 2ΔH(H2O)] — [ΔH(H2SO4) + 2ΔH(NaOH)] =
= [-1387 + 2(-285)] — [-813 + 2(-426)] = — 1957 — (-1665) = — 292 кДж/моль.
Определим тепловой эффект:
Q = — ΔHх.р. = 292 кДж.
Ответ: 292 кДж.
Задача 3.Гашение извести описывается уравнением: СаО + Н2О = Са(ОН)2.
ΔHх.р. = — 65 кДж/моль. Вычислить теплоту образования оксида кальция, если ΔH 0 (H2O) = -285 кДж/моль,
ΔH 0 (Ca(OH)2) = -986 кДж/моль.
Решение:
Запишем по закону Гесса:
ΔHх.р. = ΔH 0 (Ca(OH)2) — ΔH 0 (H2O) — ΔH 0 (CaO)
Отсюда,
ΔH 0 (CaO) = ΔH 0 (Ca(OH)2) — ΔH 0 (H2O) — ΔHх.р. = — 986 — (-285) — (-65) = — 636 кДж/моль.
Ответ: — 636 кДж/моль.
Задача 4.Рассчитайте энтальпию образования сульфата цинка из простых веществ при T = 298 K на основании следующих даных :
ZnS = Zn + S ΔH1 = 200,5 кДж
2ZnS + 3O2 = 2ZnO + 2SO2 ΔH2 = — 893,5 кДж
2SO2 + O2 = 2SO3 ΔH3 = — 198,2 кДж
ZnSO4 = ZnO + SO3 ΔH4 = 235,0 кДж
Решение:
Из закона Гесса следует, что, поскольку путь перехода не важен, расчеты подчиняются алгебраическим правилам работы с обычными уравнениями. Иными словами, их можно «тасовать» как угодно. Попробуем применить эту возможность.
Нам необходимо прийти к уравнению:
Zn + S + 2O2 = ZnSO4.
Для этого скомпонуем имеющийся «материал» так, чтобы слева оказались Zn, S, O2, а справа — сульфат цинка. Перевернем первое и четвертое уравнение слева направо, а во втором и третьем разделим коэффициенты на 2.
Получим:
Zn + S = ZnS
ZnS + 1,5O2 = ZnO + SO2
SO2 + 0,5O2 = SO3
ZnO + SO3 = ZnSO4.
Теперьпопростусложимправыечастиилевыечасти.
Zn + S + ZnS + 1,5O2 + SO2 + 0,5O2 + ZnO + SO3 = ZnS + ZnO + SO2 + SO3 + ZnSO4
Чтобудетравно
Zn + S + 2O2 + ZnS + SO2 + SO3 + ZnO = ZnS + SO2 + SO3 + ZnO + ZnSO4
Видно, да, чтополучается? Все подчеркнутоесокращаем (опять же, чистая арифметика!)
И имеем в итоге
Zn + S + 2O2 = ZnSO4 — что и требовалось.
Теперь применим тот же принцип и к энтальпиям. Первую и четвертую реакции перевернули, значит, энтальпии получат противоположный знак. Вторую и третью делим пополам (поскольку делили коэффициенты).
ΔH = — 200,5 + (-893,5/2) + (-198,2/2) + (-235,0) = — 981,35 кДж/моль.
Ответ:- 981,35 кДж/моль.
Задача 5.Вычислите энтальпию реакции полного окисления этилового спирта до уксусной кислоты, если энтальпия образования всех веществ, участвующих в реакции, равны:
Решение:Реакция окисления этилового спирта:
Задача 6.Определение теплоты сгорания
Вычислите теплоту сгорания этилена С2Н4(г) + 3O2 = 2СO2(г) + 2H2O(г) если теплота его образования равна 52,3 кДж/моль. Каков тепловой эффект сгорания 5 л. этилена?
Решение:
Определим изменение энтальпии реакции по закону Гесса.
По справочнику определим энтальпии образования компонентов, кДж/моль:
ΔH 0 (C2H4(г)) = 52.
ΔH 0 (CO2(г)) = — 393.
ΔH 0 (H2O(г)) = — 241.
ΔHх.р. = [2*(-393) + 2*(-241)] — [52,3 + 0] = -1320 кДж/моль.
Количество выделившегося тепла при сгорании 1 моль этилена Q = — ΔHх.р. = 1320 кДж
Количество теплоты, выделяющейся при сгорании 5 л. этилена:
Q1 = Q * V / Vm = 1320 * 5 / 22,4 = 294,6 кДж.
Ответ:294,6 кДж.
Задача 7.Температура наступления равновесия
Определить температуру, при которой наступит равновесие системы:
CH4(г) + CO2(г) = 2CO (г) + 2H2(г)
ΔHх.р. = + 247,37 кДж.
Решение:
Критерием возможности протекания химической реакции служит энергия Гиббса, ΔG.
ΔG 0, реакция невозможна.
С энтальпией и энтропией энергия Гиббса связана соотношением:
ΔG = ΔH — TΔS.
Отсюда, для наступления равновесия (достижения порога), должно выполниться соотношение:
T = ΔH/ΔS
Определим изменение энтропии по следствию из закона Гесса.
CH4(г) + CO2(г) = 2CO (г) + 2H2(г)
ΔS 0 х.р. = [2*S 0 (CO) + 2*S 0 (H2)] — [S 0 (CH4) + S 0 (CO2)]
Выписав из справочника соотв. значения, решаем:
ΔS 0 х.р. = (2*198 + 2*130) — (186 + 213) = 656 — 399 = 257 Дж/моль*К = 0,257 кДж/моль*К.
T = ΔH/ΔS = 247,37/0,257 = 963 о К.
Ответ:963 о К.
Задача 8.Знак изменения энтропии
Не производя вычислений, определить знак изменения энтропии процессов:
1. H2O(г) —> H2O(ж)
2. 2H2S + O2 = 2S(тв.) + 2H2O(ж)
3. (NH4)2CO3(тв.) = 2NH3 + CO2 + H2O (все продукты газообразны).
Решение:
Поскольку энтропия — мера неупорядоченности системы, то выполняется общая закономерность:
S(тв.) 0.
Задача 9.Возможность процесса
Заданы условия:
1. ΔS 0
3. ΔS > 0, ΔH 0, ΔH > 0
Проанализировать возможность протекания реакции.
Решение:
В решении будем опираться на формулу: ΔG = ΔH — TΔS. (Подробнее — см. задача № 7).
1. При ΔS |TΔS|), т.е. в целом энергия Гиббса будет меньше нуля, реакция возможна.
2. ΔS 0.
И первое, и второе слагаемое больше нуля. Энергия Гиббса больше нуля. Реакция невозможна.
3. ΔS > 0, ΔH 0, ΔH > 0
Первое слагаемое формулы (ΔH) больше нуля, а второе, за счет положительного знака энтропии, больше нуля
(-T(+ΔS) = — TΔS) . Возможность реакции будет определяться соотношением величин первого и второго слагаемого. Если значение энтальпии (по модулю) будет больше произведения TΔS, (|ΔH| > |TΔS|), т.е. в целом энергия Гиббса будет больше нуля, реакция невозможна. Однако, с ростом температуры будет расти (по модулю) второе слагаемое, и за определенным пределом температуры реакция станет возможна.
Ответ: 1 – возможна; 2 — невозможна.; 3 – возможна; 4 – возможна.
Задача 10.На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислить DG o 298 реакции СО(г) + H2O(ж) = СО2(г) + Н2(г) Возможна ли эта реакция при стандартных условиях?
Решение:DG о определяем из уравнения DG o =DH o -TDS o
DHхр = DНСО2 — DНСО — DНН2О (ж) == -393,51 – (110,52) – (-285,84) = -218,19 кДж.
DG = -218,19 – 298 × 0,07639 = -240,8 кДж
DG 0 298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ∆S 0 298 в этом процессе? Ответ: +24,19 кДж; +31,34 Дж/К.
Вариант 7
1. В каком направлении самопроизвольно протекают химические реакции? Что является движущей силой химического процесса?
2. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: -277,67 кДж.
Вариант 8
1. Что такое изобарно – изотермический потенциал химической реакции и как он связан с изменением энтальпии и энтропии реакции?
2. Тепловой эффект реакции 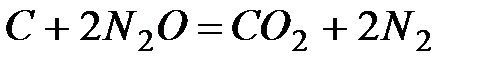
Вариант 9
1. Что такое энтропия реакции?
2. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите ∆G 0 298 реакции, протекающей по уравнению NH3 (г) + HCl(г) = NH4Cl(к). Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92,08 кДж.
Вариант 10
1. Как изменяется энтропия с увеличением движения частиц в системе?
2. Пользуясь значениями 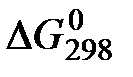
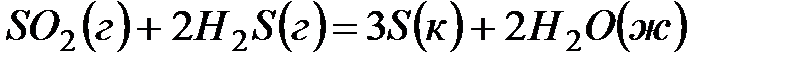
Вариант 11
1. Основные Понятия термодинамики: система, фаза, виды систем, параметры состояния систем, виды процессов.
2. Определить энтальпию реакции спиртового брожения глюкозы
Вариант 12
1. Первый закон термодинамики для изохорного и изобарного процессов. Энтальпия.
2. Определить энтальпию реакции: NH3(г) + НСl (г) = NH4Cl (Т)
∆Нº 298 (НCl) = — 92,3 кДж/моль
∆Нº (NН3) = — 46,2 кДж/моль
∆Нº (NH4Cl) = — 313,6 кДж/моль
Вариант 13
1. Термохимия: экзо- и эндотермические реакции. Термохимические уравнения, их особенности.
2. Определите какая из данных реакций экзо-, а какая эндотермическая реакция? Ответ обоснуйте.
Вариант 14
1.Что такое параметры системы? Какие параметры Вы знаете?
2. Вычислить энтальпию образования газообразного серного ангидрида,если при сгорании 16 г.серы выделилось 197.6 кДж тепла.
Вариант 15
1. Перечислить функции состояния системы.
2. При какой температуре наступит равновесие системы
Хлор или кислород в этой системе является более сильным окислителем и при какой температуре? Ответ: 891К.
Вариант 16
1. Какие типы термодинамических процессов Вы знаете?
2. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2 (г) + СО2(г) = СО(г) + Н2О(ж); ∆Н = -2,85 кДж. Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ∆G 0 298 этой реакции. Ответ: -19,91 кДж.
Вариант 17
1. Закон Гесса и следствия, вытекающие из него.
2. Определите 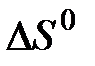
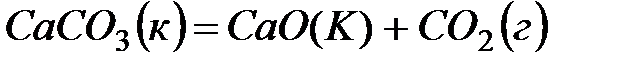
Вариант 18
1. Чем отличается энтальпия образования вещества от энтальпии реакции?
2. Вычислите ∆Н 0 ,∆S 0 ,∆G 0 Т реакции, протекающей по уравнению Fe2O3(к) + 3Н2(г) = 2Fe(к) + 2Н2О(г). Возможна ли реакция восстановления Fe2O3 водородом при 500 и 2000 К? Ответ: +96,61 кДж; 138,83 Дж/К; 27,2 кДж; -181,05 кДж.
Вариант 19
1. Какие процессы сопровождаются увеличением энтропии?
2. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
Н2(г) + 
Вариант 20
1. Какие процессы сопровождаются увеличением энтропии?
2. Подсчитав 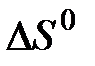
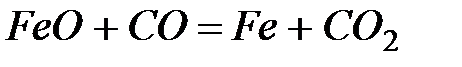
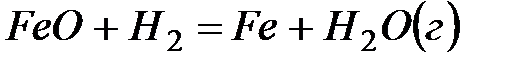
Вариант 21
1. Что называется стандартной энтальпией образования?
2. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G 0 298 реакции, протекающей по уравнению СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж). Возможна ли эта реакция при стандартных условиях? Ответ: -130,89 кДж.
Вариант 22
1. Каков знак ∆ G процесса таяния льда при 263 К?
2. Уменьшается или увеличивается энтропия при переходах а) воды в пар; б) графита в алмаз? Почему? Вычислите ∆S 0 298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: а) 118,78 Дж/(моль∙К); б) -3,25 Дж/(моль∙К).
Вариант 23
1. Каков знак ∆ H процесса горения угля?
2. При стандартных условиях реакция 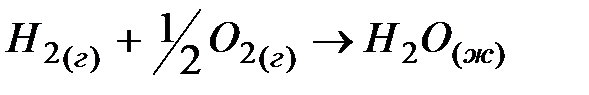
Вариант 24
1. Каков знак ∆ S процесса сублимации “сухого льда”?
2. Вычислите ∆Н О ,∆S О ,∆G О Т реакции, протекающей по уравнению TiO2(к) +2C(к) = Ti(к) + 2СО(г). Возможна ли реакция восстановления TiO2 углеродом при 1000 и 3000 К? Ответ: +722,86 кДж; 364,84 Дж/К; +358,02 кДж; -371,66 кДж.
Вариант 25
1. Каков знак изменения энтропии в процессе кипения воды?
2. Найдите изменение внутренней энергии при испарении 75г этилового спирта при температуре кипения, если удельная теплота его испарения равна 857,7 Дж/г, а удельный объем пара при температуре кипения равен 607 см 3 /г. Объемом жидкости пренебречь. Ответ: 58,39 кДж.
Вариант 26
1. II закон термодинамики. Теорема Карно — Клаузиуса.
2. Рассчитайте расход тепловой энергии при реакции 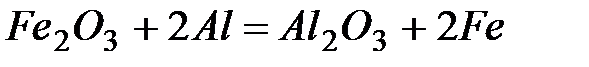
Вариант 27
1. III закон термодинамики.
2. Реакция горения ацетилена протекает по уравнению
С2Н2(г) + 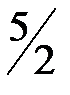
Вычислите ∆G 0 298 и ∆S 0 298. Объясните уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216,15 Дж/(моль∙К).
Вариант 28
1. Теорема Нернста.
2. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Вариант 29
1. Постулат Планка.
2. При какой температуре наступит равновесие системы
Вариант 30
1. Основы термодинамических расчетов
2. Подсчитав тепловой эффект и изменение энергии Гиббса при 25ºC для реакции 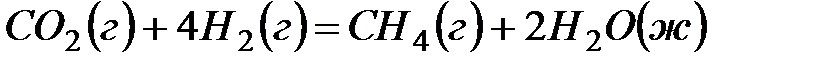
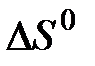
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. (Ответ: -45,76 кДж)






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
(Ответ: -45,76 кДж)
Решение :
Запишем уравнение реакции:
Тепловой эффект реакции рассчитаем по следствию из закона Гесса:
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Какой из растворов, взятых в одинаковом объеме и содержащих одинаковое число граммов растворенного вещества, имеет при одинаковой температуре большее осмотическое давление — глюкозы или мочевины?
- Водный раствор HF содержит 12,5 г кислоты в 10 л раствора. Степень диссоциации кислоты равна 8 %. Чему равна константа диссоциации HF? (Ответ: 4,3*10-4)
- Какие из приведенных реакций относятся к реакциям обмена и к окислительно-восстановительным реакциям? 2-3. KMnO4 + HNO2 + H2SO4 MnSO4 + K2SO4 + HNO3 Ca(OH)2 + CO2 Ca(HCO3)2 Bi2S3 + HNO3 Bi(NO3)
- Какое уравнение отражает корпускулярно-волновой дуализм микрообъектов? Почему и как реально проявляются волновые свойства электрона? Почему не проявляются волновые свойства макрообъектов
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://lektsii.org/12-35669.html
http://natalibrilenova.ru/gazoobraznyij-etilovyij-spirt-s2n5on-mozhno-poluchit-pri-vzaimodejstvii-etilena-s2n4-g-i-vodyanyih-parov-napishite-termohimicheskoe-uravnenie-etoj-reaktsii-vyichisliv-ee-teplovoj-effekt-otvet-4576-kdzh/


