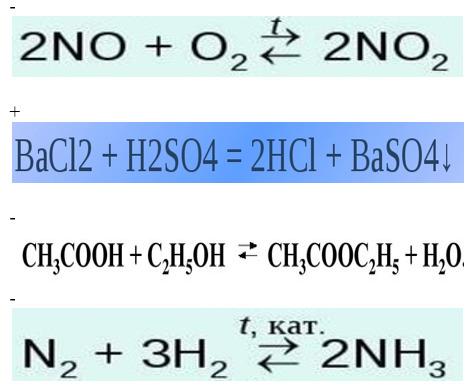Тест по химии химические уравнения 11 класс
Тесты по химии 11 класс. Тема: «Химические реакции»
Правильный вариант ответа отмечен знаком +
Вариант 1
1. К химическим реакциям по изменению степени окисления не относятся химические реакции:
2. К реакциям разложения относятся:
— взаимодействие лития с кислородом
+ распад оксида ртути на ртуть и кислород
— взаимодействие цинка с соляной кислотой
3. К реакциям соединения относятся:
+ взаимодействие алюминия с серой
— взаимодействие уксусной кислоты с магнием
— взаимодействие магния с водородом
4. К реакциям замещения относятся:
+ взаимодействие цинка с соляной кислотой
— взаимодействие углерода с водородом
— взаимодействие лития с кислородом
5. Процессы, в результате которых происходит изменение степеней окисления, называются:
+ окислительно – восстановительными реакциями
6. Какой метод используется при расстановке коэффициентов в уравнении?
7. По числу и составу исходных и образующихся веществ не относится реакция:
+ по радикальному механизму
8. К реакциям разложения относится:
+ 2 KClO3= 2 KCl + 3O2 (газ)
— 2 Fe + 3 Cl2 = 2 FeCl3
— HCOOH + NaOH — ≥ HCOONa + H2O
9. К реакциям соединения относится:
+ 2 Fe + 3 Cl2 = 2 FeCl3
— CH4 + Cl2 — ≥(свет) CH3Cl + HCl
— 2 СH4 =(t) C2H2 (газ) + 3H2 (газ)
тест 10. К реакциям характерным для органических веществ относится:
+ идущие по ионному механизму
11. По тепловому эффекту реакции подразделяются на:
+ экзотермические и эндотермические
— обратимые и необратимые
— идущие по радикальному механизму и ионному механизму
12. Экзотермическими называют реакции, которые:
+ идут с выделением теплоты
— идут с поглощением теплоты
— идут до полного израсходования одного из реагирующих веществ
13. Эндотермическими называют реакции, которые:
— идут с выделением тепла
+ идут с поглощением тепла
— идущие при данных условиях во взаимно противоположных направлениях
14. Примером эндотермической реакции является:
— H2(г) + Сl2 (г) = 2 HCl ( г) + 184.6 кДж
+ ½ N2(г) + 1/2O2 (г) = NO( г) – 90.4 кДж
— H2(г) + 1/2O2 (г) = H2O( жидк.) + 285.8 кДж
15. Теплотой образования называют:
+ уровень теплоты, который выходит или используется при выделении одного моля соединения из простых веществ
— уровень теплоты, который выходит при сгорании одного моля вещества
— уровень теплоты, выходящий или используемый при реакции
16. Теплотой сгорания называют:
— уровень теплоты, выходящий или используемый при выделении одного моля соединения из простых веществ
+ уровень теплоты, выходящий при сгорании одного моля вещества
— уровень теплоты, выходящий или используемый при реакции
17. Термохимическими называют реакции, в которых указано:
— уровень теплоты, выходящий или используемый при образовании одного моля соединения из простых веществ
— уровень теплоты, выходящий при сгорании одного моля вещества
+ уровень теплоты, выходящий или поглощаемый при реакции
18. По признаку обратимости реакции подразделяются на:
+ обратимые и необратимые
— экзотермические и эндотермические
— замещения, обмена, разложения, соединения
19. Необратимой называется реакция:
+ идущая до конца, то есть до полного израсходования одного из реагирующих веществ
— которая идет во взаимно противоположных плоскостях
— идущая с выделением теплоты
тест-20. Обратимой называется реакция:
— идущая до конца, то есть до полного израсходования одного из реагирующих веществ
+ которая идет во взаимно противоположных плоскостях
— идущая с выделением теплоты
Вариант 2
1. Чему равен коэффициент окислителя в реакции, протекающей согласно схеме Al + H2SO4 = Al2(SO4)3 + H2?
— единице
2. Выберите вещества, после вступления в реакцию которых образуется химический процесс, который можно описать сокращенным ионным уравнением 2H + + CO3 2- = H2O + CO2:
3. К соединительным реакциям относится:
+ взаимодействие Al с S
— взаимодействие CH3COOH с Mg
— взаимодействие Mg с H2
— все ответы верные
4. Какая реакция не является окислительно-восстановительной?
5. Из представленных ниже вариантов выберите необратимую реакцию:
6. Как называется раствор, вещество в котором при определённой температуре не подлежит растворению?
7. К обратимой относятся реакции, которые:
— протекают до конца
+ идут во взаимно противоположных плоскостях
— заканчиваются выделением тепла
— происходят лишь с применением катализатора
8. Повысить скорость химического взаимодействия, описываемого уравнением 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q, возможно, если:
+ мелко подробить железный колчедан
— применять воздух, насыщенный азотом
— абсорбировать SO2 водой
9. Как называется метод, предназначенный для уравнения химических реакций?
тест 10. Гидролизу не подвергается соль:
11. Окислительно-восстановительная реакция — это:
— нейтрализация CH₃COOH гидроксидом кальция
12. Газ, выделяющийся вследствие реакции между СaC2 и Н2О:
13. Что подразумевается под «теплотой сгорания»?
— степень тепла, вышедшая либо израсходованная в процессе выделения 1 моль вещества из простого соединения
— изменение энтальпии химической системы за счёт протекания взаимодействующей реакции
+ количество тепла, получаемое при сгорании 1 моль вещества
— нет правильного ответа
14. Щелочной показатель рН характерен для раствора:
15. Какой тип химических реакций не классифицируется по количеству и составу исходных и конечных веществ?
+ по радикальному механизму
16. Кислотный рН характерен для водного раствора:
17. Реакцией разложения является:
— взаимодействие Li с O2
+ распад HgO на Hg и O2
— взаимодействие Fe с CuSO4
— взаимодействие Zn с HCl
18. В результате какой реакции состав вещества остаётся прежним?
19. На смещение равновесия системы N2(г) + О2(г) = 2NO(г) – Q не влияет:
— повышение концентрации NO
— уменьшение концентрации N2
тест-20. Скорость прямого взаимодействия в системе N2 + 3H2 = 2NH3 + Q возрастает при:
+ увеличении концентрации азота
— уменьшении концентрации аммиака
— уменьшении концентрации азота
— увеличении концентрации аммиака
21. По характеру обратимости реакции классифицируются на:
— идущие с изменением и без изменения степени окисления атомов
— соединения, разложения, обмена, замещения
22. Взаимодействие NaOH с H₃PO₄ относится к реакциям:
23. Какая соль в водном растворе изменяет цвет фенолфталеин на малиновый?
24. К реакциям замещения относится:
+ взаимодействие Zn с HCl
— взаимодействие NaOH с HCl
— взаимодействие C с H2
— взаимодействие Li с O2
25. Кислый рН характерен для водного раствора:
26. Уравнение 2Na + 2H2O = 2NaOH + H2 + Q описывает реакцию:
27. Какое вещество образуется путём соединения водных растворов Na2CO3 и Al₂(SO₄)₃:
28. Эндотермические реакции – это те, которые:
+ идут с поглощением теплоты
— протекают в обычных условиях, но в противоположных направлениях
— невозможны без участия катализатора
— протекают с выделением теплоты
29. Укажите, чему равно значение коэффициентов химической реакции Mg + HNO3 = Mg(NO3)2 + N2 + H2O:
тест_30. К какому типу относится реакция, отображенная на рисунке ниже?
Тест по теме: «Химические реакции»
тест по химии (11 класс) по теме
тест по химии 11 класс
Скачать:
| Вложение | Размер |
|---|---|
| тестирование | 62.12 КБ |
Предварительный просмотр:
Тест по теме «Химические реакции» 11 класс
Часть А (задания с выбором ответа)
- Укажите химическую реакцию, в результате которой состав вещества не меняется:
- 2SO 2 + O 2 2SO 3
- 3H 2 + N 2 2NH 3
- C (графит) + O 2 = CO 2
- 3O 2 = 2O 3
- Укажите уравнение реакции обмена
- 2Н 2 О + 2 Na = 2NaOH + H 2
- CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl
- 2KMnO 4 t K 2 MnO 4 + MnO 2 + O 2
- 2SO 2 + O 2 = 2 SO 3
- К окислительно – восстановительным не относится реакция:
- Гидрирования жиров
- Гидролиза жиров
- Ароматизации циклоалканов
- Гидратации алкенов
- Укажите тип следующей реакции: nCH 2 =CH 2 (-CH 2 -CH 2 -) n
- реакция присоединения
- р еакция обмена
- р еакция замещения
- р еакция разложения
- К окислительно – восстановительным относится реакция:
- гидролиза крахмала
- полимеризации метилметакрилата
- гидрирования ацетилена
- нейтрализации уксусной кислоты гидроксидом кальция
- Укажите реагенты, взаимодействие которых приводит к следующему сокращенному ионному уравнению реакции: 2H + + CO 3 2- = H 2 O + CO 2
- CaCO 3 + HCl
- Na 2 CO 3 + CH 3 COOH
- NaHCO 3 + HCl
- Na 2 CO 3 + HCl
- Скорость химической реакции зависит от:
- природы реагирующих веществ
- температуры реакции
- присутствия катализатора
- от каждого из перечисленных факторов
- Укажите верное суждение: А) при нагревании на 10 0 С скорость экзотермической реакции увеличивается в 2-4 раза; Б) при нагревании на 10 0 С скорость эндотермической реакции увеличивается в 2-4 раза.
- верно только А
- верны оба суждения
- верно только Б
- оба суждения неверны
- Укажите обратимую реакцию
- 2Al + 3O 2 = Al 2 O 3
- 2Na + 2H 2 O = 2NaOH + H 2
- N 2 + 3H 2 = 2NH 3
- C 3 H 8 + 5O 2 = 3CO 2 + 4H 2 O
- Раствор, в котором при данной температуре вещество больше не растворяется, называется
- разбавленным
- концентрированным
- насыщенным
- перенасыщенным
- Укажите формулу осадка, образующегося при сливании водных растворов карбоната натрия и сульфата алюминия
- Al 2 (CO 3 ) 3
- Al 4 C 3
- Al(OH) 3
- Al 2 O 3
- Укажите газ, который выделяется при взаимодействии карбида кальция СaC 2 с водой
- метан
- ацетилен
- этилен
- пропан
- Краткое ионное уравнение CO 3 2- + H 2 O HCO 3 — + OH —
соответствует первой стадии гидролиза
- карбоната аммония
- гидрокарбоната калия
- карбоната калия
- карбоната кальция
- Водный раствор какой соли окрашивает фенолфталеин в малиновый цвет?
- сульфид калия
- сульфат натрия
- сульфат алюминия
- сульфид алюминия
- Кислотную среду имеет водный раствор следующей соли
- хлорид серебра
- сульфат натрия
- ацетат аммония
- хлорид железа (III)
- Определите коэффициент перед окислителем в уравнении реакции по схеме:
Al + H 2 SO 4 Al 2 (SO 4 ) 3 + H 2
- 3
- 1
- 4
- 2
- Определите коэффициент перед восстановителем в уравнении реакции по схеме:
Ca + H 2 O Ca(OH) 2 + H 2
- 2
- 1
- 3
- 4
- Определите объем водорода, который выделится, если 6,9 г натрия поместить в избыток воды
- 3,36 л
- 2,24 л
- 4,48 л
- 6,72 л
- Определите сумму коэффициентов в уравнении реакции по схеме:
Mg + HNO 3 Mg(NO 3 ) 2 + N 2 + H 2 O
- 23
- 20
- 26
- 29
- По термохимическому уравнению реакции горения оксида углерода (II) газа:
2CO 2 (г) + О 2 (г) = 2СО 2 (г) + 566 кДж. Определите объем (н.у.) сгоревшего оксида углерода(II), если выделилось 1520 кДж теплоты.
- 249 л
- 120 л
- 60 л
- 30 л
- Увеличить скорость реакции 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 + Q можно, если:
- измельчить пирит (FeS 2 )
- использовать воздух, обогащенный азотом
- поглощать оксид серы (IV) водой
- снижать температуру
Часть В ( задания с кратким ответом)
- Установите соответствие между уравнением химической реакции и классификацией этой реакции. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
А) S + O 2 = SO 2 1) реакция с изменением состава вещества
Б) 3О 2 = 2О 3 2) реакция без изменения состава вещества
Тестовая работа по теме «Химические реакции» 11 класс
Тестовая работа по химии, для учащихся 11 классов. Тема урока ионные уравнения. Помощь при подговке к ЕГЭ по химии.
Просмотр содержимого документа
«Тестовая работа по теме «Химические реакции» 11 класс»
Тема «Химические реакции» (тестовая работа)1 вариант
1. Взаимодействие гидроксида натрия с ортофосфорной кислотой относится к реакциям
а) замещения; б) обмена; в) присоединения; г) разложения.
2. Реакция, уравнение которой 2Na + 2H2O = 2NaOH + H2 + Q, относится к реакциям:
а) замещения, экзотермическим; в) соединения, эндотермическим;
б) разложения, экзотермическим; г) обмена, эндотермическим.
3. Сокращенное ионное уравнение Са 2+ + СО3 2- = СаСО3 соответствует взаимодействию
а) хлорида кальция и карбоната натрия;
б) сульфида кальция и углекислого газа;
в) гидроксида кальция и углекислого газа;
г) ортофосфата кальция и карбоната калия.
4. В соответствии с термохимическим уравнением реакции
2СО(г) = СО2(г) + С(т) = 173 кДж выделилось 1730 кДж теплоты. Объем оксида углерода (II), вступившего в реакцию, равен:
а) 112л б) 224л в) 336л г) 448л.
5. Скорость прямой реакции N2 + 3H2 = 2NH3 + Q возрастает при:
а) увеличении концентрации азота; в) увеличении концентрации аммиака;
б) уменьшении концентрации азота; г) уменьшении концентрации аммиака.
6. Для увеличения скорости реакции железа с соляной кислотой следует:
а) добавить ингибитор; в) повысить давление;
б) понизить температуру; г) увеличить концентрацию HCl.
7. Химическое равновесие в системе СО(г) + 2Н2(г) = СН3ОН(г) + Q сместится в сторону прямой реакции при:
а) понижении температуры; в) повышении концентрации СН3ОН;
б) понижении концентрации СО; г) повышении температуры.
8. На состояние динамического равновесия в системе 2SO2 + O2 = 2SO3 +Q не влияет:
а) катализатор; в) изменение температуры;
б) изменение концентрации г) изменение давления.
9. Какая из солей не подвергается гидролизу?
10. Щелочную среду имеет раствор
а) ацетата натрия; в) нитрата бария;
б) нитрата алюминия; г) сульфата железа (III).
11. Установите соответствие между названием соли и средой ее водного раствора
1. Сульфат натрия
2. Сульфид калия
4. Нитрат алюминия
12. Установите соответствие между реагирующими веществами и сокращенными ионными уравнениями реакций обмена.
Сокращенные ионные уравнения
а) Ag + + Br — = AgBr
в) Al 3+ + 3Cl — = FlCl3
e) Na + + Cl — = NaCl
13. При охлаждении реакционной смеси с 50С до 20С скорость химической реакции уменьшилась в 27 раз. Температурный коэффициент реакции равен __________________________________________________________
14. Начальная концентрация одного из реагирующих веществ составила 0,8 моль/л. Скорость данной химической реакции при данных условиях равна 0,001 моль/л . с. Через 40 секунд концентрация данного вещества составит _______________________________________________________
1. Реакцией замещения является
а) горение водорода в кислороде;
б) восстановление оксида меди (II) водородом;
в) взаимодействие гидроксида калия с серной кислотой;
г) термическая дегидратация гидроксида цинка.
2. Реакция, уравнение которой 3H2 + N2 = 2NH3 + Q, является
а) обратимой, экзотермической; в) обратимой, эндотермической;
б) необратимой, экзотермической; г) необратимой, эндотермической.
3. Сокращенное ионное уравнение реакции Cu 2+ + 2OH — = Cu(OH)2 соответствует взаимодействию между
а) нитратом меди (II) и гидроксидом железа (III);
б) оксидом меди (II) и гидроксидом натрия;
в) хлоридом меди (II) и гидроксидом кальция;
г) оксидом меди (II) и водой.
4. В соответствии с термохимическим уравнением реакции
С6Н12О6 + 6О2 = 6СО2 + 6Н2О+ 280 кДж 140 кДж теплоты выделяется при сгорании глюкозы массой
а) 90 г б) 180 г в) 270 г г) 360 г.
5. Для увеличения скорости реакции 2CO(г) + O2(г) = 2СО2(г) +Q необходимо
а) увеличить концентрацию СО; в) понизить давление;
б) уменьшить концентрацию О2; г) понизить температуру.
6. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния
а) концентрация кислоты; в) температура реакции;
б) измельчение железа; г) увеличение давления.
7. Равновесие в системе Н2(г) + I2(г) = 2HI(г) + Q сместится в сторону продуктов реакции
а) при повышении температуры; в) в присутствии катализатора;
б) при повышении давления; г) при понижении температуры.
8. На смещение равновесия системы N2(г) + О2(г) = 2NO(г) – Q не оказывает влияния
а) повышения температуры; в) повышение концентрации NO;
б) повышение давления; г) уменьшение концентрации N2.
9. Кислую среду имеет водный раствор
10. Среди предложенных солей CH3COONH4, CuBr2, Al2(SO4)3 гидролизу подвергается (-ются)
11. Установите соответствие между названием соли и средой ее водного раствора
1. Карбонат калия
3. Сульфат цинка
4. Хлорид железа (III)
12. Установите соответствие между сокращенными ионными уравнениями реакций обмена и веществами, вступающими в реакцию
Сокращенные ионные уравнения
4. Cd 2+ + S 2- = CdS
13. Температурный коэффициент реакции равен 5. Чтобы скорость реакции увеличилась в 125 раз, надо повысить температуру на ____ градусов.
14. Концентрация одного из реагирующих веществ в начальный момент времени составляла 1 моль/л, а через 20 секунд – 0,6 моль/л. Скорость данной реакции равна __________________________________________
http://nsportal.ru/shkola/khimiya/library/2013/04/13/test-po-teme-khimicheskie-reaktsii
http://kopilkaurokov.ru/himiya/uroki/tiestovaia_rabota_po_tiemie_khimichieskiie_rieaktsii_11_klass