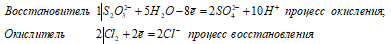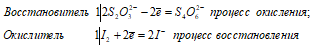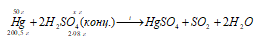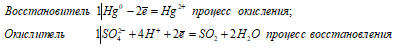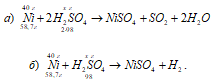Тиосульфат натрия
| Тиосульфат натрия | |||
|---|---|---|---|
| |||
| Систематическое наименование | тиосульфат натрия | ||
| Традиционные названия | гипосульфит | ||
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) | ||
| Молярная масса | 158,11 г/моль | ||
| Плотность | 2,345 г/см³ | ||
| Температура | |||
| • плавления | 48,5 °С (пентагидрат) | ||
| • разложения | 300 °C | ||
| Растворимость | |||
| • в воде | 70,1 20 ; 229 80 г/100 мл | ||
| Рег. номер CAS | 7772-98-7 | ||
| PubChem | 24477 | ||
| Рег. номер EINECS | 231-867-5 | ||
| SMILES | |||
| Кодекс Алиментариус | E539 | ||
| RTECS | XN6476000 | ||
| ChEBI | 132112 | ||
| ChemSpider | 22885 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
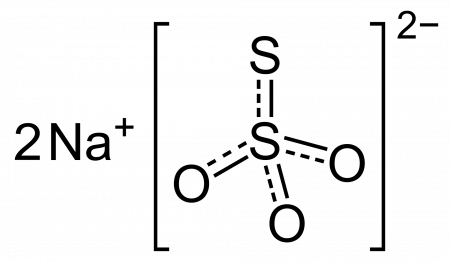
Тиосульфат натрия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
Содержание
Получение
- окислением полисульфидов Na;
- кипячение избытка серы с Na2SO3:
Na2SO3 + S → Na2S2O3
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
4SO2 + 2H2S + 6 NaOH → 3 Na2S2O3 + 5H2O
- кипячение избытка серы с гидроксидом натрия:
4 S + 6 NaOH → 2Na2S + Na2S2O3 + 3H2O
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
2NaNO2 + 2 S → Na2S2O3 + N2O
- растворение сульфида натрия в воде в присутствии кислорода воздуха:
2Na2S + 2 O2 + H2O → Na2S2O3 + 2 NaOH
Физические и химические свойства
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль.
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C)).
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100 о С.
При нагревании до 220 °C распадается по схеме:
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, йодом, переводится в соли тетратионовой кислоты:
Приведённая реакция очень важна, так как служит основой йодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия йодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
Характеристика окислительно-восстановительных свойств серной кислоты. Получение тиосульфата натрия
Реакции получения тиосульфата натрия
Задача 866.
Написать уравнение реакции получения тиосульфата натрия. Какова степень окисленности серы в этом соединении? Окислительные или восстановительные свойства проявляет тиосульфат-ион? Привести примеры реакций.
Решение:
Уравнения реакций получения тиосульфата натрия:
а) Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия:
Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия.
б) Окисление полисульфидов кислородом воздуха:
в) Получение тиосульфата натрия путём взаимодействия серы со щёлочью. Реакция протекает с одновременным окислением и восстановлением серы:
г) Непосредственное взаимодействие сернистого ангидрида с сероводородом в щелочной среде. Для этого смесь обеих газов пропускают при сильном размешивании в раствор едкого натра до его нейтрализации, то образуется тиосульфат натрия:
Атомы серы, входящие в состав тиосульфатов имеют различную степень окисленности; у одного атома степень окисленности равна +4, у другого 0.Тиосульфат-ион S2O3 2- проявляет свойства восстановителя. Хлор, бром и другие сильные окислители окисляют его до сульфат-иона SO4 2- , например:
Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8Cl — + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ 2H 2 SO 4 + 2NaCl + 6HCl l
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4. При нагревании свыше 200 0С тиосульфат натрия распадается по схеме:
4Na2S2O 
При этом протекает реакция самоокисления-восстановления.
Реакции серной кислоты
Задача 867.
Составить уравнения реакций: а) концентрированной Н2SO4 с магнием и с серебром; б) разбавленной Н2SO4 с железом.
Решение:
а) 4Mg + 5Н2SO4(конц.) → 4MgSO4 + H2S↑) + 4H2O;
б) 2Ag + 2Н2SO (конц.) → Ag2SO4 + SO2↑ + 2H2O;
в) Fe + Н2SO4(разб.) → FeSO4 + H2↑.
Задача 868.
Сколько граммов серной кислоты необходимо для растворения 50 г ртути? Сколько из них пойдет на окисление ртути? Можно ли для растворения ртути взять разбавленную серную кислоту?
Решение:
Уравнение реакции:
Из уравнений окисления-восстановления следует, что на окисление 1 моль Hg затрачивается 1 моль H2SO4, следовательно,
200,5 : 98 = 50 : х; х = (98 . 50)/200,5 = 24,44 г.
Находим массу H2SO4 из пропорции:
200,5 : (2 . 98) = 50 : х; х = (2 . 98 . 50)/200,5 = 48,88 г.
Ответ: 48,88 г; 24,44 г. Ртуть стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на ртуть. Следовательно, для растворения ртути нужно взять концентрированную серную кислоту.
Задача 869.
Одинаковое ли количество серной кислоты потребуется для растворения 40 г никеля, если в одном случае взять концентрированную кислоту, а в другом разбавленную? Какая масса серной кислоты пойдет на окисление никеля в каждом случае?
Решение:
Уравнения реакций:
Рассчитаем массу концентрированной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7 : (2 . 98) = 40 : х; х = (2 . 98 . 40)/58,7 = 133,56, г.
Теперь рассчитаем массу разбавленной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7 : 98 = 40 : х; х = (98 . 40)/58,7 = 66,78 г.
Ответ: 133,56 г; 66,78 г. На окисление никеля расходуется одинаковое количество серной кислоты.
Тиосульфат натрия
Тиосульфат натрия — неорганическое соединение, натриевая соль тиосульфатнои кислоты состава Na 2 S 2 O 3. При обычных условиях находится в форме своего кристаллогидрата Na 2 S 2 O 3 · 5H 2 O, который является бесцветными кристаллами; при небольшом нагревании теряет кристаллизационную воду. Тиосульфат проявляет сильные восстановительные свойства, способен образовывать координационные соединения с металлами.
Полулетальные доза тиосульфата натрия составляет 7,5 ± 0,752 г / кг тела (для мышей). Благодаря своей низкой токсичности, тиосульфат может свободно использоваться в медицинских целях — он антидотом при отравлениях цианидами и соединениями серебра.
Тиосульфат натрия применяется в фотографии для растворения бромида серебра, в целлюлозно-бумажной и текстильной отраслях — для нейтрализации остатков хлора. Тиосульфат является реагентом для определения содержания йода, брома, хлора и серы по методу йодометрии. В пищевой промышленности тиосульфат натрия применяется в качестве антиоксиданта и СЕКВЕСТРАНТЫ; в международном реестре пищевых добавок он имеет код E539.
Физические свойства
Чистый тиосульфат натрия представляет собой белый, тяжелым порошком, однако при обычных условиях он находится в форме своего пентагидрата Na 2 S 2 O 3 · 5H 2 O, который кристаллизуется из растворов в виде коротких призматических или продолговатых кристаллов. На сухом воздухе, при 33 ° C, он теряет влагу, а при 48 ° C тиосульфат растворяется в собственной кристаллизационной воде.
| 0 ° C | 10 ° C | 20 ° C | 25 ° C | 30 ° C | 40 ° C | 50 ° C | 60 ° C | 70 ° C | 80 ° C | 90 ° C | 100 ° C |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 33,1 | 36,3 | 40,6 | 43,3 | 45,9 | 52,0 | 62,3 | 65,7 | 68,8 | 69,4 | 70,1 | 71,0 |
Получение
В промышленности тиосульфат натрия синтезируют окислением сульфида, гидросульфида или полисульфидов натрия. Кроме того, одним из распространенных способов является взаимодействие серы с сульфитом натрия:
Добавление серы в суспензии сульфита проводят при постоянном перемешивании. Внесение катионных поверхностно-активных веществ увеличивает смачивания серы и, соответственно, скорость реакции. Выход реакции зависит от температуры, количества серы и интенсивности перемешивания. Растворы тиосульфата натрия фильтруют горячим, предварительно избавившись избытка серы, и при охлаждении из них кристаллизуется гидрат Na 2 S 2 O 3 · 5H 2 O, который дегидратують при температуре 60-105 ° C при атмосферном или пониженного давления. Чистота продукта составляет около 99% и имеет незначительные примеси сульфита и сульфата натрия.
Другими промышленными способами являются обработка соединений натрия диоксидом серы:

Тиосульфат натрия также синтезируется в качестве побочного продукта в производстве серных красителей, где полисульфиды натрия окисляются нитросоединениями:
Химические свойства
Находясь в обычных условиях в форме кристаллогидрата, тиосульфат теряет воду при слабом нагреве:
Дальнейшее нагревание вызывает разложение вещества: с образованием серы или пентасульфиду натрия (с примесями других полисульфидов):

В затемненном месте раствор тиосульфата может сохраняться в течение нескольких месяцев, но при кипячении он сразу разлагается.
Тиосульфат является неустойчивым к действию кислот:


Он является сильным восстановителем:

При взаимодействии с галогенами тиосульфат восстанавливает их в галогенидов:



Последняя реакция нашла применение в аналитической химии в титриметрическом методе йодометрия.
Тиосульфат участвует в реакциях комплексообразования, связывая соединения некоторых металлов, например, серебра:
Применение
Тиосульфат натрия широко применяется в фотографическом деле для растворения бромида серебра с негативов или отпечатков. В целлюлозно-бумажной и текстильной отраслях тиосульфат применяется для нейтрализации остатков хлора он участвует в дехлорирования воды.
В горном Na 2 S 2 O 3 выполняет роль экстрагента серебра с его руд. Тиосульфат является реагентом для определения содержания йода, брома, хлора и серы по методу йодометрии. Также тиосульфат является антидотом при отравлениях цианидами и соединениями серебра.
http://buzani.ru/zadachi/khimiya-glinka/1283-tiosulfat-natriya-sernaya-kislota-zadachi-866-869
http://info-farm.ru/alphabet_index/t/tiosulfat-natriya.html