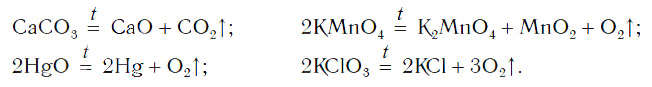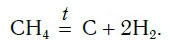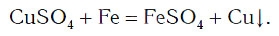Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
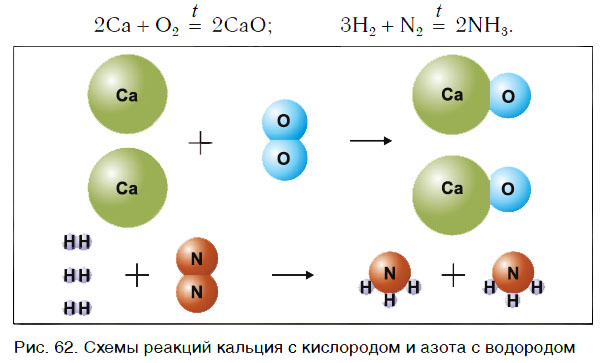
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
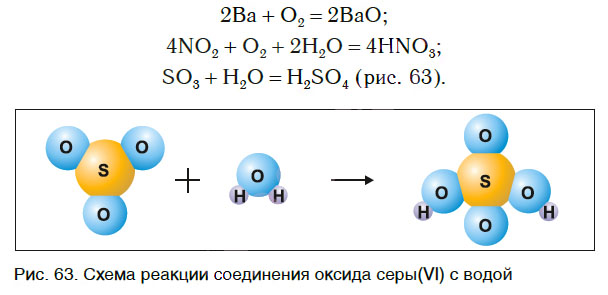
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
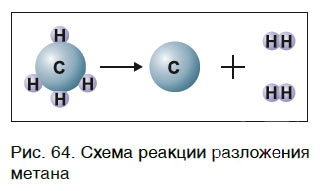
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
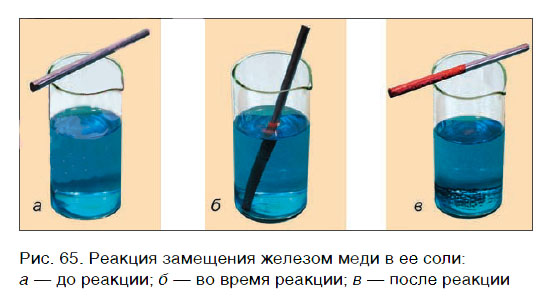
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
- Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
- Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
- Реакции замещения — это реакции, в которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Урок 8 Бесплатно Химическая реакция- уравнение и типы
Начало
Продолжим изучение химической реакции как одной из основ химической науки.
Ведь полноценное понимание этой темы нужно для дальнейшего изучения химии, и в то же время это сделает вас образованнее не только в научном плане, но и в бытовом!
Уравнение химической реакции
Вся информация о протекающей химической реакции (исходные вещества, продукты реакции, условия протекания, тепловой эффект) на письме фиксируется в виде уравнения реакции.
Уравнение можно записать для любой реакции. Для этого нужно знать состав молекул исходных веществ и продуктов.
Всё это записывается в виде химических формул.
Всё происходит как в математике: в левой части записываются формулы исходных веществ, а в правой – формулы продуктов.
Только вместо знака «равно» чаще всего ставят стрелку: она показывает, что реакция идёт именно в этом направлении.
У меня есть дополнительная информация к этой части урока!
В некоторых случаях возможно протекание реакции при одних и тех же условиях в обоих направлениях. В таком случае обычно ставят две стрелки в обе стороны, но также и допустимо ставить знак «равно».
В некоторых случаях (когда это требуется) указывают условия протекания реакции и тепловой эффект реакции.
Условия протекания записывают над стрелкой, а тепловой эффект – в виде количества теплоты в левой части, если реакция эндотермическая, и в правой части, если экзотермическая.
Для примера запишем уравнение реакции водорода с кислородом:
Зигзаг обозначает искру – условие для начала реакции, а «+ Q» – то, что в результате реакции выделяется энергия.
В зависимости от конкретных задач условия протекания и тепловой эффект могут вообще не отмечать или отмечать конкретное числовое значение теплового эффекта.
Если среди продуктов реакции есть газ, около его формулы пишут стрелку вверх.
Например, когда мы капаем на рану перекись водорода, под действием ферментов крови она разлагается с выделением кислорода:
У меня есть дополнительная информация к этой части урока!
Кислород обладает обеззараживающим действием и способствует более быстрой свёртываемости крови!
Перекись водорода может разлагаться не только под воздействием ферментов крови, но и многих других веществ.
Разложение перекиси водорода в присутствии оксида марганца (IV) (Оксид марганца (IV) в химической реакции не участвует).
Если реакция идет в растворе и в результате выпадает осадок, то пишут стрелку вниз.
Садовые деревья весной обрабатывают от паразитов «бордосской жидкостью». Чтобы её приготовить, смешивают растворы извести и медного купороса.
При этом наблюдается выпадение хлопьев, которые состоят сразу из двух нерастворимых веществ: гидроксида меди и сульфата кальция.
Получившийся сульфат кальция, гипс, образует корку, которая будет дольше держаться на стволе дерева, и поэтому такая смесь дольше защищает его от вредителей.
Запишем уравнение этой реакции
Как правильно читать уравнение химической реакции?
В химии принято делать это примерно так: «один моль сульфата меди реагирует с одним молем гидроксида кальция с образованием одного моля гидроксида меди и одного моля сульфата кальция».
То есть коэффициент перед формулой вещества считают количеством вещества в молях, а не количеством молекул.
Ведь в реальной жизни мы наблюдаем реакцию не единичных молекул, а большого объема веществ.
При составлении уравнений химики опираются на два основных закона природы: закона сохранения массы и закона постоянства состава веществ.
Пройти тест и получить оценку можно после входа или регистрации
Разработка уроков химии в 8-м классе по теме «Уравнения химических реакций. Типы химических реакций»
Разделы: Химия
Урок № 1.Уравнения химических реакций. Реакции соединения
Цели
- Образовательные: рассмотреть сущность реакций соединения. Научить учащихся составлять уравнения реакций соединения.
- Развивающие: развить умения, опираясь на знание химии, формулировать несложные проблемы, гипотезы, обобщать; формировать навыки само- и взаимоконтроля.
- Воспитывающие: продолжить формирование научного мировоззрения учащихся, воспитывать культуру общения через работу в парах «ученик-ученик», «учитель-ученик»; воспитывать у учащихся наблюдательность, внимание, пытливость, инициативу.
Оборудование и реактивы: Мультимедийная установка, колбы с кислородом, ложечка для сжигания веществ, красный фосфор, сера, уголек, стакан с водой, индикатор лакмус, видеомагнитофон, видеокассета 8 класс (Собрание демонстрационных опытов для средней общеобразовательной школы. Современный гуманитарный университет, 2000).
1. Организационный момент. Организация учащихся на усвоение новых знаний, умений навыков.
2. Актуализация знаний.
Мы изучаем главу «Изменения, происходящие с веществами» и знаем, что изменения могут быть физическими и химическими.
- В чем отличие химического явления от физического?
- По каким признакам можно определить, что произошла химическая реакция?
- Какому закону, связанному с массой веществ, подчиняются все химические реакции?
- Дайте формулировку этого закона.
Вам известно, что все явления подразделяются на физические и химические. Химические явления, или химические реакции можно записать с помощью химических уравнений.
Сегодня перед нами стоит задача — изучить один из типов химических реакций, научиться данные реакции распознавать среди всех химических реакций, уметь применять закон сохранения массы веществ к этим реакциям.
3. Изучение нового материала.
Для того, чтобы познакомить вас с реакциями, я проведу ряд опытов (СЛАЙД 2).
Демонстрационный опыт 1. Горение красного фосфора в кислороде.
По каким признакам можно сказать, что произошла химическая реакция?
Подставьте в схему проведенной реакции
Фосфор + кислород ->оксид фосфора (V)
Вместо названий веществ их химические формулы P + O2 -> P2O5
Посмотрите на схему реакции. Не нарушает ли она закон сохранения массы веществ? Число атомов элементов до и после реакции неодинаково.
Чтобы этот закон соблюдался, необходимо составить уравнение химической реакции, расставив коэффициенты 4P + 5O2 -> 2P2O5
Демонстрационный опыт 2. Взаимодействие оксида фосфора (V) с водой.
В колбу с оксидом фосфора (V) наливаю воду. Что вы наблюдаете? Чтобы определить, образовалось ли новое вещество, добавлю в колбу индикатор лакмус. По какому признаку можно сказать, что произошла химическая реакция? (Раствор окрасился в красный цвет).
Схема реакции: Оксид фосфора (V) + вода -> фосфорная кислота
Демонстрационный опыт 3. Горение серы в кислороде.
Схема реакции: Сера + кислород -> оксид серы (IV)
Подставьте в эту схему формулы веществ: S + O2 = SO2
Необходимы здесь коэффициенты?
Демонстрационный опыт 4. Взаимодействие оксида серы (IV) с водой.
В колбу с оксидом серы (IV) наливаю воду. Что наблюдаете? Чтобы определить, образовалось ли новое вещество, добавлю в колбу индикатор лакмус. По окраске лакмуса определите среду раствора.
Схема этой реакции: Оксид серы(IV) + вода -> сернистая кислота
Подставьте в схему формулы веществ: SO2 + H2O = H2SO3
Необходимы здесь коэффициенты?
Видеокассета Демонстрация взаимодействия брома и алюминия.
Схема этой реакции: Алюминий + бром ->бромид алюминия
Подставьте в схему формулы веществ: Al + Br2 -> AlBr3
Расставьте коэффициенты: 2Al + 3Br2 = 2AlBr3
Обратите внимание, сколько веществ вступило в этих реакциях и сколько веществ образовалось?
СЛАЙД 4. Такой тип реакций относится к реакциям соединения.
Запись определения в тетрадь: Реакцией соединения называется реакция, в результате которой из двух или более простых или сложных веществ образуется одно сложное вещество.
Соединение простых веществ в одно сложное вещество: А + В = АВ
Соединение двух бинарных веществ в одно трехэлементное сложное вещество: АВ + СВ = АСВ2
4. Закрепление материала.
СЛАЙД 5. На экране написаны схемы химических реакций разного типа. Выберите реакции соединения, запишите их схемы в тетрадь и расставьте коэффициенты.
Класс работает самостоятельно, затем ученик зачитывает выписанные схемы, обосновывает свой выбор и расставляет коэффициенты.
5. Заключительная часть.
Подведение итогов, выставление оценок, домашнее задание. (Приложение 1)
Урок № 2. Реакции разложения
Цели
- Обучающие: рассмотреть сущность реакций разложения, научить учащихся писать уравнения реакций разложения.
- Развивающие: развивать умения формулировать несложные проблемы, обобщать, делать выводы.
- Воспитывающие: Продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах, а также наблюдательность, внимание, пытливость, инициативу.
Оборудование и реактивы: мультимедийная установка, лабораторный штатив с пробирками, свежеприготовленный гидроксид меди (II), спиртовка, видеомагнитофон, видеокассета 8 класс (Собрание демонстрационных опытов для средней общеобразовательной школы. Современный гуманитарный университет, 2000)
1. Организационный момент. Организация учащихся на усвоение новых знаний, умений и навыков
2 Актуализация знаний.
СЛАЙД 6. Проверка домашнего задания.
СЛАЙД 7. Самостоятельная работа в парах.
Проверка на экране.
3. Изучение нового материала.
С каким типом реакций мы познакомились на прошлом уроке? Отличаются ли реакции, с которыми вы сейчас работали, от реакций соединения? Сколько веществ было до реакции и сколько образовалось в результате этих реакций? Как вы думаете, как могут называться данные реакции? Тема урока сегодня — реакции разложения.
СЛАЙД 8. Демонстрационный опыт Разложение гидроксида меди (II) при нагревании.
В пробирке свежеприготовленный гидроксид меди(II). Нагреваю пробирку, что вы можете сказать о признаках химической реакции? Вещество черного цвета — оксид меди (II). Вторым продуктом реакции является вода. Мы видим, что в реакцию вступило одно соединение, а в результате реакции получилось два.
Схема этой реакции: гидроксид меди (II) -> оксид меди(II) + вода
Подставьте в эту схему формулы веществ: Cu(OH)2 -> CuO + H2O
Видеокассета Разложение воды под действием электрического тока.
Схема этой реакции: Вода -> водород + кислород
Подставьте в эту схему формулы веществ: H2O -> H2 + O2
Видеокассета Разложение карбоната кальция при нагревании
Схема этой реакции: карбонат кальция a оксид кальция + оксид углерода (IV)
Подставьте в схему формулы веществ: CaCO3 -> CaO + CO2
СЛАЙД 9. Попробуйте дать определение реакциям разложения.
Реакцией разложения называется такая реакция, в результате которой из одного вещества образуется несколько простых или сложных веществ.
Разложение сложного вещества на два (несколько) простых веществ: АВ = А + В
Разложение трехэлементного сложного вещества на два бинарных вещества: АСВ2 = АВ + ВС
4. Закрепление материала.
Вы изучили два типа химических реакций — реакции разложения и соединения. Продолжаем работать парами. СЛАЙД 10.
5. Заключительная часть. Подведение итогов, домашнее задание (Приложение 2).
Урок № 3. Реакции замещения
Цели
- Обучающая: рассмотреть новый тип реакций — реакции замещения; научить учащихся писать реакции замещения; формировать умение предсказывать продукты реакций замещения.
- Развивающая: развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку, совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к само- и взаимоконтролю.
- Воспитывающая: продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах, а также наблюдательность, внимание, пытливость, инициативу.
Оборудование и реактивы: мультимедийная установка, карточки с заданиями для самостоятельной работы «Реакции разложения, соединения», лабораторный штатив с пробирками, гранулы цинка, железный гвоздик, растворы соляной кислоты и сульфата меди(II).
1. Организационный момент. Организация учащихся на усвоение новых знаний, умений и навыков.
2. Актуализация знаний.
Фронтальный опрос (во время которого один ученик на доске выписывает уравнения реакций соединения, другой — уравнения реакций разложения из домашнего задания)
С реакциями каких типов вы познакомились на прошлых уроках? Дайте определение реакции соединения. Какая реакция называется реакцией разложения. Для чего в схемах химических реакций расставляют коэффициенты?
СЛАЙД 11. Проверка домашнего задания.
Самостоятельная работа (СЛАЙД 12).
3. Изучение нового материала.
Лабораторная работа (Приложение 3). Для того, чтобы познакомиться с новым типом реакций, проведем ряд опытов.
Схема данной реакции: цинк + соляная кислота -> хлорид цинка + водород
Подставьте в эту схему формулы веществ : Zn + HCl -> ZnCl2 + H2
Расставьте коэффициенты. Zn + 2HCl ->ZnCl2 + H2
Из уравнения реакции видно, какой газ выделился, запишите вывод.
Давайте проанализируем, что же произошло в результате реакции: взаимодействуют простое вещество цинк и сложное вещество — соляная кислота.
Атомы простого вещества заместили атомы элемента, стоящего в сложном на первом месте.
Схема данной реакции: железо + сульфат меди (II) -> сульфат железа (II) + медь
Подставьте в эту схему формулы веществ: Fe + CuSO4 ->FeSO4 + Cu
Снова взаимодействуют простое и сложное вещества. Запишите вывод.
Демонстрационный опыт Взаимодействие натрия с водой.
Схема данной реакции: Na + HOH ->
Попробуйте самостоятельно записать продукты реакции: Na + HOH -> NaOH + H2
Расставьте коэффициенты: 2Na + 2H2O -> 2NaOH + H2
Какие вещества и как взаимодействуют на этот раз?
СЛАЙД 14. Рассмотрим цветную схему на экране, которая отображает механизм реакции.
Простое вещество взаимодействует со сложным, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуются новые вещества — простое и сложное.
Как могут называться такие реакции?
Запись определения реакций замещения в тетрадь. А + ВС =АС + В
4. Закрепление материала.
Сегодня вы познакомились еще с одним типом реакций — реакциями замещения. Теперь для закрепления полученных знаний, выполните упражнения. СЛАЙД 15, СЛАЙД 16.
5. Заключительная часть
Подведение итогов, домашнее задание (Приложение 4).
Урок № 4. Реакции обмена
Цели
- Обучающие: объяснить сущность реакций обмена; научить учащихся писать уравнения реакций обмена.
- Развивающие: развить умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку, опираясь на знания химии; совершенствовать умения работать с лабораторным оборудованием и реактивами, оформлять результаты учебного эксперимента; формировать способности к адекватному само- и взаимоконтролю.
- Воспитывающие: продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах «Ученик — ученик», «учитель — ученик», воспитывать такие качества личности, как наблюдательность, пытливость, инициатива, стремление к самостоятельному поиску.
Оборудование и реактивы: мультимедийная установка, карточки с заданиями для самостоятельной работы, карточки со схемами реакций обмена, растворы хлорида бария, сульфата магния, сульфата железа (II), гидроксида натрия, соляной кислоты, фенолфталеина, лабораторный штатив с пробирками.
1. Организационный момент. Организация учащихся на усвоение новых знаний, умений и навыков.
2. Актуализация знаний
СЛАЙД 17, 18. Проверка домашнего задания: два ученика пишут на доске, затем с помощью экрана проверяем, в это время беседа со всем классом.
Фронтальная беседа
Самостоятельная работа. СЛАЙД 19.
Проверка самостоятельной работы: СЛАЙД 20 (1 вариант), СЛАЙД 21 (2 вариант)
Подводя итог самостоятельной работы, можно сказать, вам известны три типа химических реакций: реакции соединения, разложения, замещения. Перед нами стоит задача изучить еще один тип химических реакций.
3. Изучение нового материала.
Для того, чтобы познакомиться с новым типом реакций, проведем ряд опытов.
Лабораторная работа (инструкция по проведению работы на столах, повторение правил ТБ).
Результаты работы записываются в таблицу. (Приложение 5)
Схема реакции: Хлорид бария + сульфат магния -> хлорид магния + сульфат бария
Подставьте в эту схему формулы веществ: BaCl2 + MgSO4 -> MgCl2 + BaSO4
Как определить, какой из продуктов реакции выпал в осадок? Определите с помощью таблицы растворимости, что является в данной реакции осадком. Запишите вывод.
Проанализируем, что произошло в данной реакции. Какие вещества вступили в реакцию, что произошло? Взаимодействуют два сложных вещества, при этом они обмениваются своими составными частями.
Схема данной реакции: Сульфат железа (II) + гидроксид натрия ->
Подставьте в схему формулы: FeSO4 + NaOH ->
И попробуйте самостоятельно, глядя на предыдущее уравнение, записать продукты этой реакции. Снова взаимодействуют два сложных вещества и обмениваются составными частями
Расставьте коэффициенты: FeSO4 + 2NaOH -> Fe(OH)2 + Na2SO4
Какое вещество выпало в осадок? Запишите вывод.
Запишем схему реакции: NaOH + HCl ->
Попробуйте самостоятельно записать уравнение реакции. Взаимодействуют два сложных вещества и обмениваются составными частями.
NaOH + HCl -> NaCl + HOH
Зачем при проведении этого опыта мы использовали фенолфталеин? В результате реакции произошло изменение щелочной среды раствора на нейтральную. Увидеть это нам помог индикатор фенолфталеин.
СЛАЙД 23. Рассмотрим цветную схему на экране, которая отображает механизм реакции.
Взаимодействуют два сложных вещества, которые обмениваются своими составными частями.
Нетрудно догадаться, как называется данный тип реакций.
Запись определения реакций обмена в тетрадь.
В опыте № 3 мы рассмотрели реакцию обмена между кислотой и щелочью. Эту реакцию называют реакцией нейтрализации. Мы в дальнейшем познакомимся с ними поближе.
4. Закрепление материала.
Составление уравнений реакций обмена требует знание формул веществ, умение составлять формулы веществ, расставлять коэффициенты.
На карточках вам предложены схемы реакций обмена. Попробуйте написать уравнения реакций. Есть ли среди этих реакций реакции нейтрализации?
(Работа в парах, с последующей проверкой на экране.) СЛАЙД 24, 25
5. Заключительная часть
Подведение итогов, выставление оценок, домашнее задание (Приложение 6)
Урок № 5. Уравнения химических реакций. Типы химических реакций. Обобщение
Цели
- Обучающая: обобщение и систематизация знаний о типах химических реакций. Закрепление умений составлять уравнения химических реакций.
- Развивающая: формирование комплекса общеучебных познавательных умений — логически мыслить, анализировать, сравнивать, обобщать, делать выводы, аргументировать и отстаивать свою точку зрения.
- Воспитывающая: формирование коммуникативных и организационных умений.
Оборудование и реактивы: Карточки с заданиями, листы с таблицей для выполнения заданий, периодическая система химических элементов, таблица растворимости, медные стружки, гранулы цинка, стружки магния, железный гвоздик, нитрат серебра, хлорид бария, серная кислота, сульфат меди (II), гидроксид натрия, соляная кислота, нитрат свинца (II), иодид калия, сульфат натрия, сульфат железа (II), гидроксид калия, лабораторный штатив с пробирками.
1. Организационный момент. Класс делится на 5 групп по 5 человек. В группе должны быть как сильные, так и слабые ученики. Инструктаж по выполнению работы. Инструктаж по ТБ.
2. Групповая самостоятельная работа. (Приложение 7)
Выполнение и проверка каждого задания строго регламентированы временными рамками, за соблюдением которых следит учитель. Учащиеся выполняют задания в таблице на отдельных листах.
Действуя по заданной схеме, каждый ученик выполняет пять заданий и осуществляет проверка пяти аналогичных заданий.
На выполнение и проверку заданий отводится в общем 30 минут. По истечении этого времени учитель собирает таблицы с выполненными заданиями. На оставшиеся 10 минут выдает каждому учащемуся карточку с индивидуальным заданием.
3. Индивидуальная лабораторная работа. (Приложение 8)
Провести взаимодействия между выданными веществами, указать признаки реакций, определить их тип, назвать полученные вещества. Полученные результаты занести в таблицу.
4. Заключительная часть. Подведение итогов, выставление отметок за работу на уроке наиболее активным учащимся.
http://ladle.ru/education/himia/8class/himicheskaya-reakciya15
http://urok.1sept.ru/articles/623645