Ксантопротеиновая реакция на белок: признаки и формула уравнения
Для установления качественного состава многих продуктов питания используется ксантопротеиновая реакция на белок. Наличие ароматических аминокислот в соединении даст положительное изменение цвета исследуемого образца.
Что такое белок
Его еще называют протеином, являющимся строительным материалом для живого организма. Белки поддерживают объем мышц, восстанавливают травмированные и отмершие тканевые структуры различных органов, будь то волосы, кожные покровы или связки. При их участии производятся красные тельца крови, регулируется нормальная работа многих гормонов и клеток иммунной системы.
Это сложная молекула, представляющая собой полипептид с массой больше 6*10 3 дальтон. Белковую структуру образуют остатки аминокислотные в большом количестве, соединенные пептидной связью.
Структура протеинов
Отличительной чертой данных веществ по сравнению с низкомолекулярными пептидами является их развитое пространственное трехмерное строение, поддерживаемое влияниями с разной степенью притяжения. Белки обладают четырехуровневой структурой. Для каждого из них присущи свои характеристики.
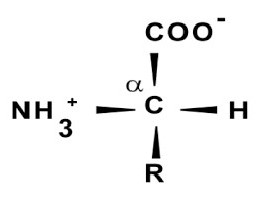
За основу первичной организации их молекул взята аминокислотная последовательность, строение которых распознает ксантопротеиновая реакция на белок. Такая структура представляет собой периодически повторяющуюся пептидную связь -HN-CH-CO-, а избирательной частью являются радикалы боковой цепочки в аминокарбоновых кислотах. Именно они определяют в дальнейшем свойства вещества в целом.
Первичную белковую структуру считают достаточно прочной, это обусловлено наличием сильных ковалентных взаимодействий в пептидных связях. Образование последующих уровней происходит в зависимости от признаков, установленных на начальном этапе.
Формирование вторичной структуры возможно благодаря скручиванию аминокислотной последовательности в спираль, в которой между витками устанавливаются водородные связи.
Третичный уровень организации молекулы образуется при наложении одной части спирали на другие фрагменты с возникновением между ними всевозможных связей, с водородным, дисульфидным, ковалентным или ионным соединением. В результате получаются ассоциации в виде глобул.
Пространственное расположение третичных структур с образованием химических связей между ними приводит к формированию конечного вида молекулы или четвертичному уровню.
Аминокислоты
Именно они обуславливают химические свойства белков. Насчитывают около 20 главных аминокислот, входящих в состав полипептидов в разной последовательности. Сюда также причисляют редкие аминокарбоновые кислоты в виде гидроксипролина и гидроксилизина, являющиеся производными основных пептидов.
Как признак ксантопротеиновой реакции распознавания белков, присутствие отдельных аминокислот дает изменение окраски реактивов, что позволяет предполагать о наличии специфических структур в их составе.
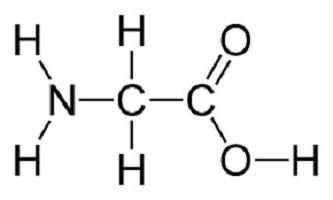
Как оказалось, все они представляют собой карбоновые кислоты, у которых произошло замещение атома водорода на аминогруппу.
Примером строения молекулы может служить структурная формула глицина (HNH− HCH− COOH) как простейшей аминокислоты.
В данном случае один из водородов CH2— углерода может быть заменен более длинным радикалом, включающим бензольное кольцо, амино-, сульфо-, карбоксигруппы.
Что означает ксантопротеиновая реакция
Для проведения качественного анализа протеинов используют различные методики. К ним относят реакции:
- биуретовую с появлением фиолетового окрашивания;
- нингидриновую с образованием сине-фиолетового раствора;
- формальдегидную с установлением красного окрашивания;
- Фоля с выпадением осадка серо-черного цвета.
При проведении каждого метода доказывается присутствие протеинов и наличие определенной функциональной группы в их молекуле.
Существует ксантопротеиновая реакция на белок. Ее называют еще пробой Мульдера. Относится она к цветным реакциям на протеины, в которых присутствуют ароматические и гетероциклические аминокислоты.
Особенностью такой пробы является процесс нитрования кислотой азотной циклических аминокислотных остатков, в частности присоединение нитрогруппы к бензольному кольцу.
Результатом такого процесса является образование нитросоединения, которое осаждается. Это основной признак ксантопротеиновой реакции.
Какие определяются аминокислоты
Не все аминокарбоновые кислоты можно выявить с помощью такой пробы. Основной признак ксантопротеиновой реакции распознавания белков — наличие бензольного кольца или гетероцикла в составе молекулы аминокислоты.
Из протеиновых аминокарбоновых кислот выделяют две ароматические, в которых имеется фенильная группа (у фенилаланина) и гидроксифенильный радикал (у тирозина).
С помощью ксантопротеиновой реакции определяют гетероциклическую аминокислоту триптофан, имеющую ароматическое индольное ядро. Наличие вышеуказанных соединений в белке дает характерное изменение окраски испытуемой среды.
Какие используют реактивы
Для проведения ксантопротеиновой реакции потребуется приготовить 1%-й раствор протеина яичного или растительного происхождения.
Обычно используют куриное яйцо, которое разбивают для дальнейшего отделения белка от желтка. Для получения раствора 1%-й протеин разводят в десятикратном количестве очищенной воды. После растворения белка полученную жидкость необходимо отфильтровать через несколько слоев марли. Такой раствор следует хранить в холодном месте.
Можно проводить реакцию с растительным белком. Для приготовления раствора используют муку пшеничную в количестве 0,04 кг. Добавляют 0,16 л очищенной воды. Ингредиенты смешивают в колбе, которую ставят на 24 часа в холодное место с температурой около +1°С. По истечении суток раствор взбалтывают, после чего проводят его фильтрацию сначала с помощью ваты, а затем − бумажного складчатого фильтра. Полученную жидкость держат в холодном месте. В таком растворе присутствует в основном альбуминовая фракция.
Для проведения ксантопротеиновой реакции в качестве основного реактива используют азотную кислоту концентрированную. Дополнительными реагентами является раствор 10%-го гидроксида натрия или аммиака, желатиновый раствор и неконцентрированный фенол.
Методика проведения
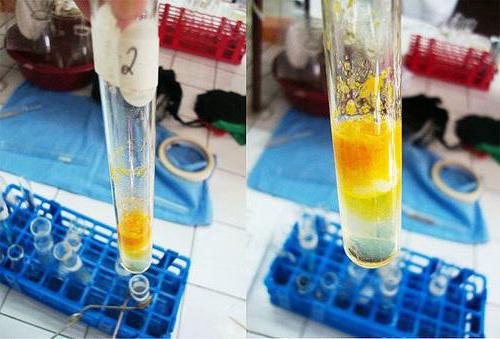
В чистую пробирку вносят 1%-й раствор белка яйца или муки в количестве 2 мл. К нему прибавляют около 9 капель кислоты азотной концентрированной, чтобы прекратилось выпадение хлопьев. Полученную смесь нагревают, в результате осадок желтеет и постепенно исчезает, а его цвет переходит в раствор.
Когда жидкость остынет, в пробирку по стеночке добавляют около 9 капель натрия гидроксида концентрированного, что является избытком для процесса. Реакция среды становится щелочной. Содержимое в пробирке приобретает оранжевую окраску.
Особенности проведения
Так как ксантопротеиновой называют качественную реакцию на белки под действием азотной кислоты, то пробу проводят под включенным вытяжным шкафом. Соблюдают все меры безопасности при работе с концентрированными едкими веществами.
В процессе нагревания может происходить выброс содержимого из пробирки, что следует учитывать при закреплении ее в держателе и выборе наклона.
Набирать концентрированную азотную кислоту и едкий натрий следует только с помощью стеклянной пипетки и груши резиновой, запрещается набирать ртом.
Сравнительная реакция с фенолом
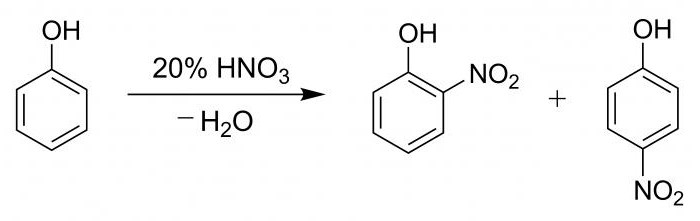
Для наглядности процесса и подтверждения наличия фенильной группы проводят подобную пробу с гидроксибензолом.
В пробирку вносят 2 мл фенола разведенного, затем постепенно, по стеночке, добавляют 2 мл кислоты азотной концентрированной. Раствор подвергают нагреванию, в результате чего он становится желтым. Данная реакция является качественной на присутствие бензольного кольца.
Процесс нитрования гидроксибензола азотной кислотой сопровождается образованием смеси из паранитрофенола и ортонитрофенола в процентном соотношении 15 к 35.
Сравнительная проба с желатином
Чтобы доказать, что ксантопротеиновая реакция на белок выявляет аминокислоты только с ароматическим строением, используют протеины, не имеющие фенольной группы.
В чистую пробирку вносят 1%-й желатиновый раствор в количестве 2 мл. К нему прибавляют около 9 капель кислоты азотной концентрированной. Полученную смесь нагревают. Раствор не окрашивается в желтый цвет, что доказывает отсутствие аминокислот с ароматической структурой. Иногда наблюдается незначительное пожелтение среды, связанное с наличием протеиновых примесей.
Химические уравнения
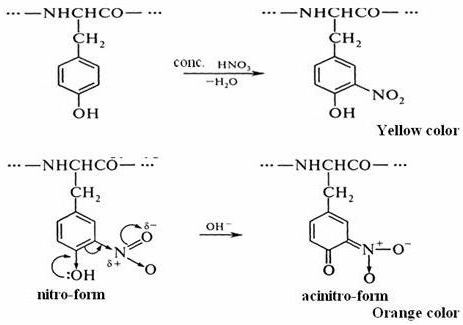
В две стадии проходит ксантопротеиновая реакция на белки. Формула первого этапа описывает процесс нитрования аминокислотной молекулы с помощью кислоты азотной концентрированной.
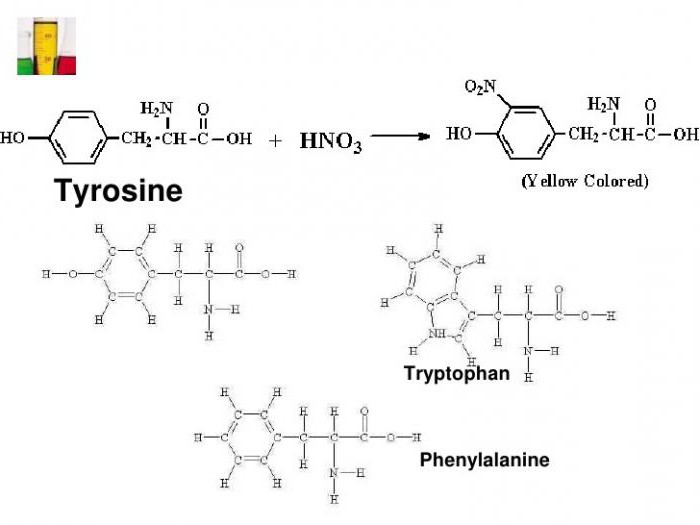
Примером может служить присоединение нитрогруппы к тирозину с образованием нитротирозина и динитротирозина. В первом случае к бензольному кольцу прикрепляется один NO2-радикал, а во втором соединении уже два атома водорода замещается на NO2. Химическая формула ксантопротеиновой реакции представлена взаимодействием тирозина с азотной кислотой с образованием молекулы нитротирозина.
Процесс нитрования сопровождается переходом бесцветной окраски в желтый тон. При проведении подобной реакции с белками, содержащими аминокислотные остатки триптофана или фенилаланина, цвет раствора также изменяется.
На втором этапе происходит взаимодействие продуктов нитрования молекулы тирозина, в частности нитротирозина, с аммония или натрия гидроксидом. В результате получается натриевая или аммонийная соль, у которых цвет желто-оранжевый. Такая реакция связана с возможностью молекулы нитротирозина переходить в хиноидную форму. В дальнейшем из нее образуется соль нитроновой кислоты, у которой имеется хиноновая система из двойных сопряженных связей.
Так заканчивается ксантопротеиновая реакция на белки. Уравнение второй стадии представлено выше.
Результаты
В процессе анализа жидкостей, содержащихся в трех пробирках, раствором сравнения служит разбавленный фенол. Вещества с бензольным кольцом дают качественную реакцию с кислотой азотной. В результате изменяется окраска раствора.
Как известно, желатин включает коллаген в гидролизованной форме. Данный белок не содержит аминокарбоновых кислот ароматического строения. При взаимодействии с кислотой не происходит изменения окраски среды.
В третьей пробирке наблюдается положительная ксантопротеиновая реакция на белки. Вывод можно сделать следующий: все протеины с ароматической структурой, будь то фенильная группа или индольное кольцо, дают изменение цвета раствора. Это связано с образованием нитросоединений с желтой окраской.
Проведение цветной реакции доказывает наличие разнообразной химической структуры в аминокислотах и белках. Пример с желатином показывает, что в его составе присутствуют аминокарбоновые кислоты, не имеющие фенильной группы или циклического строения.
С помощью ксантопротеиновой реакции можно объяснить пожелтение кожи при нанесении на нее сильной азотной кислоты. Такой же цвет приобретет молочная пенка при проведении с ней подобного анализа.
В медицинской лабораторной практике данную цветную пробу не используют для обнаружения белка в моче. Это связано с желтой окраской самой мочи.
Ксантопротеиновая реакция стала все чаще использоваться для количественного подсчета таких аминокислот, как триптофан и тирозин, в составе различных белков.
Ксантопротеиновая реакция
Большинство белков с крепкой азотной кислотой образуют соединение желтого цвета. Эта реакция характерна для циклических аминокислот, содержащих бензольное кольцо: фенилаланин, тирозин и триптофан.
Так, при действии крепкой азотной кислоты на тирозин происходит нитрирование бензольного кольца с образованием динитротирозина желтого цвета:
Н2С — СН — СООН Н2С — СН — СООН
При добавлении щелочи образуется натриевая соль динитротирозина, имеющая оранжевое окрашивание:
Н2С — СН — СООН Н2С — СН — СООН
Натриевая соль динитротирозина (оранжевое окрашивание)
Реактивы: концентрированная азотная кислота, 10% раствор едкого натрия.
Проведение испытания: в пробирку вносят 2 см 3 водного раствора белка, прибавляют каплями 1 см 3 концентрированной азотной кислоты и осторожно нагревают. Появляется осадок свернувшегося белка. Осадок и раствор окрашиваются в желтый цвет. Пробирку охлаждают и осторожно прибавляют избыток 10% раствора едкого натрия, при этом желтая окраска переходит в красно-оранжевую.
Реакция с нингидрином
Нингидрин – специфический реактив на α-аминокислоты. Реакция с нингидрином зависит от рН среды. При рН меньше 5 образуются аммиак, диоксид углерода и альдегид. По количеству выделившегося СО2 определяют содержание аминокислот.
При рН больше 5 реакция протекает с образованием соединения сине-фиолетового цвета, которое дают все аминокислоты, за исключением пролина и оксипролина, которые образуют с нингидрином продукты желтого цвета.
Реакция идет в две стадии. На первой стадии аминокислота реагирует с нингидрином с образованием восстановленной формы нингидрина (дикетооксигидриндена), аммиака, оксида углерода и альдегида.
ОН ׀ СН – СООН + ОН → Н +
α- аминокислота нингидрин нингидрин
На второй стадии образовавшиеся восстановленная форма нингидрина и аммиак реагируют со второй молекулой нингидрина с образованием пурпурного пигмента, окрашенного в интенсивный сине-фиолетовый цвет и имеющего следующее строение :
Реактивы: 0,1% раствор нингидрина.
Проведение испытания: в пробирку вносят 2 см 3 раствора белка, добавляют 0,5 см 3 0,1% раствора нингидрина и нагревают. Смесь окрашивается в фиолетовый или фиолетово-розовый цвет, через некоторое время смесь синеет.
Реакция Миллона
При помощи этой реакции определяют наличие в белке фенольной группы тирозина. Фенолы и их производные при нагревании со специально приготовленным раствором ртути в азотной кислоте (реактив Миллона) образуют ртутные соединения красного цвета.
Взаимодействие тирозина с реактивом Миллона идет по реакции: Н2С — СН — СООН Н2С — СН — СООН
ртутная соль динитротирозина
Реактивы: реактив Миллона.
Проведение испытания: в пробирку вносят 2 см 3 водного раствора белка, прибавляют 2-3 капли реактива Миллона и нагревают на водяной бане. Появляется осадок свернувшегося белка красного цвета.
При добавлении реактива Миллона в избытке наблюдается желтое окрашивание вследствие взаимодействия белка с азотной кислотой, дающей ксантопротеиновую реакцию, которая маскирует реакцию Миллона.
Реакция Адамкевича
Эта реакция является характерной на содержание в белке триптофана, который в кислой среде образует со многими альдегидами цветные продукты конденсации. При взаимодействии двух молекул триптофана с глиоксиловой кислотой в присутствии концентрированной серной кислоты образуется продукт красно-фиолетового цвета. Глиоксиловая кислота содержится как примесь в ледяной уксусной кислоте.
L- триптофан (α – амино – β – индолилпропионовая кислота) находятся почти во всех белках, но практически отсутствуют в склеропротеинах (коллагене и эластине). Эти белки богаты пролином.
Характеристика пищевой ценности мяса предусматривает определение триптофан-оксипролинового показателя. Чем больше триптофана содержится в мышцах, тем выше пищевая ценность мяса.
Реактивы: концентрированная серная кислота, ледяная уксусная кислота.
Проведение испытания: в пробирку наливают несколько капель неразбавленного белка и прибавляют около 2 см 3 ледяной уксусной кислоты и нагревают до растворения образующегося осадка. Охлаждают пробирку со смесью, а затем, наклонив её, осторожно по стенке приливают 1 см 3 концентрированной серной кислоты так, чтобы обе жидкости не смешались, и возвращают пробирку в вертикальное положение. На границе двух несмешивающихся жидкостей образуется красно-фиолетовое кольцо.
Реакция Фоля
В состав большинства белков входят содержащие серу аминокислоты – цистин, цистеин и метионин. Эти аминокислоты способны при нагревании в щелочной среде образовывать сульфид натрия, который с плюмбитом натрия дает черный или бурый осадок сульфида свинца.
Реактивы: 20% раствор едкого натрия, 10% раствор уксуснокислого свинца.
Проведения испытания: в пробирку наливают 2 см 3 раствора белка, приливают равный объем 20% раствора едкого натрия и несколько капель 10% раствора уксуснокислого свинца. Смесь нагревают до кипения. Образовавшийся осадок сначала буреет, а затем чернеет, что указывает на содержание в белке серы.
Задание: по результатам цветных реакций сделать вывод об аминокислотном составе исследуемых растворов белка. Результаты наблюдений занести в таблицу 3.1.
| Название реакции и исследуемый материал | Окраска продукта | Реагирующая группа |
| Биуретовая реакция: — яичный белок — белок мяса — белок рыбы |
Контрольные вопросы
1.Что такое белки? Какие виды связей присутствуют в белках?
2. Дайте характеристику протеинам и протеидам.
3. Какие четыре основные группы белков по растворимости Вы знаете?
4. В каком веществе растворимы альбумины?
5. Как классифицируют аминокислоты?
6. Какие свойства характерны для аминокислот?
7. Как определяется биологическая ценность белка?
8. Какой специфический реактив позволяет выявить наличие в белке α -аминокислот?
9. Какие аминокислоты являются протеиногенными?
10. Соединение каких химических веществ образуется при биуретовой реакции? Какой цвет имеет это соединение? Какие свободные аминокислоты дают биуретовую реакцию?
11. Для каких аминокислот характерна ксантопротеиновая реакция?
12. Какая окраска характерна для нингидриновой реакции? Какие соединения образуются в зависимости от рН среды?
13. При помощи какой реакции в белке открывают фенольную группу тирозина? Какая образуется окраска?
14. Какая реакция характерна для белка, содержащего триптофан? Ее окраска?
15. Какие аминокислоты, содержащие серу Вы знаете? С помощью какой реакции можно их определить? Какое соединение при этом образуется?
16. Какие белки мышечной ткани Вы знаете? В чем их особенности?
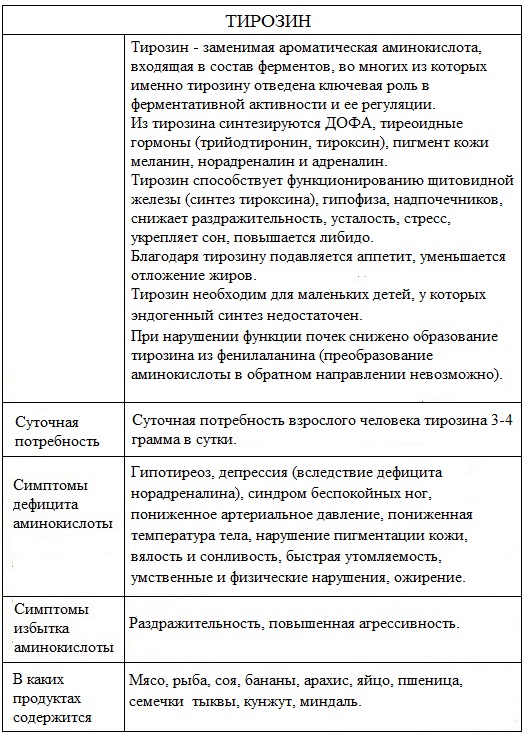
Тирозин с азотной кислотой уравнение
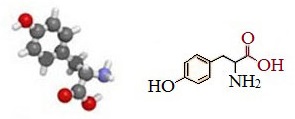
Тирозин — ароматическая α-аминокислота.
Тирозин относят к заменимым аминокислотам, так как в организме эта аминокислота образуется из другой (незаменимой) аминокислоты – фенилаланина.
По строению тирозин отличается от фенилаланина наличием фенольной гидроксильной группы в пара-положении бензольного кольца.
Тирозин — 2-амино-3- (п-гидроксифенил)пропановая кислота или α-амино-β- (п-гидроксифенил)пропионовая кислота.
Тирозин — (Тир, Tyr, Y) — аминокислота, входящая в состав ферментов, во многих из которых именно тирозину отведена ключевая роль в ферментативной активности и ее регуляции. Химическая формула C₉H₁₁NO₃.
Тирозин входит в состав почти всех белков, много его в пепсине (8,5%), инсулине крупного рогатого скота (12,5%).
Впервые тирозин выделен в 1849 г. Ф. Боппом из казеина.
Название тирозин происходит от греческого tyros, что означает сыр, поскольку именно в сыре было впервые обнаружено эту аминокислоту.
Суточная потребность взрослого человека тирозина 3-4 грамма сутки.
Физические свойства
Тирозин представляет собой бесцветные кристаллы, имеет температуру плавления 290-295 0 С (с разл.) Тирозин хорошо растворяется в воде, мало растворим в этаноле, не растворим в диэтиловом эфире.
Химические свойства
Тирозин – ароматическая аминокислота Химические свойства обусловлены наличием реакционноспособного фенольного гидроксила.
Вследствие наличия функциональных групп кислотного и основного характера тирозин образуют соли как с кислотами, так и со щелочами.
Биологическая роль
Тирозин необходим для нормальной работы надпочечников, щитовидной железы и гипофиза, создания красных и белых кровяных телец, синтеза меланина, пигмента кожи и волос.
Тирозин обладает мощными стимулирующими свойствами, помогает при хронической депрессии.
Тирозин регулирует давление крови и мочеиспускание, а также участвует в синтезе адреналина.
Адреналин — гормон коры надпочечников, где он образуется из тирозина.
Адреналин является ключевым гормоном стресса — «аварийным гормоном» и действует на обмен веществ и сердечнососудистую систему, повышает сердечную функцию. Сужает сосуды, повышая артериальное давление. Расширяет бронхи, увеличивая снабжение кислородом. Ускоряет расщепление гликогена до глюкозы, обеспечивая энергией мышечную ткань. Адреналин выполняет функции, как медиатора, так и гормона.
Тирозин является незаменимой аминокислотой для взрослых мужчин. Он необходим мужчинам, страдающим фенилкетонурией (генетическое заболевание, при котором превращение фенилаланина в тирозин затруднено). Тирозин также вызывает усиленное выделение гипофизом гормона роста. При заболеваниях почек синтез тирозина в организме может резко снизиться, поэтому в этом случае его необходимо принимать в виде добавки.
Природные источники
Мясо, рыба, соя, бананы, арахис, яйцо, пшеница, семечки тыквы, кунжут, миндаль.
При нехватке этой аминокислоты у человека может наблюдаться пониженное артериальное давление и температура тела (холодные руки, ноги), неконтролируемый набор массы тела, синдром беспокойных ног.
Недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии.
При низком содержании тирозина в организме наблюдается вялость и сонливость, быстрая утомляемость. У людей, страдающих хронической нехваткой тирозина, могут появиться тяжелые умственные и физические нарушения.
Симптомами недостаточности тирозина являются угнетение функции щитовидной железы, ощущение тяжести в икроножных мышцах.
При бесконтрольном потреблении тирозина у человека могут возникнуть проблемы с желудком, раздражительность, повышенная агрессивность.
Людям, страдающим некоторыми заболеваниями, лучше ограничить прием тирозина. К таким болезням относятся меланома — злокачественная опухоль, развивающаяся на коже, сетчатке глаз или слизистых оболочках, агрессивная опухоль мозга, а также мигрень.
Тирозин не рекомендуется принимать онкологическим больным, а также людям, страдающим шизофренией, гипертоникам, беременным женщинам.
Наследственные нарушения обмена тирозина
Тирозин является исходным продуктом для образования красящего вещества кожи и волос − меланина. Если превращение тирозина в меланин уменьшено из-за наследственной недостаточности фермента возникает альбинизм.
Альбинизм — отсутствие пигментации кожи, сетчатки глаз и волос. При альбинизме часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких людей под открытым солнцем приводит к раку кожи.
Области применения
Тирозин нормализует пониженное артериальное давление, оказывает психостимулирующее, противоаллергическое и антидепрессантное действие.
Тирозин подавляет аппетит, снимает зависимость, способствует минимизации жировых отложений, улучшает интеллектуальные функции.
Применяется для повышения внимательности и улучшения познавательной деятельности.
Тирозин необходим для снятия стресса, возникающего как в жизненных ситуациях, так и в результате тренировок.
Тирозин применяется при мигрени, болезни Паркинсона, синдроме хронической усталости, гипотиреозе, ожирении.
Тирозин применяется при синдроме профессионального выгорания, волнения и умственного утомления.
Для получения максимального антистрессового эффекта тирозин рекомендуется принимать в сочетании со зверобоем, травяным сбором, которое, как считается, снимает депрессию легкой степени.
В особенности тирозин необходим людям, которые подвергают себя длительным физическим тренировкам, а также сокращения периода восстановления сил.
Тирозин эффективен в лечении кокаиновой зависимости, синдрома отмены кофеина и других лекарственных зависимостей, алкоголизме, полезен для облегчения предменструального синдрома.
Препарат L-Тирозин
L-Тирозина рекомендуется принимать для нормализации работы щитовидной железы, для снятия стресса, головных болей, нервных расстройств.
Спортивное питание с L-тирозином.
L-тирозин помогает атлетам избежать перетренированности, благодаря его способности устранять утомление и увеличивать выносливость. Тирозин может улучшать ментальную концентрацию, технику выполнения упражнений, самочувствие и настроение.
Во время аэробных тренировок L-тирозин помогает сохранить мышечную ткань от разрушающего воздействия катаболических процессов. Таким образом, аминокислота L-тирозин может использоваться как компонент спортивного питания, для сжигания жира и сохранения мышц.
Обычному человеку со средней физической активностью не требуется дополнительного приема аминокислот, достаточное количество обычно получается с пищей. Добавочное количество аминокисот необходимо спортсменам при интенсивных тренировках и соревнованиях.
http://sdamzavas.net/3-22661.html
http://himija-online.ru/organicheskaya-ximiya/aminokisloty/tirozin.html