Транспорт электролитов. Электрохимический потенциал. Ионное равновесие на границе мембрана-раствор. Профили потенциала и концентрации ионов в двойном электрическом слое
Движущая сила диффузии через мембрану в случае незаряженных частиц – разность химических потенциалов µ между областями, разделенными полупроницаемой мембраной (ПМ). Напомню, что µ=µ0+RTlnC. Если через мембрану движутся заряженные частицы – например, ионы, — то это движение зависит не только от разности химических потенциалов, но и от разности электрических потенциалов. В этом случае пользуются электрохимическим потенциалом µ с чертой, которую не знаю как пставить. µ=µ0+RTlnC+zFφ. Собственно, движущей силой для ионов является грдиент этого потенциала, который по определению является производной потенциала по напавлению dµ/dx.
Рассмотрим, что происходит, когда ион проникает в мембрану. Диэлектрическая постоянная εлипидов=2-3, а εводы=81. Следовательно, энергия иона с радиусом r — E=e 2 /2rε – повышается в липидном слое! Следовательно, коэффициэнт распределения иона между водой и мембраной очень мал (напомню, что коэффициэнт распределения γ=Слип/Cводы, это отношение концентраций иона ооооочень близке к границе с одной и с другой стороны). Он равен 10 -20 -10 -30 . Это значит, что в воде ооооооооооооочень много, а в мембрану проникает оооооооооочень мало.
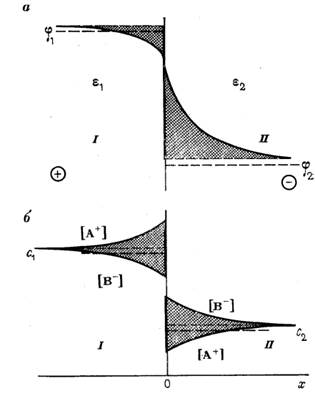
Рассмотрим распределение электролита А + В — между липидной (2) и водной (1) фазами. Пусть липофильность В — больше, чем у А + . Поэтому вблизи границы в липидной фазе будет побольше анионов, следовательно, липидная фаза около границы будет иметь отрицательный заряд! Однако вдали от границы концентрации катионов и аноинов будут одинаковыми (потому что если ты уже в глубине липидной фазы, то в гробу все видали твою липофобность, тебе уже деваться некуда), так что соблюдается условие электронейтральности объемов(!) фаз (но не самой мембраны): CA=CB. В целом, концентрация обоих ионов ниже в липидной фазе, так как в ней у ионов горааздо выше энергия, им не выгодно (из-за разности в диэлектрических проницаемостях).
На рисунке: профили распределения потенциала и концентраций ионов А + и В — на границе раздела фаз I и II. Фаза I – водный раствор, а – распределение φ, б – распределение С. С1 и С2 – концентрации в объемах фаз I и II
Кому не понятно, объясняю, че тут нарисовано. б – это концентрации. Мы видим, что вблизи границы А больше, чем В в водной фазе, а В больше, чем А в липидной. Но при этом и того, и другого в водной больше. По мере удаления от границы концентрации выравниваются до соблюдения электронейтральности в объемах фаз. А вблизи границ электронейтральности нет.
Пусть у нас установилось равновесие! Тогда электрохимические потенциалы фаз равны: µ0А (1) +RTlnCA (1) +Fφ (1) = µ0А (2) +RTlnCA (2) +Fφ (2) . Ключевой момент в том, что СОВСЕМ вблизи границы φ (1) = φ (2 ) (видно из профиля, да и логично, совсем на границе потенциалы фаз равны). Следовательно, µ0А (1) +RTlnCA (1) = µ0А (2) +RTlnCA (2) . Вспоминаем, что γ=Слип/Cводы, и пишем: ln γA=Δµ0A/RT,(Δµ0A= µ0А (1) — µ0А (2) ), аналогично для В.
Отношение концентраций электролита в фазах зависит от γA и от γB. Величина разности потенциалов Δφ=φ1-φ2 между фзами зависит от разности электрохимических потенциалов обоих ионов. Опять же, не в состоянии понять, почему: Δφ=φ1-φ2=1/2F*(Δµ0B-µ0A)=2F/RT*( ln γA — ln γB). Вывод: межфазная разность потенциалов возникает, только если коэффициенты распретеделения катионов и анионов различны (то есть разная липофильность, в данном случае).
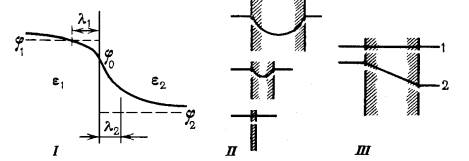
Характер падения потенциала вблизи границы зависит от распределения ионов в двойной электрическом слое (двойной слой возникает у заряженных мембран. 1 слой – на самой мембране, т.к. она заряжена, второй – от электролита). Эмперический факт: потенциал падает при отдалении от границы экспоненциально: φ(х)=φ0exp(χ|x|). χ – константа, зависящая от концентрации ионов в данной фазе и диэлектрической проницаемости. Потенциал падает в е раз на расстоянии x=1/ χ от границы. Величина λ=1/ χ – длина экранирования. Она падает при увеличении концентрации электролита в данной фазе (иными словами, при увеличении концентрации электролита в данной фазе потенциал падает быстрее при удалении от границы). Поэтому в разбавленных растворах толщина двойного диффузинного слоя – сотни ангстрем, а в концентрированных – единицы. Еще поэтому в липидном слое, где концентрация ниже, длина экранирования больше. Намного. Поэтому, если мембрана тонкая (ее толщина заметно меньше длины экранирования), то скачок потенциала внутри мембраны почти отсутсвует. Иными словами, в отсутсвии внешнего поля, потенциал тонкой мембраны постоянен по всей толщине! Поэтому значения потенциала в тонкой мембране не отличаются от уровня потенциала окружающих растворов на любом удалении от мембраны (не понял мысль. ). Именно так и происходит в незаряженных бислойных липидных мембранах толщиной 70-100 ангстрем. Если приложить внешнее поле, то внутри мембраны потенциал будет меняться линейно, то есть градиент приложенного потенциала в мембране постоянен: dφ/dx=const.Однако, если поверхность мембраны заряжена, то около поверхности образуется двойной электрический слой. Противоионы электролита с одной стороны будут удерживаться мембраной электростатически, а сдругой – тепловое движение хочет их вернуть равномерно в лбъем электролита. Короче, потенциал на поверхности такой мембраны сложным образом зависит от плотности поверхностного заряда, равновесной концентрации электролита в растворе и температуры.
На рисунке профили распределения потенциала на границе раздела фаз – I. В мембранах разной толщины – II. В тонкой мембране в отсутсвии внешнего поля – III.1, и в присутсвии (т.е. при наложении разности электрических потенциалов) – III.2. φ1 и φ2 –электрические потенциалы в объеме фаз, φ0 – на границе раздела фаз. Остальное в тексте.
Теперь немного про Доннановское равновесие.
Представим себе корыто, разделенное на две части – 1 и 2 – полупроницаемой мембраной (ПМ), через которую проходят и катионы, и анионы нашего электролита A + B — , но не проходят фиксированные заряды Q (скажем, аминокослота какая-нить), находящиеся во второй части корыта. Направим ось x слева направо.
Напишем, чем равен электрохимический потенциал 1 и 2. µа1= µа 0 +RTlnCа1+zFφ1, аналогично для 2.(Еще отныне забьем на z, так как будем считать, что у нас все одновалентное). И аналогично для аниона В.
Поскольку установилось равновесие, то Δµ= µ1 — µ2=0=>RT ln(C1/C2)+F(φ1 – φ2)=0 => φ1 – φ2=RT/F* ln(Ca2/Ca1)=- RT/F* ln(Cb2/Cb1) — уравнение Нернста. Вах, равновесный потенциал определяется соотношением концентраций электролитов в обеих фазах.
Пусть во второй фазе есть фиксированные заряды – Q. Его влияение приведет к тому, что Δφ уже не равно нулю, капитан.=) Из условия электронейтральности первой фазы следует:
Са1=Сb1=С, а для второй фазы Са2+Q=Cb2. Значит, Са2 2 =C 2 , Са2> Са1. Значит, содержание Q во второй фазе компенсируется повышенном содержанием в ней анионов В и пониженном – катионов А. В этом случае возникает доннановская разность потенциалов: ΔφD=φ1 – φ2=RTln(Са1/ Са2)= RT/F*ln(C/ Са2)>0, где Са2
| | | следующая лекция ==> |
| Химия элементов VIIA группы | | |
Дата добавления: 2016-04-11 ; просмотров: 3025 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Лекция 5, 6. Биофизика транспортных процессов
Лекция 5, 6. Биофизика транспортных процессов
Перейдем теперь к рассмотрению некоторых направлений клеточной биофизики и начнем с биофизики транспортных процессов.
Прежде всего, определим некоторые понятия – под транспортом на клеточном ровне понимаются прежде процессы переноса нейтральных веществ и ионов через биологические мембраны, и именно эти процессы изучаются в первую очередь в биофизике транспортных процессов. Надо отметить, что транспорт на клеточном уровне этими процессами не исчерпывается. Так существует латеральный транспорт – т. е. транспорт веществ ВДОЛЬ мембраны. Можно говорить также о транспорте веществ внутри клетки, который не связан с мембранными структурами, а осуществляется, например, за счет взаимодействия транспортируемых молекул с белками цитоскелета или водных потоков внутри клетки.
Однако именно трансмембранный транспорт, т. е. транспорт ЧЕРЕЗ биологические мембраны играет одну из ключевых ролей. Поему так? Чтобы понять это, необходимо вспомнить роль биологических мембран в существовании живых систем.
Как вы, наверно, знаете мембраны представляют собой клеточные структуры состоящие из бислоя (если нужно – напомнить структуру бислоя, РИС) и взаимодействующих с ним белков. У прокариот основной мембранной структурой является клеточная мембрана, выполняющая широкий спектр функций. У эукариот имеется широкий спектр мембранных структур – плазматическая мембрана, ядерная мембрана, сопрягающие мембраны – у митохондриальная и тилакоидная, и другие. Наиболее общей функцией биомембран является барьерная – т. к. за счет центрального гидрофобного участка в бислое, они обладают очень низкой проницаемостью для полярных, водорастворимых соединений. Именно благодаря этой функции мембраны и стали играть столь значительную роль в функционировании живых систем – без них само существование живых систем как отдельных объектов стало бы невозможным.
Однако, как мы уже говорили, живые системы – это открытые системы, т. е. системы, которые не могут существовать без обмена с внешней средой веществом и энергией. Отсюда существование биомембран, являющееся само по себе необходимым условиям для существования живых организмов в том виде в каком они есть, с необходимостью требует существования транспортных процессов через эти мембраны и обуславливает большую биологическую значимость этих процессов.
Рассмотрим процессы транспорта через биомембраны подробнее.
Простая диффузия представляет собой движение молекул незаряженного вещества по градиенту концентрации, т. е. от участков с более высоким содержанием данного вещества к участкам с более низким содержанием его. Такой процесс является пассивным, т. е. его непосредственное протекание не требует затрат энергии. Его существование было изначально показано эмпирически, однако этот закон может быть выведен, например, из более общего второго принципа термодинамики (равновесие – как отсутствие градиентов, если нужно объяснить). Впрочем, к явлению диффузии легко прийти и на основе молекулярной картины строения вещества и броуновского движения, которое, в общем-то, тоже вытекает из этой картины. Так, если у нас имеется два отсека, заполненных, например, разной концентрацией газа, то если мы откроем перегородку между этими отсеками, то получим, что количество молекул, движущихся из 1 в 2, будет пропорционально концентрации газа в 1, а из 2 в 1 – концентрации газа в 2 (РИС). Т. е. можно записать, что 




Отметим, что D – коэффициент диффузии, размерность которого обычно см2*с-1, j – поток вещества, с размерностью М*см-2*с-1. D – можно найти, учитывая, что 
В том случае, когда речь идет о перемещении вещества через тонкий барьер, например, через биомембрану, толщиной h, можно принять внутри этого барьера связь между С и х имеет линейный характер, т. е. dC/dx = const. Справедливость этого легко доказать, проанализировав зависимость ΔС от x, на участке от 0 до h:

 | Дорожное хозяйство России строительство и содержание дорог — это очень важно |
| |
 Транспорт
Транспорт
Лекция по химии на тему «Электродные потенциалы и электрохимические процессы»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
ПОНЯТИЕ ОБ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛАХ и
В основе всех электрохимических процессов лежит теория возникновения скачка потенциалов на границе металл — электролит, предложенная Нернстом. Основные положения этой теории заключаются в следующем:
1. Металлы имеют кристаллическое строение . В узлах решеток расположены катионы и атомы, а в межузловом пространстве электроны, называемые электронным газом . Между катионами и атомами происходит непрерывный обмен электронами.
Катионы образуются из атомов в процессе их обратимого окисления:
Оторвавшиеся электроны переходят в межузловое пространство и участвуют в образовании металлической связи.
2. Абсолютно нерастворимых веществ не существует . И если металлическую пластинку погрузить в полярный растворитель, то она начнет поверхностно растворяться. Процесс частичного растворения металла заключается в следующем. Полярные молекулы воды за счет ион – дипольного взаимодействия притягиваются к поверхностным ионам металла, вырывают их из узлов кристаллической решетки и катионы в гидратированном состоянии переходят в водную среду. При этом пластинка заряжается отрицательно за счет избыточных электронов. Отрицательно заряженная пластинка притягивает катионы перешедшие в воду и не дает им свободно распространиться по всему объему. Ионы металла плотно прилегающие к его поверхности образуют адсорбционный слой , а ионы металла, находящиеся в объеме воды, составляют диффузный слой .
В результате на границе металл – вода возникает двойной электрический слой ДЭС , вследствие, которого между металлом и водой создается разность потенциалов, называемая электродным потенциалом металла .
По мере выхода ионов металла из пластины в воду заряд ДЭС увеличивается и тогда начинается обратный процесс возврат ионов металла из раствора на пластину. В результате, между металлом и водой устанавливается подвижное химическое равновесие, которое можно изобразить уравнением:
где Me ( H 2 O ) m n + — гидратированные ионы металла, n – заряд ионов металла.
Потенциал, устанавливающийся в состоянии динамического равновесия, называется равновесным электродным потенциалом данного металла Е . Определить можно только относительные значения равновесного потенциала. В качестве стандарта взят водородный электрод, электродный потенциал которого условно принят за нуль. Стандартным электродным потенциалом Е о называется разность потенциалов, которая возникает между нормальным водородным электродом и электродом данного металла, погруженного в раствор его соли с концентрацией ионов металла 1моль/кг. Водородный электрод представляет собой платиновую пластину, погруженную в раствор H 2 SO 4 , с концентрацией ионов Н 1моль/кг.
Электродный потенциал зависит от следующих факторов:
1. Природа металла : чем меньше энергия ионизации металла, тем более отрицательное значение принимает электродный потенциала металла и тем более металл электрохимически активен.
2. Активность металла : Она определяется положением металла в ряду стандартных электродных потенциалов (ряд напряжений). Чем левее расположен металл в этом ряду, тем выше его восстановительная активность и ниже окислительная способность его катиона в растворе и наоборот.
В связи со значением электродных потенциалов металлы делятся на три группы:
1 Активные от Li до Zn
2. Средней активности от Fe до H
3. Неактивные правее H .
Все металлы (активные, средней активности и неактивные) в воде, растворах кислот заряжаются отрицательно, а раствор положительно.
Если же металл погрузить в раствор собственной соли, то его заряд будет зависеть от соотношения скоростей перехода ионов в раствор и обратно. У активных металлов выше скорость перехода катионов металла из узлов кристаллической решетки в раствор; поэтому они заряжается отрицательно, а раствор положительно. У неактивных металлов выше скорость возврата катионов из раствора в вакансии кристаллической решетки, поэтому они заряжаются положительно, а раствор отрицательно.
Способность металла отдавать ионы в раствор характеризуется электролитической упругостью растворения (ЭУР) , способность принимать их из раствора ионным осмосом . У активных металлов выше ЭУР, у неактивных металлов — ионный осмос. Следовательно, активные металлы в растворах собственных солей при стандартных условиях заряжаются отрицательно, а неактивные положительно. Стандартными условиями являются давление 101,3 КПа, температура 298К и концентрация катионов металла в растворе 1моль/кг растворителя.
3. Концентрация ионов металла в растворе : С повышением концентрации катионов металла уменьшается переход ионов металла в раствор и увеличивается их переход из раствора на металл, что приводит к смещению электродного потенциала металла в сторону положительных значений . Зависимость величины электродного потенциала от концентрации его катионов в растворе выражается уравнением Нернста:
Ес = Ео + 0,059ℓ g С m / n , где
Ес — потенциал металла при концентрации его катионов в растворе равной С m
Ео – стандартный электродный потенциал металла
http://pandia.ru/text/78/219/15048.php
http://infourok.ru/lekciya-po-himii-na-temu-elektrodnie-potenciali-i-elektrohimicheskie-processi-2006504.html

 Транспорт
Транспорт