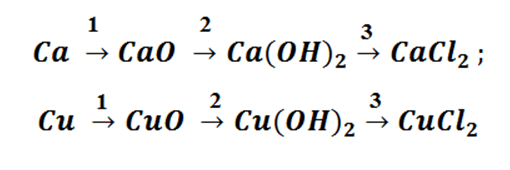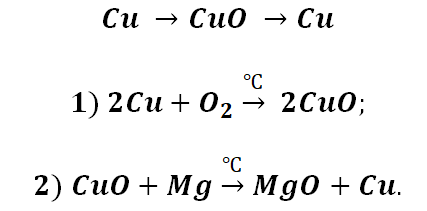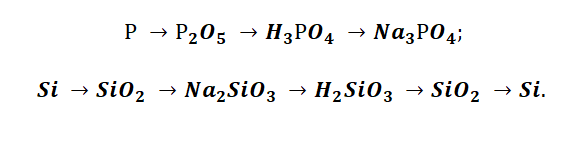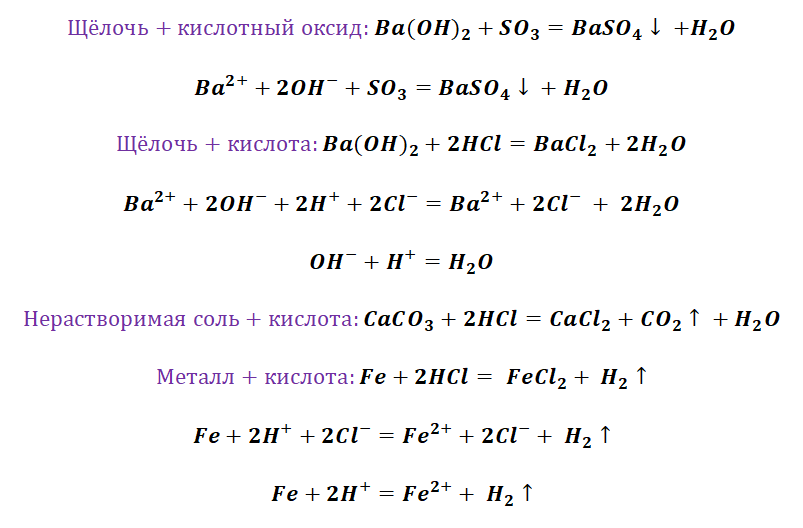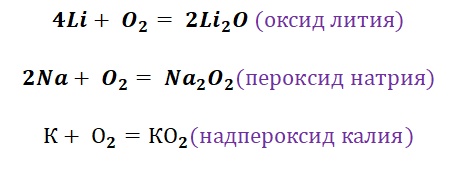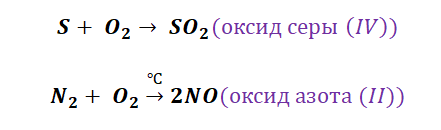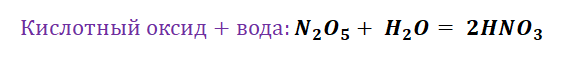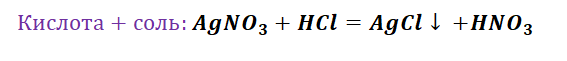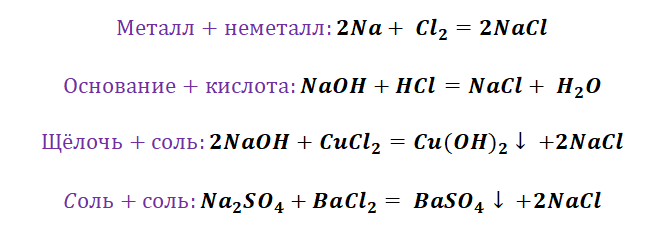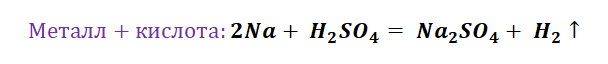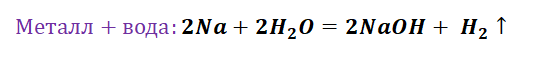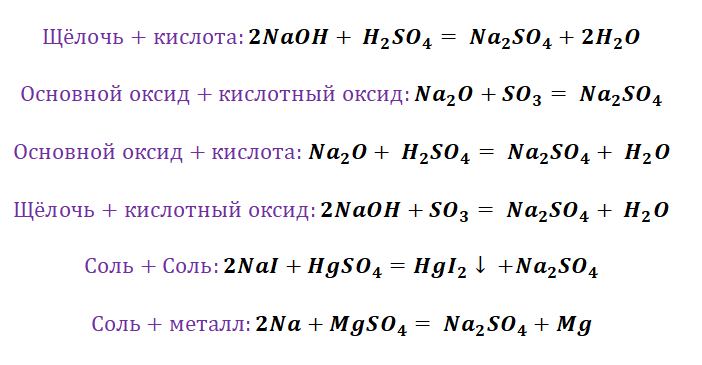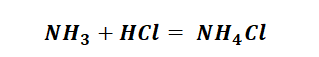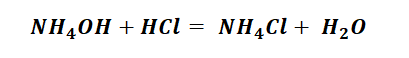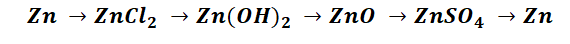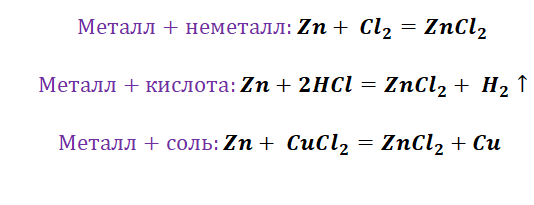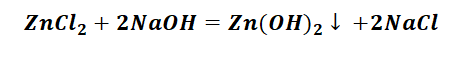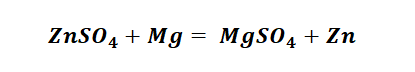Химия
План урока:
Почему связь между классами веществ считается генетической
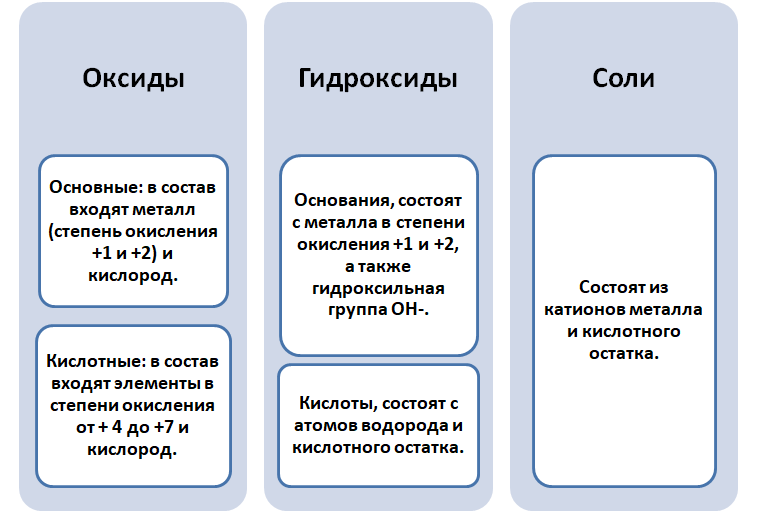
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
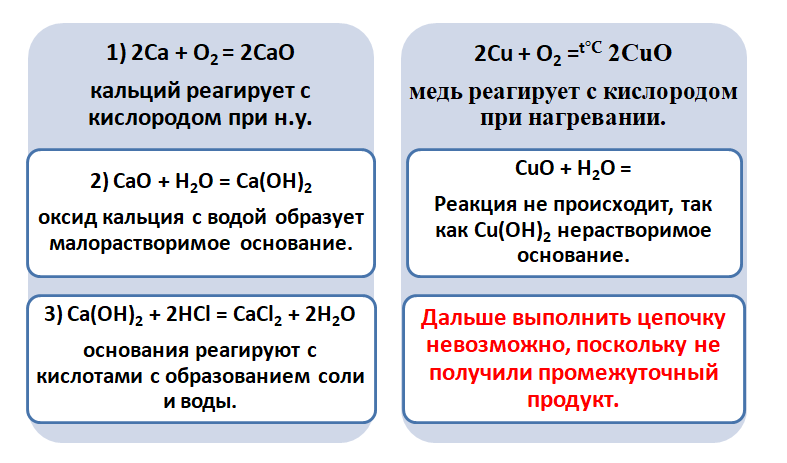
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
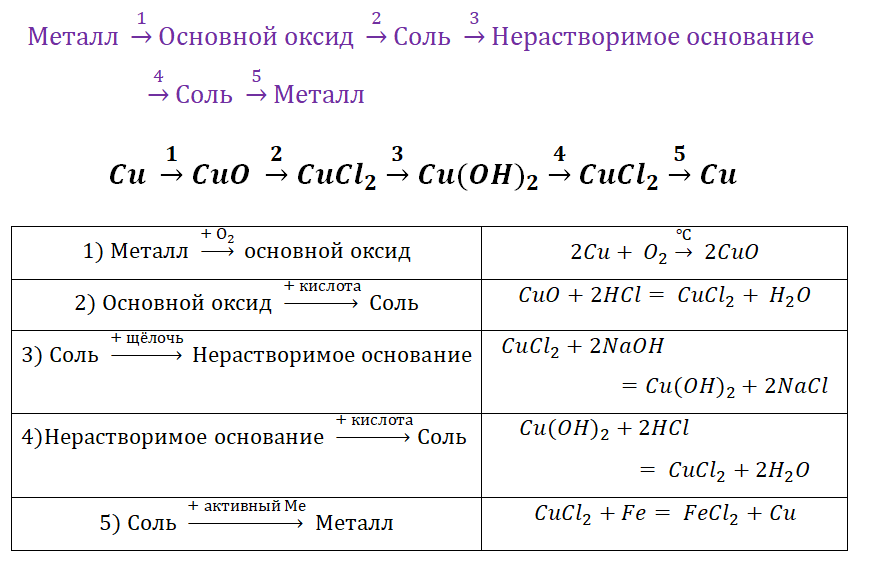
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
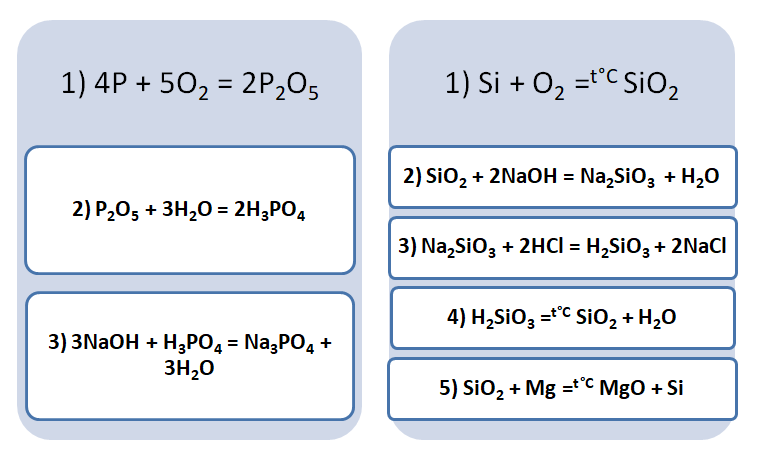
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
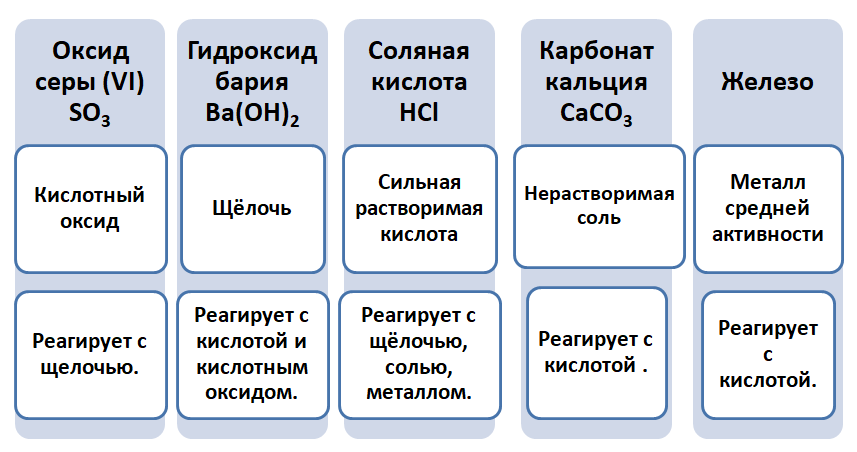
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
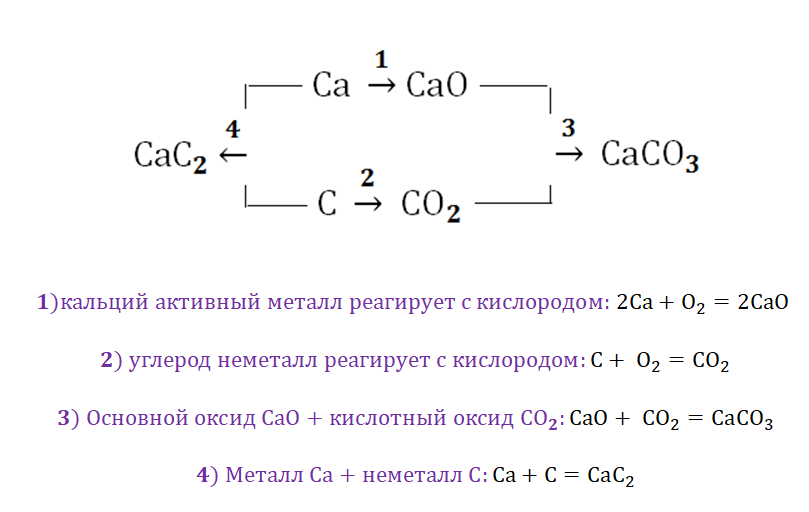
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Алгоритм решения «цепочек превращений» веществ. Инструкция для учащихся 8 класса
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
2 шаг. Пронумеруйте количество реакций для удобства решения
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2 С a + O 2 2Ca +2 O -2
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 925 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 14 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 576 828 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
§ 43. Генетическая связь между классами веществ
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 16.05.2020
- 206
- 3
- 14.04.2020
- 306
- 6
- 28.03.2020
- 863
- 5
- 14.03.2020
- 376
- 7
- 11.02.2020
- 1145
- 1
- 05.02.2020
- 1542
- 100
- 16.01.2020
- 1313
- 15
- 13.01.2020
- 362
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 17.05.2020 31642
- DOCX 19.5 кбайт
- 218 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Светлова Елена Александровна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 1 месяц
- Подписчики: 3
- Всего просмотров: 65700
- Всего материалов: 42
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
В Ленобласти школьники 5-11-х классов вернутся к очному обучению с 21 февраля
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
урок цепочки превращений 8 класс
презентация к уроку по химии (8 класс)
первый урок после изучения химических свойств оксидов
Скачать:
| Вложение | Размер |
|---|---|
| первый урок по теме, после изучения химических свойств оксидов | 117.04 КБ |
Предварительный просмотр:
Подписи к слайдам:
Тема урока : Цепочки превращений Это одна из сложных тем в химии, хочется, чтобы вы поняли ПРИНЦИП их выполнения. Когда мы составляем уравнения реакции, нам даны исходные вещества. Мы должны ответить на вопрос: что получится при этом взаимодействии? Выполняя цепочки, мы отвечаем на вопрос: как получить требуемый продукт? Надо знать св-ва в-в ! Стр. 167,упр . 1 ( б) Na 2 O → NaOH → Na 3 PO 4 В этой цепочке три вещества, две стрелки ( → ).Сколько стрелок, столько уравнений надо составить. Самое главное- думать надо не математически( сколько элементов, атомов надо добавить- отнять-заменить), а химически( как перейти от одного в-ва (исходного, стоит перед стрелкой) к другому (продукту, стоит после стрелки). Думаю, многим поможет наша схема Основные Кислотные Н 2 О Основания Кислоты Со ли 1)Первый переход(превращение): Na 2 O → NaOH Анализ данных : имеем основный оксид Na 2 O , надо получить основание( щёлочь ) NaOH Если думать,как математик, то надо добавить водород(Н не хватает), но это не так! Основным оксидам соответствуют основания( гидроксиды ), значит, добавляем Н 2 О, реакция соединения. 2)Второй переход(превращение) NaOH →Na 3 PO 4 Анализ данных : имеем основание( щёлочь ) NaOH , надо получить со ль Na 3 PO 4 . Чтобы из черного (основание) получить черно — красное (соль), надо к черному добавить красное. Есть 2 способа это сделать. Первый- общий, и вы его уже знаете, добавить кислоту (это реакция нейтрализации,обмен ), получится соль и вода. Второй- добавить кислотный оксид, также получится соль и вода –реакция обмена. Выполняя это задание, главное- понять, какое вещество взять для перехода! 1 2 2
Основные НемеО НемеО Кислоты Основания Со ли НО Кроме SiO 2 Кислотные H 2 O 10 3 2 2 1 1 Основные H 2 O
Упр. 1 (б) Na 2 O → NaOH → Na 3 PO 4 Na 2 O + H 2 O = 2 NaOH NaOH → Na 3 PO 4 (соль фосфат натрия, от фосфорной кислоты) 3 NaOH + Н 3 PO 4 = Na 3 PO 4 + 3 H 2 O Или 6 NaOH + P 2 O 5 = 2 Na 3 PO 4 + 3 H 2 O (фосфорной кислоте соответствует кислотный оксид P 2 O 5 ) Посмотрите видео о том же самом https://youtu.be/7pC3xfLBKjA https://youtu.be/DF-7VuIz8i4 Кто хочет учиться на «5» и «4», составьте для 2-го перехода сокращенные ионные уравнения реакций. Не забудьте, что оксиды – неэлектролиты !
Стр. 172, упр 3(б) Кто хочет учиться на «5» и «4», составьте для 2-го перехода сокращенные ионные уравнения реакций. Не забудьте, что оксиды – неэлектролиты ! Zn → ZnO → ZnSO 4 2 Zn + O 2 = 2 ZnO ZnO + H 2 SO 4 = ZnSO 4 + H 2 O Или ZnO + SO 3 = ZnSO 4 Домашнее задание: стр.167(«Решите пример») – обязательно прочитать и разобраться! Стр. 167, упр 1а стр. 172, упр 3а
Проверка домашнего задания
C тр 167, упр 1а Mg → Mg O → MgCl 2 2 Mg + O 2 = 2 MgO 2) MgO + 2 HCl = Mg Cl 2 + H 2 O C тр 172, упр 3а S → SO 2 → Na 2 SO 3 S + O 2 = SO 2 (у серы есть 2 оксида: SO 2 u SO 3 . При горении серы в кислороде получается всегда оксид серы ( IV ) — SO 2 ) 2 NaOH + SO 2 = Na 2 SO 3 + H 2 O Или Na 2 O + SO 2 = Na 2 SO 3 Металл основный соль оксид неметалл кислотный соль оксид Кто хочет учиться на «5» и «4», составьте для 2-го перехода сокращенные ионные уравнения реакций. Не забудьте, что оксиды – неэлектролиты ! Результаты ( фото+ фамилия) прислать chemist 4 dist @ mail . ru
По теме: методические разработки, презентации и конспекты
Открытый урок в 9 классе Радиоактивные превращения
К уроку прилагаются: презентация, самостоятельная работа на 2 варианта, видеофрагмент распадов, оценочный лист обучающегося.
Цепочка превращений и теория электролитической диссоциации
Генетическая связь классов неорганических соединений, составление молекулярных, ионных и окислительно-восстановительных реакций — все это представлено в данной презентации для учащихся 8-9-х классов. .
Цепочки превращений веществ
Цепочки превращений веществ.
Презентация «Цепочка превращений»
Материал для урока химии в 9 классе.
Подготовка к ЕГЭ «Цепочки превращений»
генетические ряды неорганических веществ. цепочки превращений
закрепление понятий основных классов неорганических веществ, их генетическая связь и превращение .
Взаимосвязи организмов ( Цепочки превращений )
Взаимосвязи организмов и окружающей среды (тест).
http://infourok.ru/algoritm-resheniya-cepochek-prevrashenij-veshestv-instrukciya-dlya-uchashihsya-8-klassa-4304493.html
http://nsportal.ru/shkola/khimiya/library/2020/04/03/urok-tsepochki-prevrashcheniy-8-klass