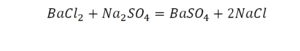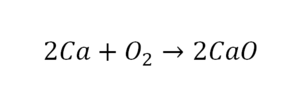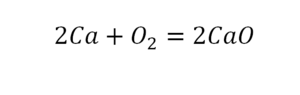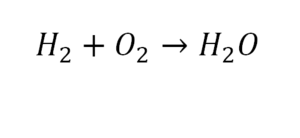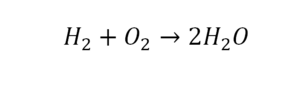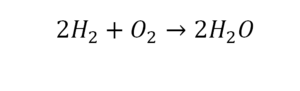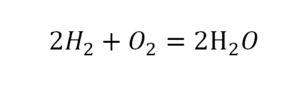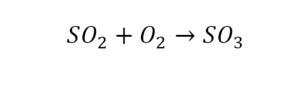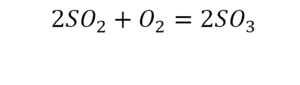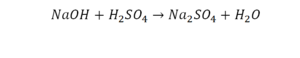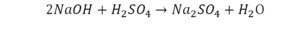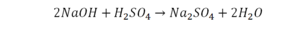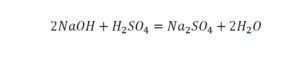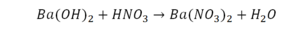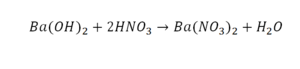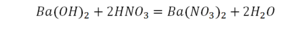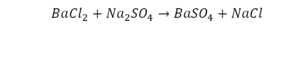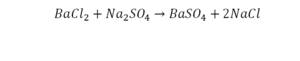Уравнения химических реакций
Уравнение химической реакции – это описание химической реакции с помощью химических формул.
Уравнение химической реакции состоит из двух частей, соединенных знаком равенства. Слева от знака равенства приводятся формулы исходных веществ, а справа – формулы веществ, образующихся в результате реакции, или продуктов реакции. Уравнения показывают не только какие вещества вступают в реакцию, и какие получаются в результате, но и указывают на их количество.
Число атомов каждого элемента в левой и правой частях реакции должно быть одинаковым.
Цифра, стоящая перед формулой любого химического вещества в уравнении химической реакции и показывающая число частиц (а также количество частиц), обозначенных химическойформулой называется стехиометрическим коэффициентом.
Подбор коэффициентов в химических уравнениях осуществляется с помощью простых рассуждений. После того, как написаны формулы исходных веществ и продуктов реакции, расставляются соответствующие стехиометрические коэффициенты. При этом добиваются равенства числа атомов в левой и правой частях уравнения.
Для нахождения неизвестного количества вещества по уравнениям реакций и известному количеству одного из участников реакции, составляют соответствующие пропорции.
Например, требуется определить число моль атомов водорода, необходимое для получения пяти моль молекул водорода по реакции, представленной следующим уравнением:
Из уравнения реакции следует, что из двух атомов (двух моль атомов) водорода образуется одна молекула (один моль молекул) водорода.
2 моль атомов Н — 1 моль молекул Н2,
х моль атомов H — 5 моль молекул Н2.
следует, что для получения 5 моль молекул водорода требуется 10 моль атомов водорода.
x = 5 · 2/1 = 10 моль.
Вопросы для самоконтроля по теме
«Первоначальные понятия химии»
1. Что изучает химия?
2. Что такое вещество?
3. Что такое материя?
4. Каковы основные положения атомно-молекулярного учения?
5. Дайте определение понятиям: а) атом, б) молекула,
в) химический элемент.
6. Что отличает один химический элемент от другого?
7. Что такое химический знак (символ элемента) и что он обозначает?
8. Что обозначает химическая формула?
9. Дайте определение понятиям: а) простое вещество, б) сложное вещество.
10. Какое явление называется аллотропией? Чем оно вызвано?
11. Чем отличаются химические явления от физических?
12. Чем отличается чистое вещество от смеси веществ?
13. Какие признаки химических реакций Вам известны?
14. Что называется абсолютной массой атома? Какой порядок имеют величины абсолютных масс атомов в граммах?
15. Что называется относительной атомной массой?
16. Что такое атомная единица массы?
17. Как можно вычислить абсолютные и относительные молекулярные массы?
18. Что такое моль?
19. Чему равно число Авогадро? Что оно обозначает?
20. Что такое молярная масса? Какова ее размерность?
21. Какой зависимостью связаны между собой масса (m), молярная масса (М) и количество вещества (ν)?
22. Что такое качественный состав вещества?
23. Что такое количественный состав вещества? Какими способами его можно выразить?
24. Как определяется массовая доля элемента в сложном веществе?
25. Что такое валентность?
26. Что такое степень окисления? Чему равна сумма степеней окисления всех атомов в молекуле химического вещества?
Примеры комплексных тестов для самоконтроля знаний
По теме «Первоначальные понятия химии»
Вариант № 1
1. В каком числе случаев упоминаются простые вещества:
олеум*, вода, железо, мел, сера, сахар, графит?
2. Под каким номером приведена запись, изображающая 2 моль молекул воды:
1. Н2О, 2. 2Н2О2, 3. Н2О2, 4. 2Н2О?
3. Под каким номером приведено округленное значение относительной молекулярной массы хлора:
1. 17, 2. 35,5, 3. 71 г/моль, 4. 71 г, 5. 71?
4. В массе 1 грамм какого из перечисленных ниже веществ, содержится наибольшее количество этого вещества (в молях)? В ответе укажите номер, под которым расположена формула этого вещества.
1. Н2, 2. Н2Те, 3. НF, 4. СO2, 5. NO2.
5. Массовые доли меди и цинка в некотором сплаве соответственно равны ω(Cu) = 60 % и ω(Zn) = 40 %. Какое количество вещества (в молях) меди приходится на 1 моль цинка в этом сплаве? В ответе укажите номер, под которым расположено правильное значение.
1. 1,50, 2. 3, 3. 1,525, 4. 63,5, 5. 0,985.
Вариант № 2
1. В каком числе нижеприведенных примеров кислород упоминается в качестве элемента, а не простого вещества:
– атом кислорода имеет заряд ядра, равный 8;
– кислород можно получить фракционированием воздуха;
– данная руда состоит из железа и кислорода;
– магний горит в кислороде?
2. Сколько веществ из числа приведенных ниже являются металлами:
магний, кальций, фосфор, олово, бром, аргон?
3. Чему равно округленное значение относительной молекулярной массы сульфата бария (ВаSO4)? В ответе укажите номер, под которым расположено правильное значение.
1. 0,233, 2. 233, 3. 233 г/моль, 4. 104, 5. 233 г.
4. Учитывая, что масса атома углерода maтома(С) = 1,95·10 –26 кг, рассчитайте значение атомной единицы массы в граммах. В ответе укажите номер, под которым расположено правильное значение.
1. 1,66 · 10 –24 , 2. 1,66 · 10 –27 , 3. 1,95 · 10 –26 ,
4. 6,02 · 10 23 , 5. 1,59 · 10 –23 .
5. Вещество состоит из атомов элементов углерода, водорода и кислорода. Количественный состав его выражается соотношением:
Под каким номером расположена простейшая формула вещества:
 |
* см. табл. 11 приложения.
Вариант № 3
1. В каком числе случаев речь идет о веществе, а не о физическом теле:
вода, сахар, гвоздь, бензин, железо, воронка?
2. В каком числе перечисленных ниже примеров речь идет о признаках химических реакций (а не об условиях химических реакций):
предварительное нагревание реагирующих веществ,
увеличение поверхности соприкосновения реагирующих веществ,
выделение газообразного вещества,
3. Каково отношение масс элементов m (H) : m (С) : m (O) в уксусной кислоте СН3СООН ? В ответе укажите номер, под которым расположено правильное значение.
1. 1 : 6 : 8, 2. 2 : 24 : 10, 3. 2 : 1 : 1, 4. 4 : 2 : 2, 5. 3 : 12 : 16.
4. Чему равна масса в граммах 10 молекул серной кислоты (Н2SO4)? В ответе укажите номер, под которым расположено найденное значение.
1. 1,63 · 10 –21 , 2. 98, 3. 980, 4. 6,02 · 10 –23 , 5. 1,63 ·10 –22 .
5. Чему равно значение массовой доли элемента серы (в %) в сероводороде (Н2S)? В ответе укажите номер, под которым расположено правильное значение.
1. 94,1, 2. 82, 3. 33,3, 4. 88,85, 5. 11,2.
Ответы см. на стр. 48.
Система охраняемых территорий в США Изучение особо охраняемых природных территорий(ООПТ) США представляет особый интерес по многим причинам.
ЧТО И КАК ПИСАЛИ О МОДЕ В ЖУРНАЛАХ НАЧАЛА XX ВЕКА Первый номер журнала «Аполлон» за 1909 г. начинался, по сути, с программного заявления редакции журнала.
ЧТО ТАКОЕ УВЕРЕННОЕ ПОВЕДЕНИЕ В МЕЖЛИЧНОСТНЫХ ОТНОШЕНИЯХ? Исторически существует три основных модели различий, существующих между.
Что делать, если нет взаимности? А теперь спустимся с небес на землю. Приземлились? Продолжаем разговор.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Химические формулы простых и сложных веществ
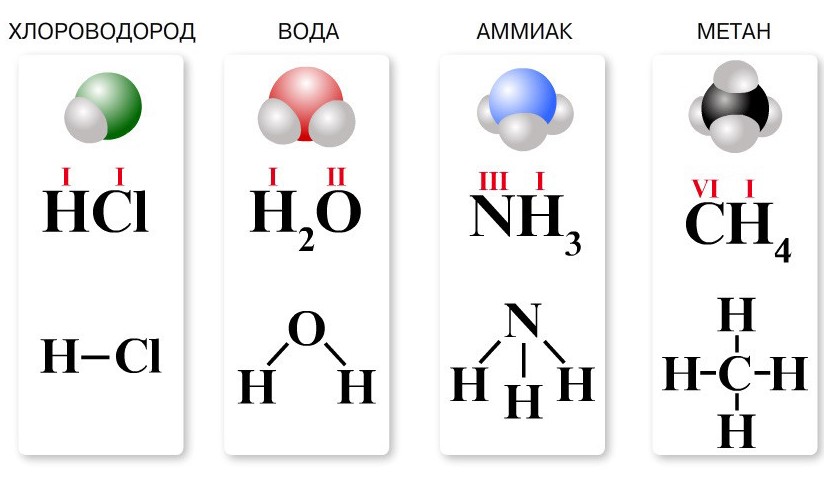
Химическая формула необходима для отражения состава вещества с помощью специальных символов и индексов. Формула включает символы химических элементов, уточнить которые всегда можно в таблице Менделеева, и индексы. В последнем случае речь идет о цифре, которая ставится справа снизу после знака элемента и указывает на количество его атомов. При ответственной подготовке к ЕГЭ по химии без умения читать формулы веществ просто не обойтись.
Химические формулы простых и сложных веществ
Для большинства простых веществ (многие неметаллы и все металлы) формула представляет собой знак соответствующего химического элемента. Так, для вещества медь и химического элемента медь обозначение одинаково — Cu. Если же вещество существует в форме молекул, то к знаку химического элемента справа внизу добавляется индекс, которые указывает на количество атомов в молекуле. В соответствии с этим правилом формула кислорода записывается как O2, хлора — Cl2, фосфора — P4.
Химическая формула простого вещества дает возможность получить следующую информацию:
- Название вещества;
- Относительная атомная масса;
- Молярная масса.
Химическая формула: что это и какую информацию несет
На примере алюминия Al можно сказать следующее:
При записи химических формул сложного вещества указывают знаки всех составляющих химических элементов и индексы, по которым можно определить, сколько элементов конкретного атома входит в молекулу. Если индекс отсутствует, то необходимо иметь в виду, что возле знака находится цифра 1.
Химическая формула: что это и какую информацию несет
В некоторых случаях в уравнении реакции перед формулой может стоять цифра. Речь идет о коэффициенте, отражающем число молекул или молей вещества. Если знак химического элемента стоит не перед, а после коэффициента, то речь идет о количестве атомов данного элемента. Например, 3Cu: количество атомов меди — три, количество моль — тоже три.
Химическая формула сложного вещества дает возможность получить следующую информацию:
- Название вещества;
- Класс веществ, к которым оно относится;
- Относительная молекулярная масса;
- Молярная масса;
- Качественный состав (список образующих вещество химических элементов);
- Количественный состав (количество атомов каждого элемента, количество молей);
- Массовый состав (массовые доли отдельных элементов в веществе, их массы в 1 моле вещества).
Химическая формула: что это и какую информацию несет
Возьмем для примера глюкозу C6H12O6 и разберем ее по представленному выше плану:
- Глюкоза;
- Углеводород;
- Mr(C6H12O6) = 6Ar(C) + 12Ar(H) + 6Ar(O) = 6·12 + 12·1 + 6·16= 72 + 12 + 96 = 180;
- 180 г/моль;
- Углерод, водород, кислород;
- В молекуле глюкозы содержится 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, в 1 моль глюкозы 6 моль углерода, 12 моль водорода и 6 моль кислорода;
- W(C) = (n(C)·Ar(C))/Mr(C6H12O6) = (6·12)/180= 0,4 (40%)
В 1 моль глюкозы (100 г) содержится 40 г углерода, 7 г водорода и 53 г кислорода.
Химическая формула: что это и какую информацию несет
Структурная химическая формула
Под структурной формулой понимается изображение, отражающее в графическом виде структуру молекул, порядок соединения атомов в них, а также валентность элементов. Данная информация может быть представлена в 2D или 3D виде. В первом случае для обозначения общих электронных пар используются штрихи (валентные черточки).
Химическая формула: что это и какую информацию несет
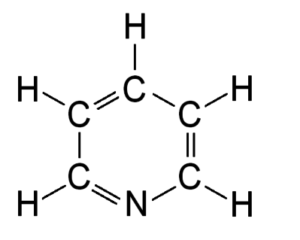
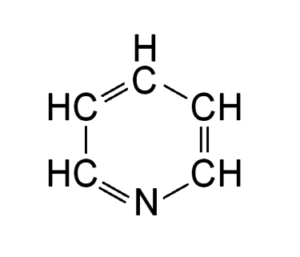
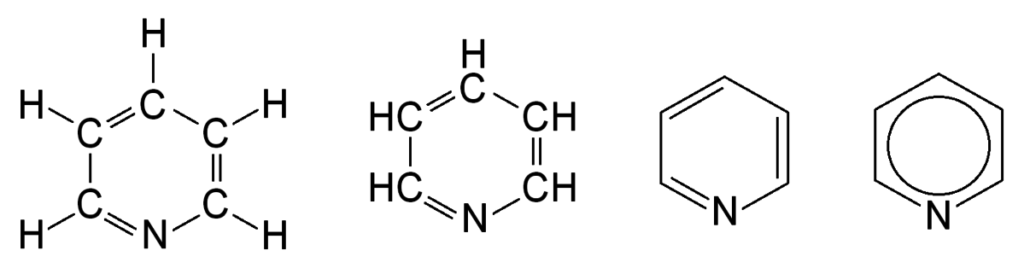
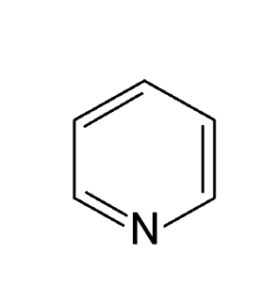
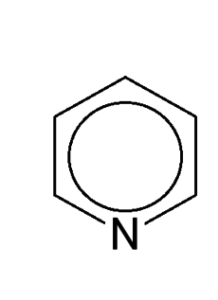
Структурные 2D формулы могут быть представлены в нескольких вариантах (в качестве примера приведен пиридин C5H5N):
- Развернутые. Содержат самую полную информацию, в них представлены все химические элементы и отражены все химические связи;
- Развернутые без указания валентными штрихами связей с атомами водорода;
- Скелетные. Данный вариант является самым кратким — здесь отсутствует информация об атомах водорода, которые связаны с атомами, и о самих связях тоже. Для обозначения атомов углерода и их связей используется ломаная: вершины и концы, которые не контактируют ни с одним из атомов, являются атомами углерода, а звенья между ними — связями.
- Формулы для соединений с бензольным кольцом. Речь идет о шестиугольнике, внутри которого находится окружность. Такая запись свидетельствует о том, что все связи между атомами углерода равноправны.
Порядок составления графических структурных формул первого и второго типов следующий:
- Определяем валентность химических элементов, составляющих вещество;
- Выписываем знаки химических элементов по одному знаку на каждый входящий в вещество атом;
- Соединяем выписанные знаки штрихами. Каждая черта — общая электронная пара, которая связывает химические элементы и в одинаковой степени принадлежит им обоим. Знаки элементов должно окружать такое количество штрихов, которое соответствует их валентности.
Химическая формула: что это и какую информацию несет
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://egevpare.ru/himicheskaya-formula-inromatsiya/