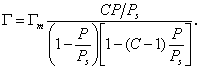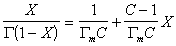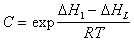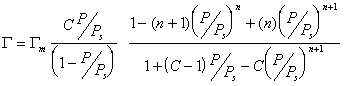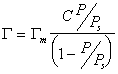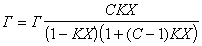Измерение удельной поверхности. Метод БЭТ
Методы анализа поверхности тел с участием сорбируемых газов приобрели особое значение в связи с появлением новых материалов с уникальной структурой и свойствами.
Для измерения удельной поверхности и пористой структуры высокодисперсных твердых тел или систем с развитой пористостью, таких, как порошки, адсорбенты, катализаторы, а также для расчета размера нанесенных частиц широко используются изотермы адсорбции, – экспериментальные зависимости адсорбции a от давления р/р0 при постоянной температуре.
Существует несколько методов математического описания физической адсорбции.
Определение удельной поверхности методом БЭТ (Брунауэра-Эммета-Теллера) является наиболее распространенным методом. В нем используются следующие допущения: поверхность адсорбента однородна; взаимодействие адсорбент–адсорбат сильнее, чем адсорбат–адсорбат; взаимодействие адсорбированных молекул учитывается только в направлении, перпендикулярном поверхности, и рассматривается как конденсация. Для вычисления площади поверхности адсорбента определяется объем газа относительно мономолекулярного слоя и площадь поперечного сечения молекулы адсорбированного газа. Принято считать, что метод БЭТ можно использовать для измерения площади поверхности с точностью 5-10% в интервале значений относительного давления р/р0 0,05-0,35.
Удельная поверхность по уравнению бэт
В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
где i — количество групп одинаковых центров.
Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. После анализа многочисленных реальных изотерм адсорбции ими была предложена их классификация на основе выделения пяти основных типов изотерм.
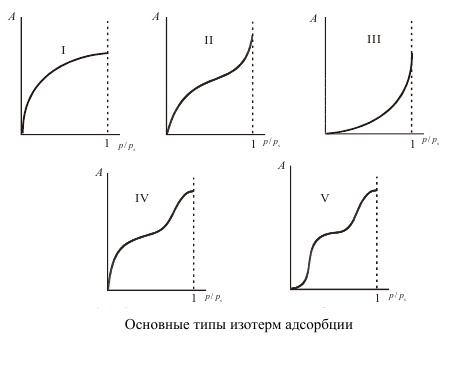
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией. Приче м, в случае II взаимодействие адсорбент — адсорбат сильнее взаимодействия адсорбат — адсорбат, а в случае III — наобор от. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на не пористом адсорбенте, а типа IV и V — на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”, названной так по начальным буквам фамилий ее авторов.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент — адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат — адсорбент, во всех последующих слоях — взаимодействием адсорбат — адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:
В приведенном уравнении АМ — емкость монослоя, С — константа, равная е (q1− λ) / RT . При малых относительных давлениях, когда р как частный случай уравнения БЭТ. В случаях, когда q1 > λ , т.е. энергия взаимодействия адсорбент — адсорбат больше энергии взаимодействия адсорбат — адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат — адсорбат больше теплоты адсорбции ( λ > q1 ), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.
Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77 К. В этом случае wо = 0.162 нм 2 .
- Источник: Пальтиель Л.Р., Зенин Г.С., Волынец Н.Ф. КОЛЛОИДНАЯ ХИМИЯ: Учеб. пособие. – СПб: СЗТУ, 2004. – 68 с.
- Источник: Кукушкина И.И., Митрофанов А.Ю. Коллоидная химия, Кемерово:2009 — 185 с.
Метод БЭТ
Метод БЭТ сокр., БЭТ (англ. BET) — метод математического описания физической адсорбции основанный на теории полимолекулярной (многослойной) адсорбции.
Теория полимолекулярной адсорбции была развита в работах Брунауэра, Эммета и Теллера (БЭТ). В основе этой теории лежит распространение обобщенных представлений локализованного монослоя на полислойную адсорбцию. В теории БЭТ используется предпосылка, что молекулы каждого предыдущего адсорбционного слоя служат активными центрами при образовании последующих слоев. Это предполагает, что емкость каждого слоя одинакова. Считается, что силами взаимодействия между молекулами в каждом адсорбционном слое можно пренебречь (отсутствие латеральных взаимодействий), а молекулы каждого адсорбционного слоя локализованы. Полагается, что адсорбционный потенциал в первом адсорбционном слое значительно выше, чем в других слоях, а начиная со второго адсорбционного слоя он сопоставим с энергией конденсации (изотермы типа II, IV) или для всех слоев одинаков (изотермы III, IV).
Существует несколько методик вывода уравнений изотермы полимолекулярной адсорбции. В работах Брунауэра с сотрудниками использовался кинетический вывод уравнения изотермы полимолекулярной адсорбции. Позднее вывод этого уравнения был осуществлен методом статистической термодинамики.
В оригинальном кинетическом выводе уравнения изотермы адсорбции БЭТ рассматривается равновесие между адсорбционными комплексами различного заполнения. Считается, что на поверхности адсорбента одновременно могут находиться незаполненные активные центры и адсорбционные комплексы, содержащие 1, 2, 3…i, молекул адсорбата, которым соответствует площадь поверхности адсорбентаA0, A1, A2, A3, …Ai.
В 1937 году Брунауэр С., Эммет П. и Теллер Е. вывели уравнение полимолекулярной физической адсорбции, которое описывает зависимость физической адсорбции от величины поверхности:
Уравнение известно как простая форма изотермы адсорбции БЭТ. Это уравнение может быть представлено в линейной форме. Обозначим для упрощения Р/Р S =Х и разделим на X обе части уравнения:
В такой форме график зависимости должен давать прямую с наклоном С-1/ГmС и отрезком, отсекающим на оси ординат 1/ ГmС .Решение двух численных уравнений позволяет определить постоянную уравнения С, предел адсорбции Гm в монослое и рассчитать удельную активную поверхность Ауд = nmAo = ГmAoNA, где Гm должна быть выражена в моль/г; А0– называют площадью молекулярного сечения адсорбата или чаще – адсорбционной «посадочной площадкой» (этот параметр представляет собой площадь, которую занимает молекула адсорбата в насыщенном мономолекулярном слое).
Температурная зависимость постоянных равновесия K1 и С позволяет определить чистую теплоту адсорбции, так как
где DH1 , DHL – теплота адсорбции в первом адсорбционном слое и теплота конденсации адсорбата.
Если адсорбент пористый и адсорбция идет в результате заполнения мезопор, то уравнение БЭТ принимает вид:
Интересно отметить, что уравнение при n=1 переходит в уравнение Ленгмюра:
В то время как уравнение БЭТ в простейшей форме может перейти в уравнение Ленгмюра только при дополнительных условиях, что С>>1 и Р/Рs 2, то уравнение БЭТ дает изотермы типа II, при С
Строго говоря, достаточно надежные данные по емкости монослоя получаются лишь при обработке результатов эксперимента по адсорбции в области малых давлений, где модель полислойной адсорбции БЭТ оказывается справедливой. Часто на линейной изотерме адсорбции наблюдаются два участка – один в области низких относительных давлений, другой — при более высоких давлениях. Для расчетов Гm следует использовать линейный участок при низких давлениях, но только в том случае, если он включает в себя точку В. Чаще всего для определения емкости монослоя используют данные по адсорбции при 0,05 0,3 проявляется латеральное взаимодействие в адсорбционных споях.
Статистико-механическая трактовка полимолекулярной адсорбции и соответствующий вывод уравнения изотермы не позволяют снять указанные выше ограничения.
Кроме того, предпринимались неоднократные попытки модифицировать уравнение БЭТ. Так Андерсон предположил, что от второго до примерно девятого слоев теплота адсорбции отличается от теплоты конденсации на некоторую постоянную величину. Это позволило ввести в простейшее уравнение некоторую постоянную K
Интересно отметить, что в более поздних работах Брунауэра была получена аналогичная форма уравнения, но вывод его был основан на другой модели, а именно, на предпосылке, что число адсорбционных слоев даже на открытой поверхности при давлении насыщения Р/Рs®1 ограничено (5-6). Такое допущение также noзволяет ввести коэффициент K 2 /г, включив в нее изотерму адсорбции на природном кварце и различных образцах непористого и аморфного кремнезема. Такие стандартные изотермы получены и для других систем.
Многочисленные эксперименты на непористых сорбентах показали, что для определения удельной поверхности твердых адсорбентов наиболее удобно простейшее уравнение БЭТ. Для таких целей используют азот, аргон и криптон. Последний, предпочтительнее для адсорбентов с малой величиной удельной активной поверхности.
http://www.sites.google.com/site/kolloidnaahimia/adsorbcia-svistat-vseh-na-poverhnost/teoria-polimolekularnoj-adsorbcii-teoria-bet
http://chemistry.herzen.spb.ru/%D0%B0%D0%B4%D1%81%D0%BE%D1%80%D0%B1%D1%86%D0%B8%D1%8F-%D1%81%D0%B2%D0%B8%D1%81%D1%82%D0%B0%D1%82%D1%8C-%D0%B2%D1%81%D0%B5%D1%85-%D0%BD%D0%B0-%D0%BF%D0%BE%D0%B2%D0%B5%D1%80%D1%85%D0%BD%D0%BE%D1%81/%D0%BC%D0%B5%D1%82%D0%BE%D0%B4-%D0%B1%D1%8D%D1%82/