Теплообмен. Количество теплоты. Удельная теплоемкость. Уравнение теплового баланса.
Теплообмен— процесс изменения внутренней энергии без совершения телом работы ли самим телом.
Количество теплоты – это количественная мера изменения внутренней энергии тела при теплообмене. Измеряется в джоулях.
Удельная теплоемкость – это количество теплоты, которое необходимо сообщить телу массой 1 кг чтобы изменить его температуру на 1 К (1 °С).
Количество теплоты можно рассчитать:
1) Q = c∙m∙(T2-T1) = c∙m∙∆T – при нагревании или охлаждении; где Q – количество теплоты; с – удельная теплоемкость вещества, [c] = 
2) Q = λ∙m – при плавлении или кристаллизации, где λ – удельная теплота плавления [λ] = Дж/кг. При плавлении тело получает энергию, при кристаллизации – выделяет.
3) Q = r∙m – при парообразовании или конденсации; r – удельная теплота парообразования, [r] = Дж/кг. При парообразовании энергия поглощается телом, при конденсации – выделяется.
4) Q = q∙m – при сгорании вещества данное количество энергии выделяется веществом; q – удельная теплота сгорания топлива, [q] = Дж/кг.
Значения величин c, λ, r, q берут из соответствующих таблиц.
Если теплообмен происходит между несколькими телами, составляющими изолированную от окружающих тел систему, то применяют уравнение теплового баланса: Q1 + Q2 + … + Qn = 0
Уравнение теплового баланса справедливо для замкнутой системы (т. е. для достаточно изолированной от окружающих тел системы из-за чего ее внутренняя энергия не изменяется). Никакой работы внутри такой системы не совершается
∆U = Q + A, где А – работа внешних сил.
Поэтому, согласно первому закону термодинамики изменение энергии любого тела системы равно количеству теплоты отданной или полученной этим телом до наступления теплового равновесия внутри системы.
Складывая подобные выражения для всех тел системы и учитывая, что внутренняя энергия не меняется:
где Q1, Q2 – количество теплоты, полученное или отданное телами; n – число тел, участвующих в теплообмене.
Теплоту, полученную телом, считают положительной и в уравнении берут со знаком «+»; теплоту, отданную телом, считают отрицательной и ставят знак «-».
Уравнение теплового баланса первоначально было открыто при наблюдении теплообмена между телами в калориметре – приборе, максимально изолирующем систему тел от воздействия окружающей среды.
Алгоритм решения задач на уравнение теплового баланса:
1. Внимательно прочитать условие задачи, выяснить, сколько тел участвует в теплообмене и какие физические процессы происходят.
2. Кратко записать условие задачи, дополняя необходимыми табличными величинами.
3. Записать уравнение теплового баланса с учетом знака количества теплоты. Если тело получает энергию, то ставят знак «+», если отдает, то ставят знак «-».
4. Записать необходимые формулы для расчета количества теплоты.
5. Решить полученное уравнение в общем виде относительно искомых величин.
6. Произвести проверку размерности (единиц измерения) полученной величины.
7. Подставить исходные данные задачи и вычислить значения искомых величин.
Пример решения задачи на уравнение теплового баланса:
Задача:В латунный калориметр массой 150 г, содержащий 200 г воды при 15 °С, опустили железную гирю массой 260 г при температуре 100 °С. Определить общую установившуюся температуру. Потери тепла не учитывать.
| Дано: mk = 150 г = 0,15 кг mв = 200 г = 0,2 кг Тв = 288 К Тк = Тв mг = 260 г = 026 кг Tг = 373 К ск = 380 Дж/(кг∙К) св = 4200 Дж/(кг∙К) сг = 460 Дж/(кг∙К) Найти: Т — ? | Решение: В теплообмена участвуют три тела: калориметр, вода и железная гиря. По таблицам определяем удельную теплоемкость латуни, воды и железа. Можно рассматривать эту систему как замкнутую. Процессы: 1) Охлаждение железной гири: Qг = cг∙mг∙(Tг -T) – тепло отданное гирей 2) Нагревание воды: Qв = cв∙mв∙(T-Tв) – полученное количество тепла 3) Нагревание калориметра: Qк = cк∙mк∙(T-Tк) – полученное количество тепла Запишем уравнение теплового баланса: Qк + Qв – Qг = 0 Подставим в уравнение выражение для количества теплоты: cк∙mк∙(T-Tк) + cв∙mв∙(T-Tв) — cг∙mг∙(Tг -T) = 0 Из этого уравнения находим установившуюся температуру: T =  = 298 К = 25 °С = 298 К = 25 °С |
Задачи: (при решении использовать формулы 1 – 4, а также вышеприведенный пример решения задачи на уравнение теплового баланса)
1. Кубики, изготовленные из алюминия и серебра массой 1 кг каждый, охлаждают на 1 °С. На сколько изменится внутренняя энергия каждого кубика.
2. Нагретый камень массой 5 кг, охлаждаясь в воде на 1 °С, передает ей 2,1 кДж тепла. Чему равна теплоемкость камня? Удельная теплоемкость?
3. Кусок льда массой 0,8 кг нагревают от -20 °С до 0 °С. При этом затрачено количество теплоты 33,6 кДж. Определить теплоемкость куска льда в этом процессе и удельную теплоемкость льда, если плавление не происходит.
4. Сколько энергии пошло на нагревание от 20 °С до 920 °С железной заклепки, масса которой 110 г.
5. Какое количество теплоты пойдет на нагревание воды от 15 °С до 25 °С в бассейне, длина которого 100м, ширина 6 м и глубина 2 м?
6. На сколько градусов нагреется вода объемом 2 л, если ей сообщить количество теплоты 100 Дж.
7. При охлаждении куска олова массой 100 г до температуры 32 °С выделилось 5 кДж теплоты. Какой была температура олова до охлаждения?
8. На нагревание кирпича массой 4 кг на 63 °С затрачено такое же количество теплоты, как и для нагревания 4 кг воды на 13,2 °С. Сему равна удельная теплоемкость кирпича?
9. На какую высоту можно было бы поднять груз массой 2 т, если бы удалось полностью использовать энергию, освободившуюся при остывании стакана воды от температуры 100 °С до температуры 20 °С. Объем стакана 250 см 3 .
10. Какое количество льда, взятого при температуре плавления, можно растопить, затратив энергию 340 Дж?
11. Сколько теплоты уходит на приготовление воды из льда, масса которого 10 кг? Лед взят при температуре – 20 °С, а температура воды должна быть 15 °С.
12. Какое количество теплоты выделяется при конденсации водяного пара массой 2,5 кг, взятого при температуре кипения?
13. Какое количество теплоты необходимо для нагревания воды массой 10 кг от температуры 5 °С до 100 °С и превращения в пар ее части 0,4 кг?
Первый закон термодинамики:
Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, сообщенного системе, и работы внешних сил, совершаемой над системой, то есть:
Или: Количество теплоты, переданное системе, идет на изменение е внутренней энергии и на совершение системой работы над внешними телами:
где Q – количество теплоты; ∆U – изменение или приращение внутренней энергии, А – работа внешних сил; А’ – работа самой системы.
А = — А’ = — p∙∆V, ∆V – изменение объема.
Процессы в газах в рамках первого закона термодинамики:
1. Изотермический процесс: (T = const): Внутренняя энергия не меняется: ∆U = 0 => Q = A.
Количество теплоты, сообщаемое системе, идет на совершение механической работы.
2. Изобарный процесс (p = const): В этом случае, если Q > 0, то газ и нагревается, и совершает механическую работу: Q = ∆U + A; A = p∙∆V.
3. Изохорный процесс (V = const): Механическая работа не совершается, так как ∆V = 0 => A = 0; следовательно, Q = ∆U, то есть количество теплоты идет на изменение внутренней энергии.
4. Адиабатный процесс – процесс, протекающий без теплообмена с окружающей средой: Q = 0. Следовательно, ∆U = A.
1. При изотермическом расширении идеальным газом совершена работа 15 кДж. Какое количество теплоты сообщено газу?
2. В закрытом баллоне находится газ. При охлаждении его внутренняя энергия уменьшилась на 500 Дж. Какое количество теплоты отдал газ? Совершил ли он работу?
Решение задач на теплообмен с использованием уравнения теплового баланса (методические рекомендации)
Разделы: Физика
Пособие рекомендовано учащимся, желающим получить практические навыки в решении задач на теплообмен, и может быть полезным для учителей и абитуриентов.
При соприкосновении тел, имеющих разные температуры, между этими телами происходит теплообмен. С точки зрения молекулярно-кинетической теории, это объясняется так: молекулы более нагретого тела имеют большую кинетическую энергию, чем молекулы тела, менее нагретого. При “столкновениях” молекул соприкасающихся тел происходит процесс выравнивания их средних кинетических энергий. Молекулы более нагретого тела теряют часть своей кинетической энергии, при этом нагретое тело будет остывать. Кинетическая энергия молекул холодного тела возрастает, поэтому температура этого тела будет увеличиваться. В конечном итоге кинетические энергии молекул обоих тел сравняются, и температуры тел станут одинаковыми. На этом теплообмен прекращается.
Энергию, которую тело получает или отдаёт в процессе теплообмена, называют количеством теплоты (Q).
Количество теплоты, как и все другие виды энергии, измеряется в системе СИ в Джоулях: [Q] = Дж. (Здесь и в дальнейшем единицы измеряются в системе СИ.)
Нагревание или охлаждение
При нагревании или охлаждении тела количество теплоты, поглощаемое или выделяемое им, рассчитывается по формуле:
(t2 – t1) – разность температур тела,° С (или К);
с – удельная теплоёмкость вещества, из которого состоит тело,
Удельная теплоёмкость вещества – это количество теплоты, которое нужно сообщить одному килограмму данного вещества, чтобы увеличить его температуру на 1° С (или это количество теплоты, которое выделяет один килограмм данного вещества, остывая на 1° С).
Значения удельных теплоемкостей других веществ можно найти в справочниках, а также в школьном учебнике или задачнике.
При нагревании тела его внутренняя энергия увеличивается. Это требует притока энергии к телу от других тел. Значит, оно поглощает некоторое количество теплоты, принимая его от других тел, участвующих в теплообмене.
При охлаждении тела его внутренняя энергия уменьшается. Поэтому остывающее тело отдаёт кому-либо некоторое количество теплоты.
Обычно конечную температуру, установившуюся в результате теплообмена, обозначают греческой буквой 
В формуле (1) произведение cm для каждого конкретного тела есть величина постоянная. Её называют теплоёмкостью тела и обозначают С:
Размерность теплоемкости: 
Теплообмен между телами, имеющими одинаковые температуры, не происходит, даже если контактируют вещества, находящиеся в разных агрегатных состояниях. Например, при температуре плавления (0° С) лёд и вода могут находиться бесконечно долго, при этом количество льда и количество воды останутся неизменными. Аналогично ведут себя пар и жидкость, находящиеся при температуре кипения. Теплообмен между ними не происходит.
Плавление или кристаллизация
Если при нагревании тела его температура достигнет температуры плавления, то начинает происходить процесс перехода этого вещества из твердого состояния в жидкое. При этом идут изменения в расположении и характере взаимодействия молекул. Температура при плавлении не изменяется. Это означает, что средние кинетические энергии молекул жидкости и твердого тела при температуре плавления одинаковы. Однако внутренняя энергия тела при плавлении возрастает за счет увеличения энергии взаимодействия молекул. Количество теплоты, поглощаемое телом при плавлении, рассчитывается по формуле

где m – масса тела, кг;

При кристаллизации, наоборот, внутренняя энергия тела уменьшается на величину 
Удельная теплота плавления показывает, сколько энергии нужно сообщить одному килограмму данного вещества, взятого при температуре плавления, чтобы полностью превратить его при этой температуре в жидкость (или сколько энергии выделяет 1 кг жидкости, взятой при температуре кристаллизации, если вся она при этой температуре полностью превратится в твёрдое тело).
Удельную теплоту плавления любого вещества можно найти в справочниках. Для льда же
Температура плавления у каждого вещества своя. Её также можно найти в справочниках. Важно подчеркнуть, что температура плавления вещества равна температуре кристаллизации этого же вещества. У льда tпл = 0° С.
Кипение или конденсация
При достижении жидкостью температуры кипения начинает происходить другой фазовый переход – кипение, при котором расстояния между молекулами значительно увеличиваются, а силы взаимодействия молекул уменьшаются. Вся подводимая к жидкости теплота идет на разрыв связей между молекулами. При конденсации пара в жидкость, наоборот, расстояния между молекулами значительно сокращаются, а силы взаимодействия молекул увеличиваются. Для кипения жидкости энергию к жидкости нужно подводить, при конденсации пара энергия выделяется. Количество теплоты, поглощаемое при кипении или выделяемое при конденсации, рассчитывается по формуле:
где m – масса тела, кг; L – удельная теплота парообразования,
Удельная теплота парообразования показывает, сколько энергии нужно сообщить одному килограмму жидкости, взятой при температуре кипения, чтобы при этой температуре полностью превратить её в пар (для конденсации: сколько энергии выделяет один килограмм пара, взятого при температуре конденсации, полностью превращаясь в жидкость).
При одинаковом давлении температура кипения и температура конденсации одного и того же вещества одинаковы.
Температуры кипения и удельные теплоты парообразования также можно найти в справочниках. Для воды же они соответственно равны: рис. 9 (при нормальном атмосферном давлении).
Уравнение теплового баланса
Тела, участвующие в теплообмене, представляют собой термодинамическую систему. Термодинамическая система называется теплоизолированной, если она не получает энергию извне и не отдаёт её; теплообмен происходит только между телами, входящими в эту систему. Для любой теплоизолированной системы тел справедливо следующее утверждение: количество теплоты, отданное одними телами, равно количеству теплоты, принимаемому другими телами.
Это утверждение описывает частный случай закона сохранения и превращения энергии в применении к процессу теплообмена. А формула (5) является одним из видов уравнения теплового баланса.
При решении задач с помощью данного вида уравнения теплового баланса в формуле (1) в качестве t2 следует брать большую температуру, а в качестве t1 – меньшую. Тогда разность (t2 – t1) будет положительна и всё произведение cm(t2–t1) также будет положительным. Все теплоты, отданные и полученные, будут положительными.
Уравнение теплового баланса можно записать и в таком виде:
где n – количество тел системы.
Алгебраическая сумма всех количеств теплоты (поглощенных и выделенных) в теплоизолированной системе равна нулю.
Q1, Q2, …, Qn – это теплоты, поглощаемые или выделяемые участниками теплообмена. Очевидно, что в этом случае какие-то теплоты должны быть положительны, а какие-то – отрицательны. При записи уравнения теплового баланса в виде (6) всегда t2 – конечная температура, а t1 – начальная.
Если тело нагревается, то разность (t2 – t1) положительна и все произведение cm(t2 – t1) положительно. То есть Q > 0 тогда, когда теплота к данному телу подводится.
А если t2 0; если тело выделяет энергию (кристаллизация, конденсация), то Q
 | Проведём анализ: Вода и калориметр находились в тепловом равновесии, поэтому они имели одинаковую температуру: t1 = t2 = 20° С. При опускании в воду с температурой 20° С свинцового тела с температурой 90° С между водой и свинцом будет происходить теплообмен. Свинец будет остывать, а вода — нагреваться. В этом же процессе участвует и калориметр, который, как и вода, будет тоже нагреваться. |
 | Изменение температур тел с течением времени удобно изображать на графике зависимости t(t ). Отрезок АВ соответствует графику изменения температуры свинцового тела. Стрелка, идущая от него, показывает, что, остывая, свинец выделяет энергию Q3. |
| Два параллельных отрезка СВ соответствуют графикам изменения температур калориметра и воды. Стрелки, идущие к ним, показывают, что для нагревания калориметра и воды требуется энергия Q1 и Q2, которую они поглощают. | |
| Решим задачу с использованием уравнения теплового баланса в виде (5): |
Решим задачу с использованием уравнения теплового баланса в виде (6):
Ответ: Вода нагреется до 24° С.
Предлагаю читателю самостоятельно сделать проверку размерности.
Тепловое равновесие и уравнение теплового баланса
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
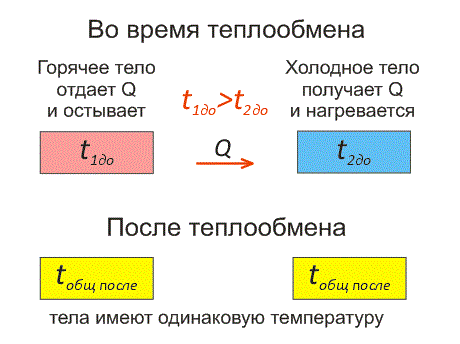
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
\(\large Q_<\text<остывания горяч>> \left( \text <Дж>\right) \) – это количество теплоты горячее тело теряет.
\(\large Q_<\text<нагревания холод>> \left( \text <Дж>\right) \) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
\[\large Q_ <1>+ Q_ <2>= 0 \]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
\[\large \boxed < Q_<1>+ Q_ <2>+ Q_ <3>+ \ldots + Q_
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
- \(\large c_<\text<воды>> \) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность \(\large (t_<\text<общ>> — t_<\text<горяч>> ) \) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность \(\large (t_<\text<общ>> — t_<\text<холодн>> ) \) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
\[\large 4200 \cdot 0,2 \cdot (t_<\text<общ>> — 80 ) + 4200 \cdot 0,1 \cdot (t_<\text<общ>> — 15 ) = 0 \]
\[\large 840 \cdot (t_<\text<общ>> — 80 ) + 420 \cdot (t_<\text<общ>> — 15 ) = 0 \]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- \(\large Q_ <1>\) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- \(\large Q_ <2>\) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- \(\large Q_ <3>\) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
http://urok.1sept.ru/articles/103594
http://formulki.ru/molekulyarka/teplovoe-ravnovesie-i-uravnenie-teplovogo-balansa