Укажите правильно написанное уравнение экзотермической реакции Выберите один ответ : 2HgO(т) = 2Hg(т) + O2(г) — 180 кДж С(т) + О2(г) = СО2(г) + 402 кДж 2HgO(т) → 2Hg(т) + O2(г) — 180 кДж С(т) + О2(г) ?
Химия | 10 — 11 классы
Укажите правильно написанное уравнение экзотермической реакции Выберите один ответ : 2HgO(т) = 2Hg(т) + O2(г) — 180 кДж С(т) + О2(г) = СО2(г) + 402 кДж 2HgO(т) → 2Hg(т) + O2(г) — 180 кДж С(т) + О2(г) → СО2(г) + 402 кДж.
2 и 4 то же самое.
Все равно, что 2, что 4.
Только там вроде энергии выделяется 402, 24 кДж.
Наверное, автор поленился дописать.
Если энтальпия образования SO3 равна – 297 кДж / моль, тогда количество теплоты, выделяемое при сгорании равно…?
Если энтальпия образования SO3 равна – 297 кДж / моль, тогда количество теплоты, выделяемое при сгорании равно….
1) 297 кДж 2) 594 кДж 3) 148, 5 кДж 4) 74, 25 кДж.
Какая масса угля вступает в реакцию уравнение которой C + O2 = CO2 + 420 кДж, если при этом выделяется 1608 кДж теплоты?
Какая масса угля вступает в реакцию уравнение которой C + O2 = CO2 + 420 кДж, если при этом выделяется 1608 кДж теплоты?
Помогите плиз Термохимическое уравнение реакции горения сероводорода 2H2S + 3O2 = 2SO2 + 2H2O + 1166 кДж?
Помогите плиз Термохимическое уравнение реакции горения сероводорода 2H2S + 3O2 = 2SO2 + 2H2O + 1166 кДж.
При сгорании 11, 2л сероводорода выделяется теплоты : а 1023 кДж в 575 кДж с 1125 кДж д 291, 5 кДж е 893, 5 кДж.
По термохимическому уравнению реакции : С + О2 равно СО2 + 402 кДЖ вычислите массу сгоревшего угля если выделилось 2412 кДж теплоты?
По термохимическому уравнению реакции : С + О2 равно СО2 + 402 кДЖ вычислите массу сгоревшего угля если выделилось 2412 кДж теплоты.
Исходя из уравнения реакции определить ΔН0 FeO + CO = Fe + CO2 ΔН0FeO = — 264?
Исходя из уравнения реакции определить ΔН0 FeO + CO = Fe + CO2 ΔН0FeO = — 264.
8 кДж / моль ; ΔН0СО2 = — 393, 5 кДж / моль ; ΔН0СО = — 110, 5 кДж / моль.
Какое количество теплоты выделится в результате реакции 2NO + O2 = 2NO2 ΔH = — 114, 5 кДж, если прореагировало 67, 2 л O2?
Какое количество теплоты выделится в результате реакции 2NO + O2 = 2NO2 ΔH = — 114, 5 кДж, если прореагировало 67, 2 л O2?
А) 114, 5 кДж б) 229 кДж в) 343, 5 кДж.
Тепловой эффект реакции горения бутадиена 2310 кДж?
Тепловой эффект реакции горения бутадиена 2310 кДж.
При сжигании 0, 2 моль бутадиена выделится теплоты :
При окислении 1 моль меди по уравнению 2Cu + O2 = 2CuO + 311 кДж выделится 1)188, 8 кДж 2)933 кДж 3)155, 5кДж 4)1888 кДж?
При окислении 1 моль меди по уравнению 2Cu + O2 = 2CuO + 311 кДж выделится 1)188, 8 кДж 2)933 кДж 3)155, 5кДж 4)1888 кДж.
Буду очень благодарен?
Буду очень благодарен!
Дано термохимическое уравнение : CuO + 2HCl = CuCl2 + H2O + 63, 3 кДж.
Согласно уравнению определите количество тепла, которое вы делится при обработке 200г оксида меди (2) соляной кислотой а) 120 кДж в) 130 кДж с) 140 кДж д) 158 кДж е) 160 кДж.
При горении 36 г углерода выделяется 1206 кДж теплоты?
При горении 36 г углерода выделяется 1206 кДж теплоты.
Укажите термохимическое уравнение реакции.
a)C + O2 = CO2 + 1206 кДж
b)C + O2 = CO2 + 402 кДж
c)C + O2 = CO2 + 201 кДж
d)C + O2 = CO2 + 804 кДж
e)C + O2 = CO2 + 603 кДж.
Вы зашли на страницу вопроса Укажите правильно написанное уравнение экзотермической реакции Выберите один ответ : 2HgO(т) = 2Hg(т) + O2(г) — 180 кДж С(т) + О2(г) = СО2(г) + 402 кДж 2HgO(т) → 2Hg(т) + O2(г) — 180 кДж С(т) + О2(г) ?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 10 — 11 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
CH₃ C₂H₅ | | H₃C — CH₂ — C — CH — CH₂ — CH₂ — CH₃ | CH₃ CH₃ C₂H₅ CH₃ | | | H₃C — CH — C — CH₂ — CH₂ — CH₂ — CH₂ — CH₂ — CH₃ | CH₃.
Au, т. К. стоит после водорода и считается не активным металлом.
Вища валентність дорівнює номеру групи, тобто 6, а нижча = 8 — № групи, тобто 8 — 6 = 2 Вищий оксид SeO3. H2Se — сполука з гідрогеном (селеноводень, або селенид Гідрогену).
1. Реакция серебряного зеркала HCOH + Ag2O = 2Ag + HCOOH 2. Окислением метаналя окислителями HCOH + Окислитель (O2, KMnO4 и тп. ) = HCOOH 3. Реакция с медным гидроксидом HCOH + 2Cu(OH)2 = 2H2O + Cu2O + HCOOH.
CO + NaOH — > HCOONa HCOONa + H2SO4 — > HCOOH + NaHSO4 — > отгонка HCOOH.
Прозрачный, бесцветеный, при охлаждении сжимается, при нагревании расширяется, и забыла бесвкусный.
Вот! Да здравствует Логика.
Li 2e 1e Na 2e 8e 1e P 2e 8e 5e Fe 2e 8e 8e 8e.
2, 3 — дибромбутан H³С — СНBr — CHBr — CH³ 3 — етил — 2, 3, 5 — триметилоктан. H³C — CН(CH3) — C(СН3)(C2H5) — CН2 — CН(СН3) — CH2 — CH2 — CH³.
Укажите правильно написанное уравнение экзотермической реакции
Вопрос по химии:
Укажите правильно написанное уравнение экзотермической реакции
Выберите один ответ:
2HgO(т) = 2Hg(т) + O2(г) — 180 кДж
С(т) + О2(г) = СО2(г) + 402 кДж
2HgO(т) → 2Hg(т) + O2(г) — 180 кДж
С(т) + О2(г) → СО2(г) + 402 кДж
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
2 и 4 то же самое.
Все равно, что 2, что 4.
Оба правильны.
Только там вроде энергии выделяется 402,24 кДж.
Наверное, автор поленился дописать.
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Тестовые задания. 2.2.1 Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы
2.2.1 Величины, пропорциональные массе (или количеству вещества) рассматриваемого рабочего тела или термодинамической системы, называются…
2.2.2 Величины, которые не зависят от массы термодинамической системы, называются…
2.2.3 Значение стандартных энергий Гиббса можно определить по уравнению 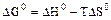
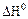
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия.
2.2.4 Значение стандартных энергий Гиббса можно определить по уравнению 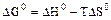
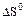
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия.
2.2.5 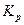
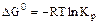
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия;
г) универсальная газовая постоянная.
2.2.6 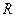
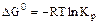
а) стандартное значение энтальпии;
б) стандартное значение энтропии;
в) термодинамическая константа равновесия;
г) универсальная газовая постоянная.
2.2.7 Порядок и знак величины 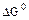
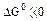
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 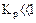
в) существует равновесие.
2.2.8 Порядок и знак величины 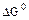
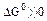
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 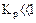
в) существует равновесие.
2.2.9 Порядок и знак величины 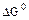
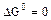
а) равенство сдвинуто вправо, выход продукта велик, константа равновесия имеет большое значение;
б) равенство сдвинуто влево, выход продукта мал, 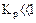
в) существует равновесие;
2.2.10 Значение 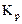
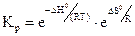
Укажите условия протекания экзотермической реакции:
а) 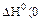
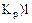
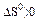
б) 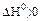
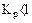
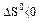
в) 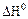
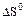
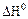
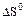
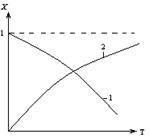
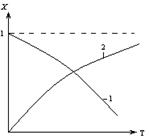
2.2.11 На рисунке представлена зависимость равновесной степени превращения от температуры.
Кривая 1 – это для…
а) экзотермических реакций;
б) эндотермических реакций.
2.2.12 На рисунке представлена зависимость равновесной степени превращения от температуры.
Кривая 2 – это для…
а) экзотермических реакций;
б) эндотермических реакций.
2.2.13 Для определения термодинамической константы равновесия пользуются приближенным уравнением 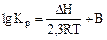
Для экзотермической реакции при повышении температуры 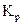
в) остается неизменной.
2.2.14 Для определения термодинамической константы равновесия пользуются приближенным уравнением 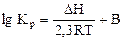
Для эндотермической реакции при повышении температуры 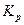
в) остается неизменной.
2.2.15 Для экзотермической реакции с повышением температуры равновесная степень превращения …
в) остается неизменной.
2.2.16 Для эндотермической реакции с повышением температуры равновесная степень превращения…
в) остается неизменной.
2.2.17 Для смещения равновесия слева направо для реакции 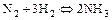
в) изменение давления не влияет на равновесие реакции.
2.2.18 Для смещения равновесия слева направо для реакции
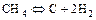
в) изменение давления не влияет на равновесие реакции.
2.2.19 Для смещения равновесия слева направо для реакции
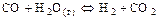
в) изменение давления не влияет на равновесие реакции.
2.2.20 При увеличении концентрации исходных реагентов равновесие смещается в сторону…
а) исходных реагентов;
б) целевых продуктов;
в) увеличение концентрации реагентов не влияет на равновесие.
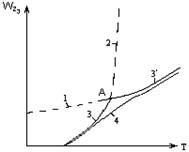 |
Рисунок 2.1 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.21 На рисунке 2.1 кривая 1 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.22 На рисунке 2.1 кривая 2 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.23 На рисунке 2.1 кривая 3 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
2.2.24 На рисунке 2.1 кривая 4 – это…
а) скорость диффузии;
б) скорость химической реакции;
в) общая скорость процесса, теоретическая;
г) общая скорость процесса, установленная экспериментально.
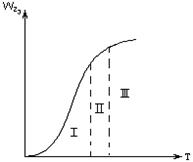 |
Рисунок 2.2 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.25 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.26 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.27 На рисунке 2.2 
а) кинетическая область;
б) переходная область;
 |
в) диффузионная область.
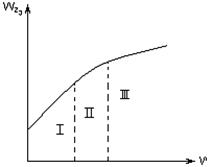
Рисунок 2.3 – Зависимость общей скорости гетерогенного
процесса от линейной скорости газового потока
2.2.28 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.29 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.30 На рисунке 2.3 
а) кинетическая область;
б) переходная область;
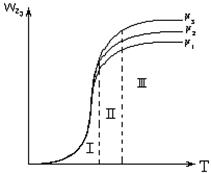 |
в) диффузионная область.
Рисунок 2.4 – Зависимость общей скорости
гетерогенного процесса от температуры
2.2.31 На рисунке 2.4 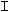
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.32 На рисунке 2.4 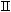
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.33 На рисунке 2.4 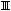
а) кинетическая область;
б) переходная область;
в) диффузионная область.
2.2.34 Скорость гетерогенного процесса можно определить по уравнению 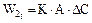
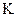
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.35 Скорость гетерогенного процесса можно определить по уравнению 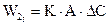
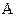
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.36 Скорость гетерогенного процесса можно определить по уравнению 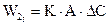
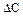
а) коэффициент скорости процесса;
б) поверхность контакта фаз;
в) движущая сила процесса.
2.2.37 Для гетерогенного процесса 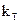
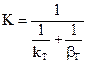
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.38 Для гетерогенного процесса 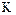
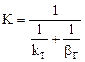
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.39 Для гетерогенного процесса 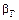
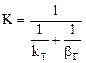
а) коэффициент скорости процесса;
б) коэффициент скорости массоотдачи в газовой фазе, отнесенной к единице поверхности;
в) константа скорости реакции.
2.2.40 Для гетерогенного процесса 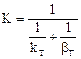
Если 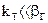
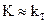
а) в кинетической области;
б) в переходной области;
в) в диффузионной области.
2.2.41 Для гетерогенного процесса 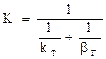
Если 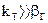
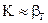
Следовательно, процесс протекает…
а) в кинетической области;
б) в переходной области;
в) в диффузионной области.
2.2.42 Для повышения скорости гетерогенного процесса, протекающего в диффузионной области ( 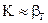
а) увеличивать скорость газового потока, усиливать его турбулизацию;
б) повышать температуру;
в) повышать температуру и применять катализатор.
2.2.43 Для повышения скорости гетерогенного процесса, протекающего в кинетической области ( 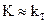
а) увеличивать скорость газового потока, усиливать его турбулизацию;
б) повышать температуру;
в) повышать температуру и применять катализатор.
2.2.44 Для реакции 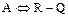
а) целевого продукта;
б) исходного реагента;
в) не изменяется.
2.2.45 Для реакции 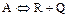
а) целевого продукта;
б) исходного реагента;
в) не изменяется.
Ответы к тестовым заданиям
| Номер вопроса | |||||||||||||||
| 2.2 | а | б | а | б | в | г | а | б | в | а | а | б | б | а | б |
| Номер вопроса | |||||||||||||||
| 2.2 | а | а | б | в | б | а | б | в | г | а | б | в | в | б | а |
| Номер вопроса | |||||||||||||||
| 2.2 | а | б | в | а | б | в | в | а | б | а | в | а | в | а | б |
Дата добавления: 2015-06-22 ; просмотров: 1025 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://online-otvet.ru/himia/5cea879796f4e19a292403e9
http://helpiks.org/3-94272.html