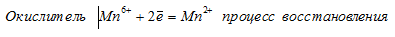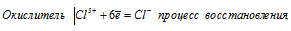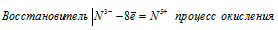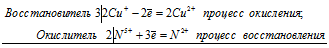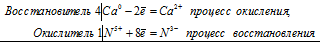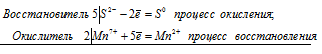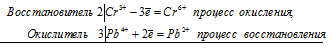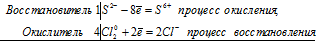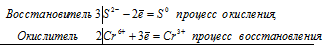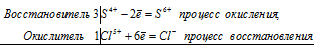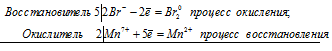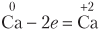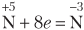Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dea4818d9b10c31 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Методы составления уравнений окислительно-восстановительных реакций
Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
Материал по теме «Окислительно-восстановительные реакции» (теория+тест)
Цель применения данного материала на уроке химии — познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов – окислительно-восстановительными реакциями, дать понятие “окислитель”, “восстановитель”, “окисление”, “восстановление”; охарактеризовать единство и неразрывность процессов окисления и восстановления; систематизировать знания о типах химических реакций, о степени окисления химических элементов.
Просмотр содержимого документа
« ⥮à¨ï»
Окислительно-восстановительными реакциями (ОВР) называются реакции, протекающие с изменением степени окисления атомов элементов. В результате этих реакций одни атомы отдают электроны, а другие их принимают.
Восстановитель — атом, ион, молекула или ФЕ, отдающий электроны, окислитель — атом, ион, молекула или ФЕ, принимающий электроны:
Процесс отдачи электронов называется окислением , а процесс принятия — восстановлением . В ОВР обязательно должны быть вещество восстановитель и вещество окислитель. Нет процесса окисления без процесса восстановления и нет процесса восстановления без процесса окисления.
Восстановитель отдает электроны и окисляется, а окислитель принимает электроны и восстанавливается
Процесс восстановления сопровождается понижением степени окисления атомов, а процесс окисления — повышением степени окисления атомов элементов. Сказанное удобно проиллюстрировать схемой (СО — степень окисления):
Конкретные примеры процессов окисления и восстановления (схемы электронного баланса) приведены в таблице:
Примеры схем электронного баланса
Схема электронного баланса
Атом кальция отдает электроны, повышает степень окисления, является восстановителем
Ион Cr +2 отдает электроны, повышает степень окисления, является восстановителем
Молекула хлора отдает электроны, атомы хлора повышают степень окисления от 0 до +1, хлор — восстановитель
Атом углерода принимает электроны, понижает степень окисления, является окислителем
Молекула кислорода принимает электроны, атомы кислорода понижают степень окисления от 0 до −2, молекула кислорода является окислителем
Ион 
Важнейшие восстановители : простые вещества металлы; водород; углерод в форме кокса; оксид углерода(II); соединения, содержащие атомы в низшей степени окисления (гидриды металлов КН, NaH , сульфиды H2S, иодиды KI, аммиак NH3); самый сильный восстановитель — электрический ток на катоде.
Важнейшие окислители : простые вещества — галогены, кислород, озон; концентрированная серная кислота; азотная кислота; ряд солей (KClO 3 , KMnO 4 , K 2 Cr 2 O 7 ); пероксид водорода H 2 O 2 ; наиболее сильный окислитель — электрический ток на аноде.
Просмотр содержимого документа
« â¥á⮢ ï à ¡®â »
1.Укажите электронные уравнения процессов восстановления:
4) 2S −1 − 10 e — = 2S +4 .
2.Отметьте электронные уравнения процессов окисления:
3.Укажите электронные уравнения, в которых атомы водорода или азота выполняют роль восстановителя:
4.Отметьте электронные уравнения, в которых атомы серы являются окислителями:
3) 2S −1 − 10 e — = 2S +4 ;
5.Укажите схему реакции, в которой степень окисления атома серы изменяется от −1 до +4:
4) KHS + HCl → KCl + H 2 S.
6.Отметьте схемы реакций, в которых степень окисления атома азота изменяется от −3 до 0:
7.Укажите схемы реакций, в которых степень окисления атома углерода повышается:
4) CO 2 + Mg → MgO + C.
8.Отметьте схемы реакций, в которых степень окисления атома хлора понижается:
9.Молекула кислорода в окислительно-восстановительных реакциях может максимально присоединить . электронов (-а):
10.Укажите формулу молекулы, которая в окислительно-восстановительной реакции может максимально отдать 10 электронов:
11.Укажите максимальное число электронов, которые может отдать молекула хлора в окислительно-восстановительных реакциях:
12.Укажите формулы молекул, которые в окислительно-восстановительных реакциях могут максимально присоединить два электрона:
13.Отметьте схемы процессов окисления:
14.Сера — окислитель, реагируя:
15.Фосфор — восстановитель, реагируя:
16.Окислительные свойства атомов галогенов увеличиваются слева направо в ряду:
17.Только восстановительные свойства в окислительно-восстановительных реакциях проявляют:
18.Самым сильным окислителем из простых веществ является:
19.Коэффициент 2 перед формулой SO 2 следует поставить в окислительно-восстановительной реакции, схема которой:
20.Окислительные свойства простых веществ слева направо возрастают в ряду:
1) углерод, сера, кислород;
2) кислород, сера, углерод;
3) кремний, фтор, иод;
4) фосфор, кислород, сера.
21.Коэффициент 4 перед формулой HNO 3 следует поставить в уравнениях окислительно-восстановительных реакций, схемы которых:
1) только окислитель;
2) только восстановитель;
3) окислитель и солеобразователь (этот термин означает, что вещество участвует в реакции образования соли);
4) восстановитель и солеобразователь.
23.В уравнении химической реакции 2KBr + Cl 2 = 2KCl + Br 2 атомы брома:
1) понижают степень окисления;
2) повышают степень окисления;
3) выступают в роли окислителя;
4) выступают в роли восстановителя.
24.Электронной схеме S −2 → S +4 соответствует уравнение химической реакции:
25.В процессе превращения S +6 → S −2 атомы серы:
1) отдают электроны, окисляются;
2) принимают электроны, окисляются;
3) отдают электроны, восстанавливаются;
4) принимают электроны, восстанавливаются.
26.Сущность превращения PbS → PbSO 4 отражается электронным уравнением:
27.Сущность химического превращения Cl 2 + KOH → KCl + KClO 3 + H 2 O отражают электронные уравнения реакций:
1) Cl 0 + e — = Cl −1 ; Cl 0 − 3 e — = Cl +3 ;
2) Cl 0 + e — = Cl −1 ; Cl 0 − 7 e — = Cl +7 ;
3) Cl 0 + e — = Cl −1 ; Cl 0 − 5 e — = Cl +5 ;
4) Cl 0 − e — = Cl −1 ; Cl 0 + 5 e — = Cl +5 .
28.Процесс восстановления имеет место:
1) когда нейтральные атомы превращаются в катионы;
2) нейтральные атомы превращаются в анионы;
3) положительный заряд простого иона возрастает;
4) положительный заряд простого иона уменьшается.
29.При окислении степень окисления атома элемента:
3) остается без изменения;
4) может как повышаться, так и понижаться.
30.При восстановлении степень окисления атома элемента:
3) остается без изменения;
4) может как повышаться, так и понижаться.
31.Процесс окисления имеет место:
1) когда нейтральные атомы превращаются в катионы;
2) нейтральные атомы превращаются в анионы;
3) положительный заряд простого иона уменьшается;
4) положительный заряд простого иона возрастает.
32.Укажите схемы реакций, в которых вода является окислителем:
33.Укажите уравнение реакции, в результате которой степень окисления атомов азота понижается с 0 до −2:
34.Отметьте схемы или уравнения, в которых пероксид водорода является восстановителем:
36.Окислительно-восстановительная реакция НЕ может протекать:
37.Свойства как окислителя, так и восстановителя в окислительно-восстановительных реакциях с другими веществами проявляют:
38.Только окислительные свойства в окислительно-восстановительных реакциях с другими веществами проявляют:
39.За счет атома азота только восстановительные свойства в окислительно-восстановительных реакциях с другими веществами проявляет:
40.Двойственные окислительно-восстановительные свойства могут проявлять:
41.Укажите схемы реакций, в которых водород — восстановитель:
42.Отметьте схемы реакций, в которых углерод — окислитель:
43.НЕВОЗМОЖНА окислительно-восстановительная реакция:
1) между KOH и HCl;
44.В реакции, схема которой HBr + KH → KBr + H 2 , бромоводородная кислота играет роль:
1) только восстановителя;
2) только окислителя;
3) восстановителя и солеобразователя;
4) окислителя и солеобразователя.
46.Переход NO → N 2 можно осуществить с помощью:
47.Переход HBr → Br 2 можно осуществить с помощью:
48.Найдите химическое количество (моль) азотной кислоты, расходуемой на солеобразование в реакции с участием 4 моль Ag, схема которой Ag + HNO 3 → AgNO 3 + NO + H 2 O :
49.Какая масса (г) азотной кислоты расходуется на солеобразование в реакции с участием 0,111 моль Fe, схема которой Fe + HNO 3 → Fe(NO 3 ) 2 + NH 4 NO 3 + H 2 O:
50.Отметьте схемы реакций, в которых роль окислителя и восстановителя выполняют атомы одного и того же элемента:
51.Укажите алгебраическую сумму степеней окисления атомов элемента окислителя до и после реакции (в восстановленной форме), протекающей по схеме Zn + H 2 SO 4 → ZnSO 4 + H 2 S + H 2 O:
52.Для окислительно-восстановительной реакции, протекающей по схеме Sn + HNO 3 → Sn ( NO 3 ) 2 + NH 4 NO 3 + H 2 O , укажите степени окисления атома элемента окислителя соответственно до и после реакции (в восстановленной форме):
53.Выберите ряд, в котором указаны символы элементов, атомы которых окисляются в реакции, протекающей по схеме
54.Какое количество (моль) электронов перейдет от атомов кислорода к атомам хлора при разложении бертолетовой соли массой 12,25 г по схеме KClO 3 → KCl + O 2 ?
http://buzani.ru/zadachi/khimiya-shimanovich/935-okislitelno-vosstanovitelnye-reaktsii-zadaniya-226-230
http://multiurok.ru/index.php/files/matierial-po-tiemie-okislitiel-no-vosstanovitiel-n.html