Изотерма поверхностного натяжения. Уравнение Шишковского.
Изотерма поверхностного натяжения.Уравнение
Шишковского
Зависимость поверхностного натяжения растворов ПАВ от их концентрации выражается при каждой данной постоянной температуре изотермами. Общий вид такой изотермы показан на рис. 1.1. Изотерма поверхностного натяжения выходит из точки s0 на оси ординат, которая отвечает поверхностному натяжению чистого растворителя. С повышением концентрации ПАВ поверхностное натяжение плавно снижается, стремясь к некоторому минимальному постоянному значению, характерному для каждого данного ПАВ.
 |
Изотермы поверхностного натяжения могут быть описаны с помощью уравнения Б. Шишковского (1908):

где s — поверхностное натяжение раствора ПАВ; Ds — понижение поверхностного натяжения раствора ПАВ с концентрацией С по сравнению с s0 — поверхностным натяжением растворителя (например, воды) при данной температуре; а и b — константы. Константа а характерна для каждого гомологического ряда; коэффициент b индивидуален для каждого отдельного ПАВ.
64. Мицеллообразование в растворах ПАВ. Критическая концентрация мицелообразования в растворах (ККМ1 И ККМ2). Методы определения ККМ.
Мицеллообразующие ПАВпри малых концентрациях существуют в растворах в виде отдельных молекул или ионов. При увеличении концентрации раствора их молекулы (ионы) ассоциируют друг с другом, образуя вначале димеры, тримеры и другие ассоциаты. После превышения некоторой, характерной для каждого данного ПАВ, концентрации, называемой критической концентрацией мицеллообразования(ККМ), МПАВ существуют в растворе в виде особого рода образований, называемых мицеллами. Для большинства ПАВ ККМ лежит в пределах 10 -5 ¸ 10 -2 моль/л.
Под мицеллой ПАВ понимают агрегат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю, а лиофобные соединяются друг с другом, образуя ядро мицеллы. Процесс мицеллообразования обратим, так как при разбавлении раствора мицеллы распадаются на молекулы и ионы.
В водных растворах при концентрациях, ненамного превышающих ККМ, образуются сферические мицеллы («мицеллы Гартли»). Внутренняя часть мицелл Гартли состоит из переплетающихся углеводородных радикалов, а полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл приблизительно равен удвоенной длине молекул ПАВ. Число молекул в мицелле (степень агрегации) растёт до какого-то предела (обычно 30 — 100 молекул), после чего с дальнейшим ростом концентрации не изменяется, но число мицелл увеличивается.
При более высоких концентрациях мицеллы Гартли взаимодействуют друг с другом, что приводит к их деформации. Они могут принимать цилиндрическую, дискообразную, палочкообразную, пластинчатую форму (“мицеллы Мак-Бена”). При концентрациях примерно в 10 — 50 раз больше ККМ (т. н. ККМ2) мицеллы приобретают цепочечную ориентацию и вместе с молекулами растворителя способны образовывать студнеообразное тело. При добавлении к таким концентрированным мицеллярным растворам ПАВ нейтральных солей — NaCl, КCl, NH4NO3 и т. п., — соли отнимают у мицелл воду, входящую в гидратную оболочку (дегидратируют мицеллы), и облегчают объединение мицелл. При этом ПАВ в зависимости от плотности выпадает в осадок или всплывает на поверхность. Такое выделение ПАВ из мицеллярных растворов называется высаливанием.
Методы определения ККМ основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ в зависимости от концентрации (например, поверхностного натяжения а, мутности т, эквивалентной электропроводности К, осмотического давления я, показателя преломления п). На кривой зависимости свойство — состав в области ККМ обычно появляется излом. Одна из ветвей кривых (при более низких концентрациях) описывает свойства системы в молекулярном состоянии, а другая — в коллоидном. Абсциссу точки излома условно считают соответствующей переходу молекул в мицеллы, т. е. критической концентрации.
Кондуктометрический метод применяется для определения ККМ ионогенных ПАВ.
Другой метод определения ККМ основан на измерении поверхностного натяжения водных растворов ПАВ, которое резко уменьшается с ростом концентрации вплоть до ККМ, а затем остается постоянным. Этот метод применим как для ионогенных, так и для неионогенных ПАВ, однако при наличии примесей точку излома на кривой о—с установить трудно.
Связь уравнений Гиббса, Ленгмюра и Шишковского
А и b – эмпирические константы.
(На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию. Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата).
Основы термодинамики адсорбции были созданы Дж.Гиббсом в 70-е гг. XIX в. По Гиббсу, в равновесной двухфазной системе вблизи поверхности раздела фаз происходит некоторое изменение локальных значений всех экстенсивных свойств (кроме объема). Однако фазы считаются однородными вплоть до некоторой геометрической поверхности, разделяющей их. Поэтому значение какого-либо экстенсивного свойства для системы в целом 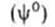



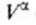

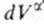

Изложенные представления позволяют привести фундаментальное термодинамическое уравнение к виду:
где G-гиббсова свободная энергия, S-энтропия, 


Величина 
Положение разделяющей поверхности может быть выбрано произвольно. В частности, выбор этого положения может удовлетворять условию Г1=0. Такая поверхность называется эквимолекулярной. Для нее вводится обозначение Г2 = Г2 (1) . Отсюда следует основное адсорбционное уравнение Гиббса:
Если адсорбтив совершенно не растворим в одной из двух фаз, 
Связь уравнений Гиббса, Ленгмюра и Шишковского.
Зависимость поверхностного натяжения от концентрации (изотерма поверхностного натяжения) в широком интервале концентраций описывается уравнением Шишковского:
σ = σ0 − b ln(1+ Ac) , (2.2)
где b и A – константы, характеризующие ПАВ, причем b является константой для всего гомологического ряда, а A — константа, характерная для данного вещества и возрастающая примерно в три раза при удлинении углеводородного радикала молекулы ПАВ на одну СН2 группу. Снижение поверхностного натяжения обусловлено адсорбцией ПАВ на поверхности раздела раствор/воздух. Адсорбцией называется процесс самопроизвольного концентрирования растворённого вещества в поверхностном слое. Универсальным термодинамическим соотношением, описывающим адсорбцию, является уравнение Гиббса:

Совместное решение уравнений (2.2) и (2.3) приводит к уравнению:

которое при условии 

Зависимость поверхностного натяжения от концентрации ПАВ. Уравнения Шишковского
Уравнение Гиббса дает возможность вычислить зависимость поверхностного натяжения от концентрации раствора, если известна изотерма адсорбции.
Для малых концентраций адсорбата адсорбция должна подчиняться закону Генри.
Поверхностное натяжение раствора можно вычислить по уравнению:
sо – поверхностное натяжение чистого растворителя;
s – поверхностное натяжение раствора с концентрацией с;
R – газовая постоянная;
Т – температура, К;
КГ – константа адсорбционного равновесия (константа Генри), зависящая от природы веществ и температуры.
Уравнение называется 1-м уравнением Шишковского.
В области зависимости адсорбции от концентрации растворенного вещества, отвечающей уравнению адсорбции Ленгмюра, можно записать:
или в интегральной форме
где Гm – предельная поверхностная концентрация адсорбата;
h = Гm·RT – константа, зависящая от температуры и природы веществ;
h и b– постоянные, причем константа h постоянна для всего гомологического ряда, тогда как константа b возрастает в 3–3,5 раза при переходе к каждому последующему гомологу.
Уравнение называется 2-м уравнением Шишковского.
Этим уравнением пользуются для расчета поверхностного натяжения в растворах и расплавах, если известна изотерма адсорбции.
Если bc > 1, то уравнение Шишковского можно привести к линейному виду:
Линейный график в координатах sо–s от lnc (рис. 3.4) позволяет определить константы уравнения Шишковского h и b , а затем рассчитать предельную адсорбцию Гm и размеры молекулы ПАВ.
Рис. 3.4. Графическое представление уравнения Шишковского вкоординатах линейной формы
Предельная величина адсорбции определяется по формуле:
где h – константа уравнения Шишковского, определяется графически;
R – газовая постоянная;
Т – температура опыта.
Площадь поперечного сечения ПАВ можно вычислить по формуле:
Осевая длина молекулы ПАВ(толщина адсорбционного слоя)
где r – плотность ПАВ, М – его молярная масса.
http://allrefrs.ru/1-18590.html
http://sdamzavas.net/3-17812.html






