Укажите уравнение нернста для хлоридсеребряного электрода
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl – представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
| Ag + + e – = Ag. |
Уравнение Нернста для этого процесса:
| (7.2) |
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag + связана с легко задаваемой в данной системе активностью ионов Cl – произведением растворимости хлорида серебра ПРAgCl:
 |
откуда
 |
Подставляя это выражение в (7.2)
 |
и обозначив
 |
получим уравнение Нернста для хлорсеребряного электрода:
|
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
 |
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl – – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и хлорсеребряного.
Укажите уравнение нернста для хлоридсеребряного электрода
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
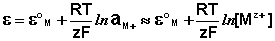
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
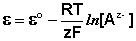
Для определения электродного потенциала элемента необходимо измерить ЭДС гальванического элемента, составленного из испытуемого электрода и электрода с точно известным потенциалом – электрода сравнения . В качестве примеров рассмотрим водородный, каломельный и хлорсеребряный электроды.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
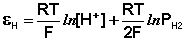
Каломельный электрод . Работа с водородным электродом довольно неудобна, поэтому в качестве электрода сравнения часто используется более простой в обращении каломельный электрод, величина электродного потенциала которого относительно стандартного водородного электрода точно известна и зависит только от температуры. Каломельный электрод состоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
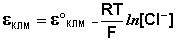
Хлорсеребряный электрод . В качестве электрода сравнения используют также другой электрод второго рода – хлорсеребряный, представляющий собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия. Хлорсеребряный электрод также обратим относительно анионов хлора:
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
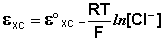
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод , относящийся к классу окислительно-восстановительных электродов (см. ниже), представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4О2·С6Н4(ОН)2 – соединения хинона С6Н4О2 и гидрохинона С6Н4(ОН)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
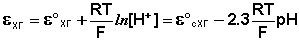
Стеклянный электрод , являющийся наиболее распространенным индикаторным электродом, относится к т.н. ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов; ионоселективные электроды могут быть обратимы как по катиону, так и по аниону.
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
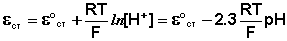
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
В отличие от описанных электродных процессов в случае окислительно-восстановительных электродов процессы получения и отдачи электронов атомами или ионами происходят не на поверхности электрода, а только в растворе электролита. Если опустить платиновый (или другой инертный) электрод в раствор, содержащий двух- и трехзарядные ионы железа и соединить этот электрод проводником с другим электродом, то возможно либо восстановление ионов Fe 3+ до Fe 2+ за счет электронов, полученных от платины, либо окисление ионов Fe 2+ до Fe 3+ с передачей электронов платине. Сама платина в электродном процессе не участвуют, являясь лишь переносчиком электронов. Такой электрод, состоящий из инертного проводника первого рода, помещенного в раствор электролита, содержащего один элемент в различных степенях окисления, называется окислительно-восстановительным или редокс-электродом . Потенциал окислительно-восстановительного электрода также определяют относительно стандартного водородного электрода:
Pt, H2 / 2H + // Fe 3+ , Fe 2+ / Pt
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
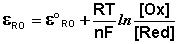
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
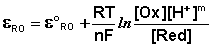
При составлении гальванических элементов с участием редокс-электрода электродная реакции на последнем в зависимости от природы второго электрода может быть либо окислительной, либо восстановительной. Например, если составить гальванический элемент из электрода Pt / Fe 3+ , Fe 2+ и второго электрода, имеющего более положительный электродный потенциал, то при работе элемента редокс-электрод будет являться анодом, т.е. на нем будет протекать процесс окисления:
Если потенциал второго электрода будет меньше, чем потенциал электрода Pt / Fe 3+ , Fe 2+ , то на последнем будет протекать реакция восстановления и он будет являться катодом:
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Copyright © С. И. Левченков, 1996 — 2005.
Обратимые электроды 2-го рода. Формула записи, электродная полуреакция. Хлоридсеребряный и каломельный электроды. Устройсто и применение в качестве электродов сравнения.
Электроды второго родасостоят из металла, покрытого слоем малорастворимого соединения этого металла, погружённого в раствор, содержащий анионы этого соединения. Малорастворимым соединением может быть какая-либо соль, а также оксид или гидроксид. Формула электрода 2-го рода в общем виде выглядит так:
а электродная реакция — МеAn + zе — Û Ме 0 + An z — .
Электроды 2-го рода обладают высокой стабильностью, которая позволяет поддерживать значение их электродного потенциала с высокой точностью в течение очень длительного времени. Поэтому они используются в лабораторных и промышленных электрохимических установках в качестве электродов сравнения.
Хлоридсеребряный электрод(ХСЭ) представляет собой серебряную проволоку, покрытую слоем хлорида серебра и помещённую в пробирку, заполненную раствором хлорида калия. Как правило, используется насыщенный раствор, так как в нём концентрация KCl, а следовательно, и ионов Cl — , от которых зависит потенциал электрода, самопроизвольно поддерживается постоянной при частичном испарении раствора или при колебаниях влажности воздуха. Для контакта с исследуемым раствором дно пробирки делается не сплошным, а в виде узкой оттянутой трубки (капилляра), обычно заполненной асбестом. Формула хлоридсеребряного электрода:
Ag½AgCl; Cl — (a),
электродная реакция, протекающая на нём:
АgCl + e — Û Аg 0 + Cl — .
Потенциал этого электрода с насыщенным раствором KCl (т. н. насыщенного хлоридсеребряного электрода) при 25 о С равен +0,222 В.
Ещё одним электродом сравнения является каломельный электрод. Он представляет собой пробирку, на дне которой находится металлическая ртуть. На поверхность ртути помещается слой пасты, состоящей из тонко измельченной каломели Hg2Cl2, смешанной с металлической ртутью и с хлоридом калия. Поверх каломельной пасты наливается раствор хлорида калия. Для осуществления электрического контакта используется платиновая проволока, изолированная от каломельной пасты и от раствора хлорида калия. Обычно она впаивается в дно пробирки. Для контакта раствора хлорида калия с исследуемым раствором к пробирке припаивается тонкая стеклянная трубка с оттянутым кончиком, которая тоже заполнятся раствором KCl (“капилляр Луггина”). Формула каломельного электрода:
или с отображением платинового ввода
протекающая на нём электродная полуреакция:
Hg o + Cl — (a) Û 1/2 Hg2Cl2 + e — ,
Каломельные электроды применяются в основном в трёх различных вариантах: с насыщенным (“насыщенный каломельный электрод”, НКЭ), нормальным и децинормальным растворами KCl в качестве электролита. Потенциалы этих электродов измерены с большой точностью. При T = 25 о С они равны:
1н. KCl + 0.2812 В,
0,1н. KCl + 0.3341 В.
Из всех электродов сравнения наиболее стабильное значение потенциала позволяет получить именно каломельный электрод. Его потенциал может сохраняться неизменным в течение многих лет. Поэтому каломельные электроды, в особенности НКЭ, применяются для высокоточных (прецизионных) измерений.
Ионоселективные электроды. Стеклянный электрод(устройство и применение). Принципиальное устройство рН-метра. Потенциометрическое определение рН.
Основной частью лабораторного рН-метраявляется датчик, состоящий из индикаторного (измерительного) электрода, опущенного в исследуемый раствор, и электрода сравнения (чаще всего хлоридсеребряного). Если в качестве измерительного электрода используется водородный электрод, то датчик представляет собой гальванический элемент, рассмотренный в п. 10.3:
(-) Pt | H2 (p); H + (a) || Cl — (a); AgCl |Ag (+).
Электродвижущая сила этого элемента, если пренебречь контактным и диффузионным потенциалами, равна разности между потенциалами хлоридсеребряного ЕХСЭ и водородного ЕН + /Н2 электродов:
Е = ЕХСЭ — ЕН + /Н2
В соответствии с уравнением Нернста потенциал водородного электрода будет равен (при 25 о С):
или, так как рН = -lg aH +
ЕН + /Н2 = — 0,0591 рН.
Е = ЕХСЭ + 0,0591 рН
| Е — ЕХСЭ рН = ¾¾¾¾¾ (11.1) 0,0591 |
Как уже было отмечено, потенциал хлоридсеребряного электрода в насыщенном растворе KCl при 25 о С равен + 0,222 В.
Значит, Е = + 0,222 — (-0,0591 рН), откуда получаем
| Е — 0,222 рН = ¾¾¾¾¾ (11.2) 0,0591 |
То есть, измеряя ЭДС рассмотренного гальванического элемента, можно вычислить рН раствора, контактирующего с водородным электродом. В том случае, если вместо хлоридсеребряного электрода используется насыщенный каломельный электрод (НКЭ), потенциал которого равен + 0,2415 В, расчёт рН ведется по уравнению:
| Е — 0,2415 рН = ¾¾¾¾¾ 0,0591 |
Использование водородного электрода по указанным выше причинам в обычной лаборатории, в том числе и в аптеке, неудобно, поэтому в лабораторных рН-метрах в качестве индикаторного электрода применяют стеклянный электрод.
Стеклянный электродсостоит из специального сосуда, в котором находится хлоридсеребряный электрод, погруженный в раствор HCl с определённой концентрацией. Дно сосуда, имеющее форму тонкостенного шарика, представляет собой мембрану из специального стекла, содержащего ионы лёгких щелочных металлов (лития или натрия), способные обмениваться с находящимися в растворе ионами водорода. Стеклянный шарик электрода погружается в исследуемый раствор, с которым при помощи электролитического мостика соединяется хлоридсеребряный электрод сравнения. Получается гальванический элемент с формулой.
Ag | AgCl ; Cl — , H + | стеклянная мембрана | исследуемый р-р || ХСЭ.
Экспериментально найдено, что потенциал стеклянного электрода изменяется с изменением активности водородных ионов таким же образом, как и потенциал водородного электрода, то есть на 0,0591 В на единицу рН при 25 о С. Таким образом, стеклянный электрод является заменителем водородного электрода. Поэтому значение рН исследуемого раствора при измерениях с помощью рН-метра, в котором установлен стеклянный электрод, может быть вычислено с помощью уравнений (11.1) или (11.2).
Измерение ЭДС и пересчёт её в единицы рН осуществляется высокочувствительным вольтметром (потенциометром). Для измерения ЭДС и рН нельзя пользоваться обычным вольтметром. Для этого необходимо применять прибор с большим входным сопротивлением, в результате чего через прибор протекает настолько малый ток, что измеряемая величина представляет собой не напряжение на электродах, а электродвижущую силу элемента. Разработаны электронные схемы и на их основе сконструированы достаточно компактные приборы, которые позволяют измерять значение рН с точностью до ±0,001 единицы рН. Однако для практических целей достаточна точность ±0,01 единицы рН, которую дают обычные лабораторные приборы. Перед измерением рН стеклянный электрод обязательно калибруется по буферным растворам с известными значениями рН.
Стеклянный электрод получил наиболее широкое распространение среди различных электродов, применяемых для определения рН растворов. На него не действуют окислители и восстановители, он с трудом подвергается отравлению. Однако длительное пребывание в сильнощелочных средах, в которых происходит растворение стекла, может вывести его из строя.
Состав стекла, из которого изготавливается шарик, подбирается таким образом, что из всех ионов, имеющихся в растворе, в ионном обмене на поверхности стекла участвуют только ионы Н + . Поэтому стеклянный электрод является примером ионоселективного электрода, потенциал которого зависит только от концентрации ионов водорода в исследуемом растворе. Присутствие других ионов на его потенциал не влияет.
В лабораториях, в том числе при исследованиях по аналитической и фармацевтической химии, фармакологии и др., применяются и другие ионоселективные электроды, которые в составе специальных приборов (иономеров) позволяют быстро измерять активности отдельных ионов и соответствующие им величины, например, рNa, pCl, pCO2 и др., а также коэффициенты активности ионов.
http://physchem.chimfak.sfedu.ru/Source/PCC/Solutions_6.htm
http://lektsia.com/7x9b32.html


