Вывод уравнения состояния двухмерного газа. Уравнение Фрумкина для реального двухмерного газа.
π- поверхность давления в пленке, π= σ0— σ=КС→d π=-d σ=KdC

Адсорбция на границе твердое тело-газ. Теория мономолекулярной адсорбции Ленгмюра. Вывод и анализ уравнения изотермы мономолекулярной адсорбции Ленгмюра.
Адсорбция на границе газ-тв тело- простейший вид адсорбции. А-f(T,P,Sуд). Газ при адсорбции может передвигаться только в 2-х измерениях и адсорбция сопровождается ↓ энтропии.ΔF↓ 0 адсорбционный комплекс(А).

1 2 3 1: А=АмахКР 2: А=(АмахКР)/(1+КР) 3: А=Амах
У-ние Ленгмюра описывает все 3 участка изотермы адсорбции
Линейная форма уравнения Ленгмюра. Нахождение констант уравнения Ленгмюра графическим методом. Определение удельной поверхности адсорбента.
Физический смысл const у-ния Ленгмюра. Амах- емкость монослоя, максимальная адсорбция, которая достигается при заполнении всех адсорбционных центров. К- const адсорбционного равновесия ( const скорости) К=qe Q / RT . Уравнение Ленгмюра является универсальным уравнением, тк оно описывает все 3 участка и его const имеют физический смысл, в отличие от уравнения Ьедевера-Фрейдлина( lgA=lgβ+1/nlgC).

Р/А 1/А=(1+КР)/(АмахКР) *Р
Адсорбция как обратимый экзотермический процесс. Интегральная и дифференци-альная теплота адсорбции.

СВОБОДНОГО ДВУХМЕРНОГО ГАЗА?
Нерелятивистский двухмерный газ бозонов состоит из N частиц массой m, находящихся на площади S, и занимающих нижнюю зону размерного квантования. Используем



Получаем не зависящую от энергии плотность состояний
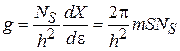
и число частиц газа
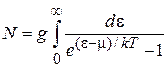
При изменении температуры число частиц сохраняется, тогда от температуры не зависит

Следовательно, при уменьшении температуры уменьшается модуль химического потенциала газа. Достижимо ли значение 

В отличие от трехмерного случая, интеграл (П.13.5) при 


где 

Получим зависимость 

При 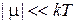


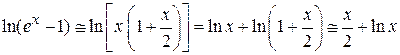


Следовательно, химический потенциал при любом числе частиц стремится к нулю только при 
ДВУХМЕРНЫЙ БОЗЕ-ГАЗ
В ПОТЕНЦИАЛЬНОЙ ЛОВУШКЕ
Двухмерный бозонный газ с числом частиц N удерживается ловушкой с потенциальной энергией
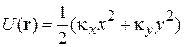
Найдем температуру порога конденсации TC.
Для газа в параболической ловушке плотность состояний (П.8.2б)




При 


при 


В 2D-системе с пространственным ограничением бозе-конденсация происходит при конечной температуре.
РЕЙТИНГОВАЯ АТТЕСТАЦИЯ ПО ДИСЦИПЛИНЕ
Итоговое число баллов складывается из баллов, получаемых за каждый вид деятельности.
| № | Вид деятельности | Число баллов |
| 1. 2. 3. 4. | Активность на занятиях (выставляется в конце 6-ой, 12-ой и 18-ой недели) Индивидуальное задание 1 Индивидуальное задание 2 Индивидуальное задание 3 | (0–3) + (0–3) + (0–3)= 0–9 9–11 9–11 9–11 |
| 5. | Коллоквиум | Всего не более 40 |
| 6. | Экзамен: постановка задачи и качественный анализ результата + количественное обоснование результата + дополнительные вопросы по теме билета | Всего не более 60 0–20 0–10 0–10 |
Всего не более 100
МЕЖДУНАРОДНАЯ И РОССИЙСКАЯ ОЦЕНКИ
| Число баллов | Оценка | ||
| международная | российская | ||
| 90–100 | 97–100 93–96 90–92 | A+ A A– | отл. |
| 80–89 | 87–89 84–86 82–83 80–81 | B+ B B– C+ | хор. |
| 70–79 60–69 50–59 | 75–79 70–74 66–69 63–65 60–62 50–59 | C C– D+ D D– E | удовл. |
| 0–49 | 25–49 0–24 | FX F | неуд. |
Коллоквиум
1. Эрмитовые операторы, собственные функции и собственные значения. Условия ортонормированности для дискретного и непрерывного спектров. Операторы координаты и импульса. Соотношение неопределенностей.
2. Плотность вероятности. Плотность тока вероятности. Уравнение непрерывности. Пример: плоская волна.
3. Уравнение Шредингера для стационарного и нестационарного состояния. Пример – частица в потенциальной яме.
4. Спин электрона. Операторы, собственные функции, собственные значения. Принцип Паули и его обоснование.
5. Плотность квантовых состояний. Пример – трехмерный газ.
6. Распределение Ферми по состояниям и по энергии. Электронный газ в металле и в полупроводнике. Химический потенциал.
7. Распределение Бозе по состояниям. Химический потенциал. Фононный газ. Характеристики фонона. Распределение по частоте. Частота и температура Дебая.
Экзамен
1. Уравнение Шредингера для стационарного и нестационарного состояния. Краевые условия для прямоугольных потенциалов.
2. Плотность вероятности, ток вероятности, уравнение непрерывности. Изменение физической величины с течением времени. Пример.
3. Квазиклассическое квантование ВКБ. Туннельный эффект.
4. Модель Кронига–Пенни. Получение и анализ дисперсионного соотношения. Разрешенные и запрещенные зоны.
5. Модель Кронига–Пенни. Анализ дисперсионного соотношения. Зона Бриллюэна. Эффективная масса.
6. Локализация Андерсона. Уровни Тамма.
7. Уравнение Шредингера в сферической и цилиндрической системах координат. Плоский и пространственный ротаторы.
8. Атом водорода.
9. Заряд в однородном магнитном поле. Уровни Ландау.
10. Теория возмущений стационарных состояний невырожденного спектра.
11. Теория возмущений, зависящих от времени. Периодические возмущения.
12. Уравнение Паули. Эффект Зеемана.
13. Плотность квантовых состояний. Примеры.
14. Каноническое распределение квантовой системы. Вычисление колебательной и вращательной частей внутренней энергии.
15. Большое каноническое распределение фермионов и бозонов.
16. Электронный газ в металле и полупроводнике. Химический потенциал.
17. Двумерный и одномерный электронный газ.
3.2.1. Модель монослоя
Основоположником мономолекулярной модели физической адсорбции был Ленгмюр. В соответствии с развитыми им представлениями адсорбционный слой состоит из локализованных на экспотенциальной поверхности не взаимодействующих друг с другом молекул (отсутствуют латеральные – боковые — взаимодействия).
При равновесном давлении Р и постоянной температуре T количествоадсорбированных молекул (на единице площади адсорбента) выражается числом молей n s или молекул N s в адсорбционном слое:
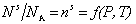
Такую зависимость называют изотермой адсорбции.
Часто адсорбцию выражают через эквивалентный для n s молей адсорбата объем при нормальных температуре и давлении V s (см 3 ). Поэтому изотерма адсорбции может быть выражена как
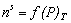
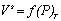
Для описания мономолекулярного при малых степенях заполнения адсорбционного слоя прибегают к модели двумерного газа, а при насыщении адсорбционного слоя считают его двумерной жидкостью. В таком случае для ненасыщенного слоя адсорбата полагается справедливым уравнение состояния двумерного газа
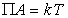
где 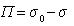
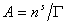
Записывая уравнение Гиббса
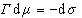
и вводя замену 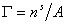
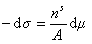
Введем степень заполнения адсорбционного слоя
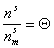
где 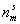
Домножая числитель и знаменатель правой части уравнения (1.3.8) на 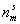
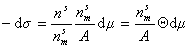
Химические потенциалы молекул в адсорбционном слое и в равновесной газовой фазе должны быть равны, поэтому
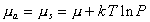
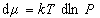
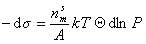
Интегрируя уравнение (1.3.12) при условии, что при P=0 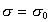
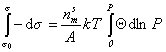
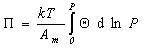
Уравнение состояния двумерного идеального газа (1.3.6) можем переписать в виде
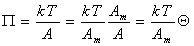
Дифференцируя и сопоставляя уравнения (1.3.14) и (1.3.15), получаем
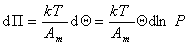
или 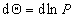
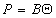
где B – постоянная. Уравнение (1.3.17) известно как уравнение Генри. Учет собственных размеров молекул адсорбата А0 в уравнении состояния двумерного газа проводится как
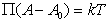
В общем случае уравнение состояния двумерного газа может быть записано в виде
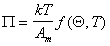
Использование описанного выше при выводе уравнения Генри подхода дает обобщенную функцию идеальной модельной изотермы, которая выражается уравнением Ленгмюра
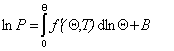
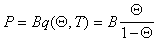
Учитывая уравнение (1.3.18), использование указанного выше подхода приводит к уравнению Фольмера
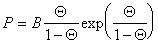
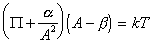
где a и b – постоянные, дает изотерму адсорбции, известную как уравнение Хилла-де-Бура
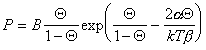
Приведенное выше уравнение (1.3.21) Ленгмюр вывел на основании рассмотрения динамического равновесия между адсорбционным слоем и объемом газовой фазы.
Из кинетической теории газов следует, что число молекул газа, сталкивающихся за единицу времени с единицей площади адсорбента (диффузионный поток), будет
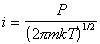
Учитывая, что адсорбция не может происходить, если молекула контактирует с уже занятым активным центром, из диффузионного потока будет захвачена адсорбентом лишь часть молекул j, остальные молекулы будут отражены. Если доля занятых активных центров будет Q, то скорость адсорбции можно выразить как
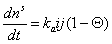
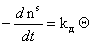
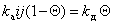
где kа и kд – постоянные скорости процессов адсорбции и десорбции.
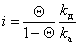
Подставляя в уравнение (1.3.29) выражение для i из (1.3.25), получаем
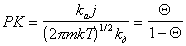
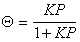

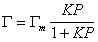
Сопоставление уравнений (1.3.30) и (1.3.21) показывает, что постоянная интегрирования обратна величине постоянной равновесия адсорбции, т.е. В = 1/K.
Уравнение Ленгмюра справедливо лишь для идеального локализованного монослоя, исключающего латеральные взаимодействия между молекулами, адсорбированными на соседних центрах.
Очевидно, что такое взаимодействие в реальных системах должно проявляться и статистико-термодинамическое рассмотрение приводит к уравнению Фаулера-Гугенгейма
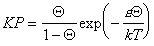
где e – энергия латерального взаимодействия.
Уравнение (1.3.33) дает изотермы, практически идентичные с уравнением (1.3.24) Хилла-де-Бура. Существуют определенные критические условия, при которых начинает проявляться латеральное взаимодействие, т.е. происходит двумерная конденсация и уравнение Ленгмюра становится неприменимым. В случае изотермы Фаулера-Гугенгейма критическим условиям соответствуют КР = 0,1353 и Q = 0,5; e/kT= 4.
Все приведенные выше изотермы адсорбции, основанные на мономолекулярной модели адсорбционного слоя предполагают экспотенциальность поверхности, которая считается однородной. В реальных системах поверхности неоднородны, особенно это проявляется у волокон полимерных материалов.
http://lektsii.org/12-63527.html
http://xumuk.ru/colloidchem/43.html

