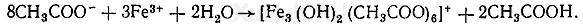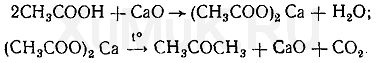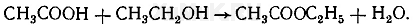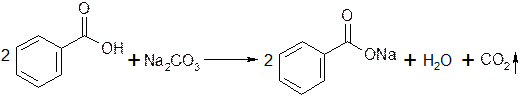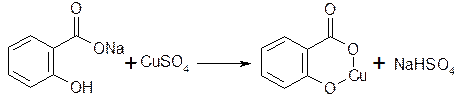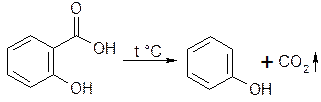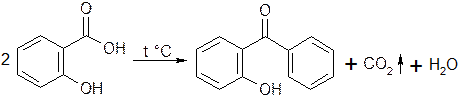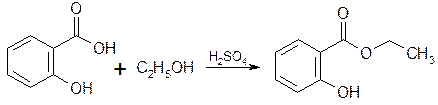§ 20. УКСУСНАЯ КИСЛОТА
Безводная (ледяная) уксусная кислота СН 3 СООН представляет собой бесцветную гигроскопическую жидкость или бесцветные кристаллы с резким запахом. Она смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Эта кислота перегоняется с водяным паром. Уксусную кислоту получают при брожении некоторых органических веществ и путем синтеза. Эта кислота содержится в продуктах сухой перегонки дерева. В небольших количествах уксусная кислота может содержаться в человеческом организме.
Применение. Действие на организм. Уксусная кислота применяется для синтеза красителей, получения ацетата целлюлозы, ацетона и многих других веществ. В виде уксуса и уксусной эссенции она применяется в пищевой промышленности и в быту для приготовления пищи. Отмечены случаи отравления уксусной кислотой (главным образом уксусной эссенцией), принятой внутрь. 10—20 г уксусной эссенции или 200—300 мл уксуса является смертельной дозой. Уксусная кислота оказывает действие на кровь и почки. При контакте с кожей ледяная уксусная кислота вызывает ожоги и образование пузырьков. После приема концентрированной уксусной кислоты или уксусной эссенции внутрь поражается верхняя часть пищевого канала, появляется кровавая рвота, понос, развивается гемолитическая анемия, гемогло-бинурия, анурия и уремия. При вдыхании паров уксусной кислоты происходит раздражение слизистых оболочек дыхательных путей, могут развиваться бронхопневмония, катаральный бронхит, воспаление глотки и г. д.
Уксусная кислота относится к веществам, изолируемым из объектов перегонкой с водяным паром. В отличие от других веществ этой группы уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 %-м раствором серной или фосфорной кислоты.
Перегонку уксусной кислоты производят до отрицательной реакции дистиллята на наличие этой кислоты. Ввиду ее летучести дистиллят собирают в сосуд, содержащий 0,1 н. раствор гидроксида натрия. В дистилляте ацетат-ионы определяют при помощи перечисленных ниже реакций.
Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
Выполнение реакции. 2—3 мл дистиллята вносят в пробирку и прибавляют 1 каплю 5 %-го свежеприготовленного раствора хлорида железа (III). Появление красной окраски указывает на наличие ацетат-ионов в дистилляте. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Предел обнаружения: 1,25 мг ацетат-ионов в 1 мл дистиллята.
Реакция с нитратом лантана и иодом. При взаимодействии ацетат-ионов с нитратом лантана La(NO 3 ) 3 в присутствии иода и аммиака раствор приобретает темно-синюю окраску или выпадает такого же цвета осадок. Появление этой окраски или осадка обусловлено адсорбцией иода основным ацетатом лантана. Подобную окраску дают и пропионаты.
Выполнение реакции. К 1 мл дистиллята прибавляют 0,5 мл 5 %-го водного раствора нитрата лантана, 0,5 мл 0,25 %-го спиртового раствора иода и 5 капель 2 н. раствора аммиака. Появление интенсивной синей или коричнево-фиолетовой окраски указывает на наличие ацетат-ионов в дистилляте.
Предел обнаружения: 500 мкг ацетат-ионов в 1 мл. Этой реакции мешают сульфаты, фосфаты и катионы, дающие с аммиаком осадки.
Образовавшийся ацетон в присутствии щелочей взаимодействует с о -нитробензальдегидом. При этом образуется ряд промежуточных продуктов. Конечным продуктом реакции является, индиго. Уравнение этой реакции приведено выше (см. гл. IV, §11).
Выполнение реакции. Около половины дистиллята вносят в пробирку и выпаривают досуха. К сухому остатку прибавляют смесь равных количеств оксида кальция и карбоната кальция. Отверстие пробирки накрывают фильтровальной бумагой, смоченной свежеприготовленным раствором о -нитробензальдегида в 5 %-м растворе гидроксида натрия. Затем пробирку нагревают на пламени газовой горелки до прокаливания ее содержимого. При наличии ацетат-ионов в исследуемом растворе на бумаге, пропитанной раствором о -нитробензальдегида, появляется синее пятно (окраска индиго).
Эту реакцию дают соединения, при гидролизе которых образуется группа СН 3 СО—. К таким соединениям относятся диацетил и др.
Реакция образования уксусно-этилового эфира. При нагревании ацетатов с этиловым спиртом в присутствии серной кислоты образуется уксусно-этиловый эфир (этилацетат):
Выполнение реакции. В пробирку вносят 3—5 мл дистиллята и выпаривают досуха. К сухому остатку прибавляют 1 мл этилового спирта и 2 мл концентрированной серной кислоты, а затем смесь осторожно нагревают на пламени горелки. При наличии ацетатов в дистилляте появляется специфический запах этилацетата.
Получение
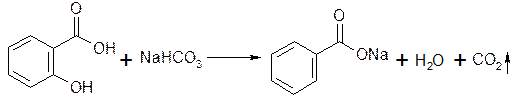
Натрия бензоат и натрия салицилат получают, выпаривая досуха раствор соответствующей кислоты (бензойной или салициловой), нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
Соли перекристаллизовывают из спирта.
Реакции подлинности.
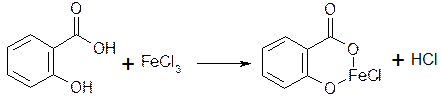
1. ГФ Х. Бензойную кислоту и ее соли определяют по реакции комплексообразования с FeCl3.
1.1. Кислоту нейтрализуют щелочью (по индикатору рН≈7). В кислой среде осадок растворяется, в щелочной среде выпадает бурый осадок гидроксида железа (III).
1.2. С хлоридом железа (III) образуется комплексная соль:
2. Реакция образования салицилатного комплекса.
2.1. Для бензойной кислоты и бензоата натрия.
2.2. Салициловую кислоту доказывают по фиолетовому окрашиванию комплекса с хлоридом железа (III).
фиолетовый цвет рН=2-3
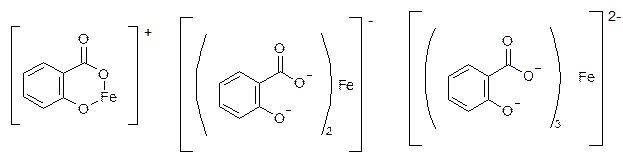
Для салициловой кислоты и ее соли:
Моносалицилат дисалицилат трисалицилат
рН=2-3 рН=3-8 рН=8-10
фиолетовый красный желтый
При добавлении минеральных кислот указанные комплексы разрушаются, окраска исчезает и выпадает белый осадок салициловой кислоты. В присутствии СН3СООН окраска сохраняется.
Соли кислот вступают в реакцию с другими солями тяжелых металлов.
3. Реакция декарбоксилирования.
3.1. При нагревании выделяется фенол, который определяют по запаху:
3.2. С концентрированной серной кислотой
4. Реакция конденсации с реактивом Марки.
5. Реакция этерификации с этанолом.
Тпл=122-124,5˚С для бензойной кислоты, Тпл=158-161˚С для салициловой кислоты.
Дата добавления: 2015-04-29 ; просмотров: 2019 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
НАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИ уксусная кислота + NaOH + FeCL3?
Химия | 10 — 11 классы
НАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИ уксусная кислота + NaOH + FeCL3.
СH3COOH + NaOH (над стрелочкойFeCL3) — — — — > ; СH3COONa + H2O.
Реакция уксусной кислоты с сольюДва уравнения?
Реакция уксусной кислоты с солью
Запишите уравнение реакциий по схеме ацетилен — этаналь — этанол — этиловый эфир уксусной кислоты — уксусная кислота?
Запишите уравнение реакциий по схеме ацетилен — этаналь — этанол — этиловый эфир уксусной кислоты — уксусная кислота.
Напишите уравнение реакции мрамора + уксусной кислоты?
Напишите уравнение реакции мрамора + уксусной кислоты.
Какая масса 50% уксусной кислоты расходуется для реакции взаимодействия в 100 гр 10% NaOH?
Какая масса 50% уксусной кислоты расходуется для реакции взаимодействия в 100 гр 10% NaOH?
Составить уравнение реакции уксусной кислоты с серной кислотой?
Составить уравнение реакции уксусной кислоты с серной кислотой.
Записать уравнения реакций уксусной кислоты с?
Записать уравнения реакций уксусной кислоты с.
Написать уравнения реакций : Аминоуксусной кислоты с : а) HCl б) NaOH в) C2H5OH?
Написать уравнения реакций : Аминоуксусной кислоты с : а) HCl б) NaOH в) C2H5OH.
Написать уравнения реакций, с помощью которых можно осуществить превращения Метан — — — — — — > ; ацетилен — — — — — > ; этаналь — — — — > ; — уксусная кислота — — — — — — > ; этиловый эфир ук?
Написать уравнения реакций, с помощью которых можно осуществить превращения Метан — — — — — — > ; ацетилен — — — — — > ; этаналь — — — — > ; — уксусная кислота — — — — — — > ; этиловый эфир уксусной кислоты.
Помогите пожалуйста?
Нужно написать уравнение реакций получения уксусной кислоты из бутана и ацетилена.
Составьте уравнение реакции уксусной кислоты с железом?
Составьте уравнение реакции уксусной кислоты с железом.
Вопрос НАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИ уксусная кислота + NaOH + FeCL3?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 10 — 11 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O NaCl + AgNO3 = AgCl + NaNO3 Zn + 2HCl = ZnCl2 + H2 стрелочка вверх.
Fe ( + 2) (OH)2 ( — ) + N ( + 4) O2 ( — 2) — Fe ( + 3) + NO3 ( — ) + Na (0) + H2 ( + ) O ( — 2) Fe ( + 2) — 1ē — Fe ( + 3) восстановитель N ( + 4) + 4ē — N (0) окислитель Fe(OH)2 + 5NO2 — Fe(NO3)3 + 2N + H2O.
Окислитель N восстановитель Fe.
Скорее всего это литий.
Наименее активный металл из перечня — литий.
Обьем воздуха 51, 42 л.
1. А 2. В 3. в 4. Г 5. 1)а2)г3)г4)б 6. Г.
2С4Н10 + 13О2 = 8СО2 + 10Н2О по закону Авогадро V CO2 / VC4H10 = 8 / 2 = 1 / 4 V CО2 = 4 * 5 = 20 л.
http://helpiks.org/3-33178.html
http://himia.my-dict.ru/q/1853916_napisat-uravnenie-reakcii-uksusnaa-kislota-naoh/