Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de638606d521e89 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Гидрокарбонат натрия
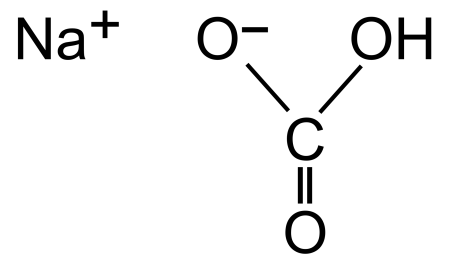
Гидрокарбонат натрия (лат. Natrii hydrocarbonas ), другие названия: бикарбонат натрия, чайная сада, питьевая или пищевая сода, двууглекислый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3. В обычном виде — мелкокристаллический порошок белого цвета. Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах. Содержание
Химические свойстваГидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора. Реакция с кислотамиГидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков: В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой: Термическое разложениеПри температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ): При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %. ПолучениеВ промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции: В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь: ПрименениеДвууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500. В химической промышленностиПрименяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления; В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей; В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков. В кулинарииОсновное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто. При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения. При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость. В медицинеТрадиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях и полости рта и горла, при сильном кашле, ангине, фарингите, а также как общепринятое средство от изжоги и болей в желудке. Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь). Применяется в качестве антиаритмического средства. Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока. Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии, и хронической почечной недостаточности. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза. В виде свечей применяется против укачивания при морской и воздушной болезнях Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой. При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия. Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек. Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина). В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует. Противопоказания к применению в медицинских целяхИндивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl — , в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу. Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу. ПожаротушениеГидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения. В бытуПрименяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды. В транспортеПрименяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды. ПроизводствоВ Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями и техническими условиями, выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров. ХранениеГидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен. БезопасностьВещество нетоксично, пожаро- и взрывобезопасно. Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м 3 .
источники: http://acetyl.ru/?search=a21kq1qy50q3a21l1q1qf22nc1o2q1qh http://chem.ru/gidrokarbonat-natrija.html | |||||||||||||||||||||||||||||||||||||||||||||||