Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Cоставьте уравнение реакции между уксусной кислотой и гидроксидом кальция в молекулярном, полном и сокращенном ионном виде?Химия | 5 — 9 классы Cоставьте уравнение реакции между уксусной кислотой и гидроксидом кальция в молекулярном, полном и сокращенном ионном виде. 2CH3COOH + Ca(OH)2 — > (CH3COO)2Ca + 2H2O 2CH3COO( — ) + 2H( + ) + Ca(OH)2 — > Ca( + 2) + 2CH3COO( — ) + 2H2O 2H( + ) + Ca(OH)2 — > Ca( + 2) + 2H2O. Составьте уравнение реакции нейтрализации гидроксида кальция соляной кислотой в молекулярном и ионном виде?Составьте уравнение реакции нейтрализации гидроксида кальция соляной кислотой в молекулярном и ионном виде. Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между гидроксидом бария и сульфатом натрия?Составьте уравнение реакции в молекулярном, полном ионном, сокращенном ионном виде между гидроксидом бария и сульфатом натрия. Уравнение реакции обмена в молекулярном полном и сокращенном ионом виде между иодоводородной кислотой и гидроксидом бария?Уравнение реакции обмена в молекулярном полном и сокращенном ионом виде между иодоводородной кислотой и гидроксидом бария. Закончить уравнения реакций ионного обмена в молекулярном виде, составить полное и сокращенное ионные уравнения : Фосфорная кислота + гидроксид натрия = Нитрат железа (III) + гидроксид натрия =?Закончить уравнения реакций ионного обмена в молекулярном виде, составить полное и сокращенное ионные уравнения : Фосфорная кислота + гидроксид натрия = Нитрат железа (III) + гидроксид натрия =. Напишите молекулярные, полные и сокращенные ионные уравнения реакций между веществами :А)гидроксидом калия и серной кислотойБ)нитратом серебра и хлоридом кальцияВ)карбонатом натрия и азотной кислотой?Напишите молекулярные, полные и сокращенные ионные уравнения реакций между веществами : А)гидроксидом калия и серной кислотой Б)нитратом серебра и хлоридом кальция В)карбонатом натрия и азотной кислотой. Напишите молекулярные полные и сокращенные ионные уравнения реакций между веществами ?Напишите молекулярные полные и сокращенные ионные уравнения реакций между веществами . А)гидроксидом калия и серной кислоты б)нитратом серебра и хлоридом кальция в)карбанатом натрия и азотной кислоты. Гидроксид кальция и серная кислота уравнение реакции полно ионное и молекулярное помогите плиз?Гидроксид кальция и серная кислота уравнение реакции полно ионное и молекулярное помогите плиз. Уравнения реакции взаимодействия уксусной кислоты в молекулярном, ионном и сокращенном ионном виде с гидроксидом калия?Уравнения реакции взаимодействия уксусной кислоты в молекулярном, ионном и сокращенном ионном виде с гидроксидом калия. Уравнение реакции Уксусная кислота + мел в молекулярной, полной и сокращенной ионной форме?Уравнение реакции Уксусная кислота + мел в молекулярной, полной и сокращенной ионной форме. Доброе время суток ?Доброе время суток ! 1. Напишите молекулярную, полную ионную и сокращенную ионную реакцию Соды и Серной кислоты Напишите молекулярную, полную ионную и сокращенную ионную реакцию Гидроксида кальция и фенолфталеина и добавьте соляной кислоты после отго как раствор пол. На этой странице находится ответ на вопрос Cоставьте уравнение реакции между уксусной кислотой и гидроксидом кальция в молекулярном, полном и сокращенном ионном виде?, из категории Химия, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать. С + 2H2 — > CH4 2CH4 — > CH = — CH + 3H2 ( t = 1500) CH = — CH + H2 — > CH2 = CH2 (t, kat) CH2 = CH2 + H2O — > CH3 — CH2 — OH (kat) C6H6 + HONO2 — > C6H5NO2 + H2O ( t, H2SO4) C6H5NO2 + 3H2 — > C6H5NH2 + 2H2O. Вот снизу должна быть указа формула на фото. Mr(CH4) = 12 + 4 * 1 = 16 W(H) = 4 / 16 = 0. 25 = 25% Mr(C2H2) = 2 * 12 + 2 * 1 = 26 W(H) = 2 / 26 = 0. 08 = 8% Mr(C2H4) = 2 * 12 + 4 * 1 = 28 W(H) = 4 / 28 = 0. 14 = 14% Ответ : C2H2, C2H4, CH4. Решение задачи находится на фото. Марганец масса 54, 93 а валентность 2 ; 4 ; 7. Дано : m(Cu) = 6. 4г Найти : V(SO2) — ? Решение : 6. 4г. Xл Cu + 2H2SO4 = SO2 + 2H2O + CuSO4 64г. 22. 4л X = 6. 4г×22. 4л : 64г = 2. 24л Ответ : выделился оксид серы (IV) массой 2. 24л. Вода – слабый электролит, диссоциирующий на ионы H + и OH — — анионы. Этому процессу соответствует константа диссоциации воды : д * [H2O] = К H2O = [H + ] [OH — ] – ионное произведение воды, К H2O = 1 * 10 — 14 (при 25° С) К H2O – величина постоянна.. 1. Литий — Li + 3 Li )2ē )1ē ē = 3, p = 3, n = 4 Находится в I группе, А подгруппе, II периоде. 2. Металл 3. Li Be 5. Высший оксид — Li2O — основный 6. Высший гидроксид — LiOH — щелочь 7. Летучего водородного соединения не образует.. Нет, там за каждый элемент ставится определенное кол — во баллов. На Решу ОГЭ вариант открой, после внизу страницы нажми «сохранить», далее будет написано, как оценивается каждое задание из 2 части. 2. Дано : ω(Е) = 91, 18% Знайти : Е — ? Ω(Н) = 100% — 91, 18% = 8, 82% Загальна формула сполуки ЕН3 Мг(ЕН3) = 3 / 0, 0882 = 34 Аг(Е) = 34 — 3 = 31⇒Р — Фосфор 2. Дано : m(Me(NO3)3 = 42. 6 r m(Me(OH)3 = 15. 6 r Знайти : Ме — ? Формула солі — ? 42.. Ацетат кальция
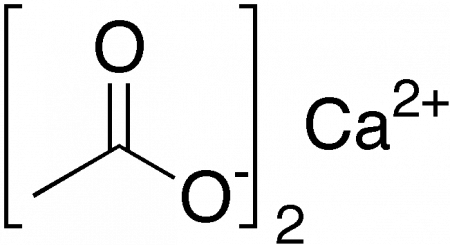
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O. Содержание
История названияПригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён, установить человека, давшего такое название этой соли или впервые получившего её, невозможно. ПолучениеВ лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция. ПрименениеНе имеет промышленного применения. Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С: Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией. Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов: Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия: Также ацетат кальция применяют при получении лавсана в качестве катализатора. Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта. Пищевая промышленностьАцетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263. Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов. Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca 2+ , то применять его лучше в сочетании с другими консервантами.
МедицинаАцетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот: Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната. источники: http://himia.my-dict.ru/q/7966670_costavte-uravnenie-reakcii-mezdu-uksusnoj-kislotoj/ http://chem.ru/acetat-kalcija.html | |||||||||||||||||||||||||||||||||||||||||||||||||||||||