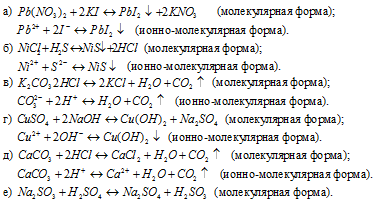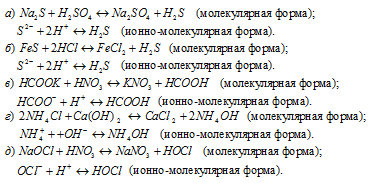Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 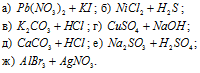
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 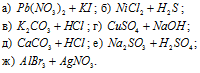
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 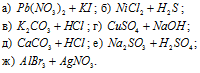
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
химия, очень нужно, 10 класс, помогите решить
как исходя из уксусной кислоты можно получить вещества :
а) ацетат аммония
б) ацетат бария
в) хлоруксусную кислоту
г) этиловый спирт
д) ангидрид уксусной кислоты
при каких условиях будут протекать эти реакции? напишите уравнения реакций.
пожалуйста, помогите мне с этим заданием.
ацетат аммония NH4C2H3O2
CH3COOH+NH4OH =NH4C2H3O2 +Н2О
1
В колбу налейте немного концентрированной уксусной кислоты (не менее 70%, лучше 80%), вставьте в одно горло делительную воронку с нашатырным спиртом — гидроксид аммония (например, 10%). После чего аккуратно поместите донышко колбы в сосуд с холодной водой и начните понемногу и медленно приливать нашатырный спирт, время от времени взбалтывая все содержимое колбы.
2
Время окончания реакции можно достаточно точно определить по резкому, неприятному запаху аммиака: это означает, что нашатырный спирт больше не «связывается» уксусной кислотой. Отсоедините делительную воронку, перелейте раствор в емкость для выпаривания, и удалите жидкость на водяной бане. Если видно, что раствор загрязнен механическими примесями – лучше предварительно отфильтровать.
3
Через некоторое время, когда вода выпарится, вы увидите образовавшийся ацетат аммония. В подавляющем большинстве случаев, это будет бесформенная «слипшаяся» масса – еще раз уточним, что ацетат аммония чрезвычайно гигроскопичен! Удалить лишнюю влагу обычным фильтрованием почти невозможно, и поэтому проходится прибегать к фильтрованию на воронке Бюхнера с бумажным спиртом. Образовавшиеся кристаллы ацетата аммония надо поскорее перенести в сухую, плотно закрывающуюся емкость и хранить в ней же.
ацетат бария Получают действием уксусной кислоты на оксид бария, гидроксид бария или карбонат бария:
BaO+2CH3COO=Ba(CH3COO)2+Н2О
Ba(OH)2+2CH3COO=Ва (CH3COO)2+2Н2О
BaCO3+2CH3COO=Ва (CH3COO)2+СО2+Н2О
хлорноукс. к-ту
Нагревают 60 кг уксусной кислоты с 150 кг сульфурилхлорида и 0,6 кг ацетилхлорида до 55-60 С. Уже ниже 50 С начинается хлорирование. Как только выделение газа прекращается, то нагревают еще короткое время до кипения сульфурилхлорида и затем позволяют массе остыть, при этом она полностью закристаллизовывается монохлоруксусной кислотой.
этиловый спирт С4Н8О2.
1
Если написать его структурную формулу, сразу будет видно, что этилацетат образован из двух молекул: этилового спирта CH3CH2OH и уксусной кислоты СН3СООН. При их соединении происходит «отщепление» молекулы воды с образованием «мостика» С-О. Поэтому один из способов получения этого вещества в том и состоит:
С2Н5ОН (этиловый спирт) + СН3СООН (уксусная кислота) = С2Н5О-СОСН3 + Н2О
2
При кипячении смеси этанола и уксусной кислоты, в присутствии концентрированной серной кислоты, как поглотителя воды, происходит эта реакция этерификации. Пары образующегося эфира конденсируются, потом очищаются от примесей.
3
Другой способ получения этилацетата – реакция уксусного ангидрида с этиловым спиртом. Она идет таким образом:
(CH3CO)2O + 2C2H5OH = 2С2Н5О-СОСН3 + H2O
4
Можно синтезировать этилацетат и путем реакции соли уксусной кислоты, например, ацетата натрия, с хлористым этилом. Продукт образуется следующим образом:
СН3СООNa + C2H5Cl = C2H5O-CO-CH3 + NaCl
ангидрид уксусной кислоты
пропусканием ацетилена в ледяную уксусную кислоту при 70-85 град. цел. в присутствии катализатора сульфата ртути (1% от массы уксусной кислоты взятой в реакцию) с последующим разложением образовавшегося этилидендиацетата в паровой или жидкой фазе в присутствии катализаторов (хлорида цинка, цинковой пыли, серной кислоты, сульфата ртути) на уксусный ангидрид и ацетальдегид
2CH3COOH + C2H2 = CH3CH(OCOCH3)2
CH3CH(OCOCH3)2 = (CH3CO)2O + CH3CHO
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e26996b59df8efb • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://sprashivalka.com/tqa/q/19223117
http://gomolog.ru/reshebniki/10-klass/rudzitis-i-feldman-2019/prakt-3/3.html