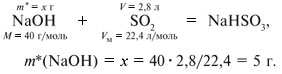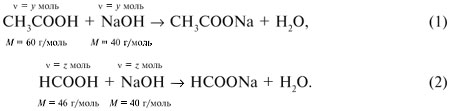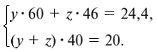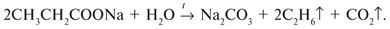Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
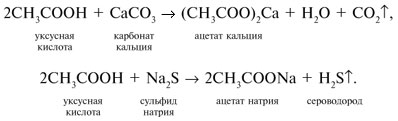
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Урок 27. Химические свойства карбоновых кислотРассмотрим химические свойства карбоновых кислот на примере уксусной кислоты.
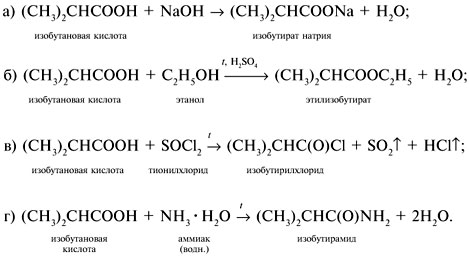
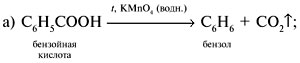
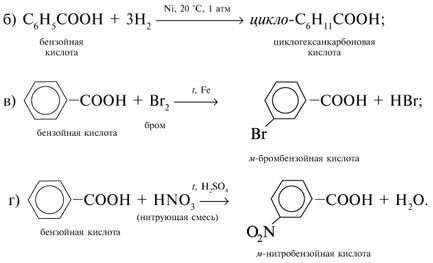
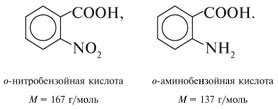
Если М = а = 90, то у = (3,26 – 0,03•90)/14 = 0,56/14 = 0,04 моль, что не соответствует условию задачи, где х + у = 0,03 моль. Если М = а = 104, то у = (3,26 – 0,03•104)/14 = 0,01 моль. Следующий гомолог: М = а = 118 г/моль не подходит, т.к. тогда количество вещества у = (3,26 – 0,03•118)/14 = –0,02 моль – отрицательная величина. Ответ. В состав смеси входили кислоты НООССН2СООН (0,02 моль) и НООССН2СН2СООН УПРАЖНЕНИЯ. 1. Составьте уравнения реакций бензойной кислоты С6Н5СООН со следующими реагентами: 2. Запишите уравнения реакций бензойной кислоты, в которых происходит расщепление связи 3. Составьте уравнения реакций, с помощью которых изобутановую кислоту (СН3)2СНСООН можно превратить в следующие соединения: а) изобутират натрия (СН3)2СНСООNa; 4. Составьте уравнения реакций: а) декарбоксилирование бензойной кислоты С6Н5СООН до бензола под действием горячего раствора КМnО4; б) восстановление бензольного кольца бензойной кислоты (Н2, Ni, 20 °С, 1 атм) с образованием циклогексанкарбоновой кислоты; 5. Неизвестная кислота может быть либо орто-нитробензойной кислотой (tпл = 147 °С), либо орто-аминобензойной (антраниловой) кислотой (tпл = 146 °С). При нейтрализации 0,201 г образца этой кислоты расходуется 12,4 мл раствора щелочи с концентрацией 0,098 моль/л NaOH. Какая это кислота? 6. К 24,4 г смеси уксусной и муравьиной кислот прибавили 227,3 мл 10%-го раствора гидроксида натрия (плотность – 1,1 г/мл). Для связывания избытка щелочи с образованием кислой соли потребовалось 2,8 л (н.у.) оксида серы(IV). Определите состав исходной смеси кислот. 7. После прокаливания натриевой соли пропионовой кислоты RCOONa получен белый остаток, растворимый в воде. Этот остаток изменяет окраску влажного красного лакмуса в синий цвет и реагирует с разбавленной соляной кислотой с выделением пузырьков газа. Какой возможный состав остатка? Напишите уравнение реакции термического разложения натриевой соли пропионовой кислоты во влажном воздухе. Ответы на упражнения к теме 2Урок 271. а) С6Н5СООН + КОН 2. 3. 4. 5. Найдем количество вещества NaOH в объеме V = 12,4 мл (0,0124 л) раствора с молярной концентрацией cмол(NaOH) = 0,098 моль/л:
Количества веществ одноосновной кислоты RCOOH и щелочи NaOH, расходуемые в реакции нейтрализации, одинаковые, т.е. Ответ. орто-Нитробензойная кислота. 6. Масса NaOH, содержащегося в заданном объеме V = 227,3 мл с концентрацией c(NaOH) = 10% и плотностью Избыток щелочи (m*) найдем из уравнения реакции: В реакции со смесью кислот НСООН и СН3СООН израсходовалось 20 г NaOH.
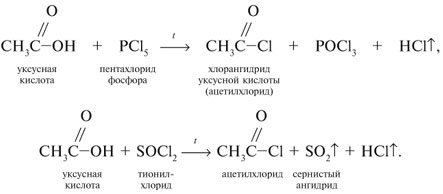
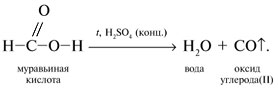
Запишем уравнения реакций: Расход количества вещества щелочи в реакциях (1) и (2) такой же, как у кислот. Зная общую массу смеси кислот (m(смеси) = 24,4 г) и расход щелочи (20 г), составим систему двух уравнений с двумя неизвестными: Решая систему, найдем: у = 0,1 моль, z = 0,4 моль. По массе это составляет: m(CH3COOH) = 0,1•60 = 6 г, Концентрация в процентах по массе: Ответ. Состав исходной смеси кислот – 6 г (24,6%) СН3СООН и 18,4 г (75,4%) НСООН. 7. Уравнение реакции термического разложения натриевой соли пропионовой кислоты во влажном воздухе: Белый остаток после прокаливания – это сода Na2CO3. В воде сода растворяется и гидролизуется: Образующаяся щелочь NaOH окрашивает красный лакмус в синий цвет. Сода реагирует с кислотой НСl с выделением газа СО2: Уксусная кислота с хлоридом фосфора уравнениеУстановите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ
Запишите в таблицу выбранные цифры под соответствующими буквами.
А) хлор взаимодействует с уксусной кислотой с образованием хлоруксусной кислоты (3) Б) с аммиаком уксусная кислота взаимодействует как обычная кислота, образуя ацетат аммония (2) В) уксусный альдегид под действием аммиачного раствора оксида серебра образует ацетата аммония. (2) Г) уксусная кислота с хлоридом фосфора (V) образует хлорангидрид уксусной кислоты (5) источники: http://him.1sept.ru/2004/36/10.htm http://chem-ege.sdamgia.ru/problem?id=11296 |

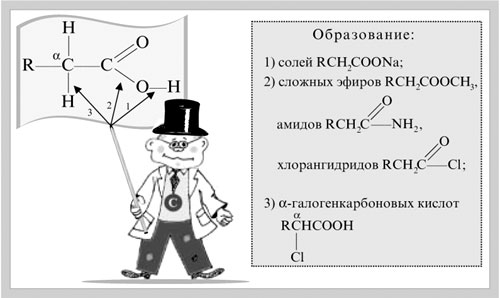
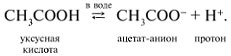
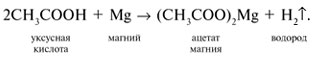
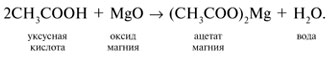
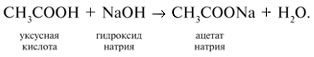
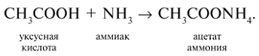
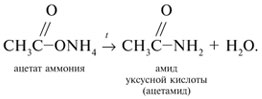
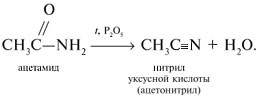
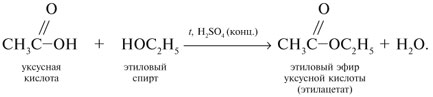
 -положении довольно подвижные и могут замещаться на атомы хлора или брома:
-положении довольно подвижные и могут замещаться на атомы хлора или брома: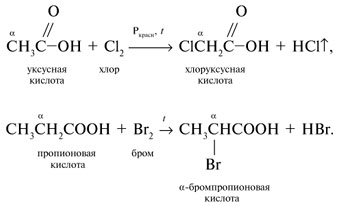
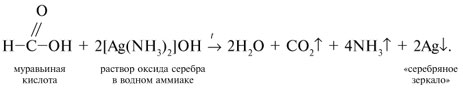
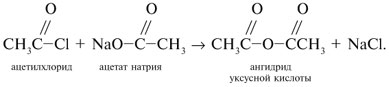
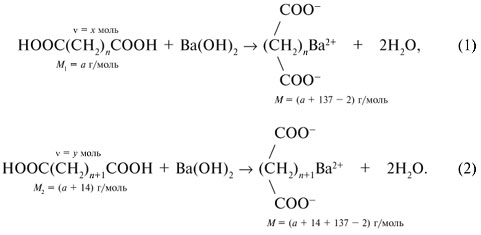
 = х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2):
= х моль других участвующих в реакции (1) веществ – Ва(ОН)2 и (СН2)n(СОО)2Ва. Аналогично в реакции (2): С6Н5СООК + Н2О;
С6Н5СООК + Н2О;  ;
; 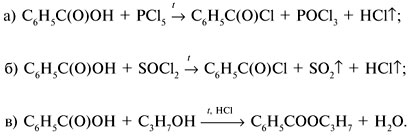
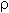 = 1,1 г/мл, составляет:
= 1,1 г/мл, составляет: