§ 20. УКСУСНАЯ КИСЛОТА
Безводная (ледяная) уксусная кислота СН 3 СООН представляет собой бесцветную гигроскопическую жидкость или бесцветные кристаллы с резким запахом. Она смешивается с водой, этиловым спиртом и диэтиловым эфиром во всех соотношениях. Эта кислота перегоняется с водяным паром. Уксусную кислоту получают при брожении некоторых органических веществ и путем синтеза. Эта кислота содержится в продуктах сухой перегонки дерева. В небольших количествах уксусная кислота может содержаться в человеческом организме.
Применение. Действие на организм. Уксусная кислота применяется для синтеза красителей, получения ацетата целлюлозы, ацетона и многих других веществ. В виде уксуса и уксусной эссенции она применяется в пищевой промышленности и в быту для приготовления пищи. Отмечены случаи отравления уксусной кислотой (главным образом уксусной эссенцией), принятой внутрь. 10—20 г уксусной эссенции или 200—300 мл уксуса является смертельной дозой. Уксусная кислота оказывает действие на кровь и почки. При контакте с кожей ледяная уксусная кислота вызывает ожоги и образование пузырьков. После приема концентрированной уксусной кислоты или уксусной эссенции внутрь поражается верхняя часть пищевого канала, появляется кровавая рвота, понос, развивается гемолитическая анемия, гемогло-бинурия, анурия и уремия. При вдыхании паров уксусной кислоты происходит раздражение слизистых оболочек дыхательных путей, могут развиваться бронхопневмония, катаральный бронхит, воспаление глотки и г. д.
Уксусная кислота относится к веществам, изолируемым из объектов перегонкой с водяным паром. В отличие от других веществ этой группы уксусную кислоту отгоняют из объектов биологического происхождения, подкисленных 10 %-м раствором серной или фосфорной кислоты.
Перегонку уксусной кислоты производят до отрицательной реакции дистиллята на наличие этой кислоты. Ввиду ее летучести дистиллят собирают в сосуд, содержащий 0,1 н. раствор гидроксида натрия. В дистилляте ацетат-ионы определяют при помощи перечисленных ниже реакций.
Реакция с хлоридом железа (III). От прибавления хлорида железа (III) к ацетат-ионам появляется красная окраска, обусловленная образованием основного ацетата железа:
Выполнение реакции. 2—3 мл дистиллята вносят в пробирку и прибавляют 1 каплю 5 %-го свежеприготовленного раствора хлорида железа (III). Появление красной окраски указывает на наличие ацетат-ионов в дистилляте. При нагревании окрашенного раствора происходит гидролиз, в результате которого выпадает бурый осадок.
Предел обнаружения: 1,25 мг ацетат-ионов в 1 мл дистиллята.
Реакция с нитратом лантана и иодом. При взаимодействии ацетат-ионов с нитратом лантана La(NO 3 ) 3 в присутствии иода и аммиака раствор приобретает темно-синюю окраску или выпадает такого же цвета осадок. Появление этой окраски или осадка обусловлено адсорбцией иода основным ацетатом лантана. Подобную окраску дают и пропионаты.
Выполнение реакции. К 1 мл дистиллята прибавляют 0,5 мл 5 %-го водного раствора нитрата лантана, 0,5 мл 0,25 %-го спиртового раствора иода и 5 капель 2 н. раствора аммиака. Появление интенсивной синей или коричнево-фиолетовой окраски указывает на наличие ацетат-ионов в дистилляте.
Предел обнаружения: 500 мкг ацетат-ионов в 1 мл. Этой реакции мешают сульфаты, фосфаты и катионы, дающие с аммиаком осадки.
Образовавшийся ацетон в присутствии щелочей взаимодействует с о -нитробензальдегидом. При этом образуется ряд промежуточных продуктов. Конечным продуктом реакции является, индиго. Уравнение этой реакции приведено выше (см. гл. IV, §11).
Выполнение реакции. Около половины дистиллята вносят в пробирку и выпаривают досуха. К сухому остатку прибавляют смесь равных количеств оксида кальция и карбоната кальция. Отверстие пробирки накрывают фильтровальной бумагой, смоченной свежеприготовленным раствором о -нитробензальдегида в 5 %-м растворе гидроксида натрия. Затем пробирку нагревают на пламени газовой горелки до прокаливания ее содержимого. При наличии ацетат-ионов в исследуемом растворе на бумаге, пропитанной раствором о -нитробензальдегида, появляется синее пятно (окраска индиго).
Эту реакцию дают соединения, при гидролизе которых образуется группа СН 3 СО—. К таким соединениям относятся диацетил и др.
Реакция образования уксусно-этилового эфира. При нагревании ацетатов с этиловым спиртом в присутствии серной кислоты образуется уксусно-этиловый эфир (этилацетат):
Выполнение реакции. В пробирку вносят 3—5 мл дистиллята и выпаривают досуха. К сухому остатку прибавляют 1 мл этилового спирта и 2 мл концентрированной серной кислоты, а затем смесь осторожно нагревают на пламени горелки. При наличии ацетатов в дистилляте появляется специфический запах этилацетата.
Уксусная кислота с хлоридом железа уравнение
Для выполнения задания используйте следующий перечень веществ: хлорид железа (III), медь, нитрат бария, серная кислота, уксусная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ: хлорид железа (III), медь, нитрат бария, серная кислота, уксусная кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Запишем уравнение реакции:
Составим электронный баланс:
Медь в степени окисления 0 является восстановителем, а железо в степени окисления +3 — окислителем.
Между медью и серной кислотой также возможна овр. Получится соль, оксид серы (|V) и вода.
Да, верно. В данном задании может быть несколько правильных ответов
Разве металл, стоящий в ряду напряжения правее, может вытеснить «левый» металл из его соли?
Он его не вытеснил, а частично восстановил. Так как медь стоит правее, то до чистого железа восстановить не может.
Для начала запишем молекулярные формулы данных веществ: ,
,
,
,
.
Условия реакций ионного обмена (РИО):
1) Растворимость реагирующих веществ:
Кислота + Основание. Растворим хотя бы 1 из реагентов
Кислота + Соль. Обязательно растворима должна быть кислота
Основание + Соль. Растворимы оба реагента
Соль + Соль. Должны быть обе растворимы
2) В ходе реакции должны образоваться осадок, газ или вода.
Медь — простое вещество, в реакции обмена не вступает.
Хлорид железа (III) — растворимая соль, с нитратом бария и серной кислотой образует растворимые продукты, с уксусной кислотой идет реакция совместного гидролиза.
Нитрат бария — растворимая соль, при взаимодействии с уксусной кислотой образует растворимые продукты, а с серной кислотой — осадок сульфата бария.
Серная кислота — с уксусной кислотой в РИО не вступает.
Первый вариант ответа:
→
→
→
Второй вариант ответа:
→
↓
→
↓
→
↓
| Критерии оценивания выполнения задания | Баллы | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; Методичка по органике. Методические указания по выполнению лабораторных работ по курсу Органическая химия
|
| Подборка по базе: Лабораторные работы _Маневрирование и Управление судном_Метод ук, Методические указания к выполнению лабораторных работ.docx, 12 04 04 Метод указания к выполнению магистерской диссертации.do, Инструкция по выполнению теста ОПК_2021-21 г..doc, Методические указания тлз заочное Математиика.docx, Методические указания по изучению курса 2.docx, Темы эссе и методические указания к его выполнению.docx, Методические указания КП 06.05.2020 (3).docx, методические указания к вкр (4).docx, Методические указания к ВЛР №2 (2).docx Опыт 1. Кислотные свойства карбоновых кислот. Реактивы и материалы: уксусная кислота, 0,1 н. раствор; магний (порошок или стружка); карбонат натрия; баритовая вода; метиловый оранжевый, раствор; лакмус синий, раствор; фенолфталеин, 1 %-ный спиртовой раствор. 1.В три пробирки помещают по 1 капле раствора уксусной кислоты. В первую пробирку добавляют 1 каплю метилового оранжевого, во вторую—1 каплю лакмуса и в третью— 1 каплю фенолфталеина. В пробирке с метиловым оранжевым появляется красное окрашивание, в пробирке с лакмусом — розовое. Фенолфталеин остается бесцветным. 2.В пробирку помещают 2 капли раствора уксусной кислоты и добавляют немного магния. К отверстию пробирки подносят горящую лучинку. При этом наблюдается вспышка, сопровождающаяся резким звуком, характерным для вспышки смеси водорода и воздуха. Химизм процесса: 3. В пробирку наливают 2—3 капли раствора уксусной кислоты и добавляют несколько крупинок углекислого натрия. К отверстию пробирки подносят горящую лучинку. Лучинка гаснет. Карбоновые кислоты в водном растворе диссоциируют с образованием карбоксилат-аниона и протона: Протон гидроксида в карбоксильной группе отщепляется легче, чем в спиртах (влияние полярной карбонильной группы). Образование карбоксилат-аниона является причиной увеличения кислотности карбоновых кислот по сравнению со спиртами. На легкость отщепления протона влияет также радикал, связанный с карбоксильной группой. Поэтому карбоновые кислоты дают характерное окрашивание с индикаторами, проводят электрический ток, т. е. являются электролитами. Карбоновые кислоты по сравнению с неорганическими — слабые кислоты. Константа диссоциации у них порядка 10 -5 . Реактивы и материалы: уксуснокислый натрий кристаллический; хлорид железа FeCl3, 0,1 н. раствор. В пробирку помещают несколько кристалликов уксуснокислого натрия, 3 капли воды и 2 капли раствора хлорида железа (III). Раствор окрашивается в желтовато-красный цвет в результате образования железной соли уксусной кислоты. Раствор нагревают до кипения. Тотчас же выпадают хлопья основных солей красно-бурого цвета. Химизм процесса: Уксусная кислота, как и большинство карбоновых кислот,— слабая кислота. Поэтому ее соли легко гидролизуются с образованием основных солей и продуктов водного гидролиза. Опыт 3. Качественная реакция α-оксикислот с хлоридом железа (III) Реактивы и материалы: хлорид железа (III), 0,1 н. раствор; фенол, водный раствор; молочная кислота; уксусная кислота концентрированная. В две пробирки вводят по 1 капле раствора хлорида железа и добавляют по 2 капли раствора фенола. Растворы окрашиваются в фиолетовый цвет. В одну пробирку добавляют 2 капли молочной кислоты, а в другую— столько же капель уксусной кислоты. В пробирке с молочной кислотой появляется зеленовато-желтое окрашивание, в пробирке с уксусной кислотой цвет раствора не изменяется. α-Оксикислоты вытесняют фенол из комплексного фенолята, и фиолетовая окраска раствора переходит в желтую. В присутствии молочной кислоты фиолетовый цвет железного комплекса изменяется на зеленовато-желтый вследствие образования лактата железа (молочнокислого железа): Реактивы и материалы: салициловая кислота, насыщенный раствор; хлорид железа FeCl, 0,1 н. раствор; этиловый спирт 96%-ный; галловая кислота, танин (насыщенные растворы); хлорид железа (III), 0,1 н. раствор. В пробирку вводят 2 капли раствора салициловой кислоты и прибавляют I каплю раствора хлорида железа. Раствор окрашивается в темно-фиолетовый цвет, что указывает на наличие в салициловой кислоте фенольного гидроксила. Добавляют к раствору 4 капли этилового спирта; окраска не исчезает (в отличие от фенола). В одну пробирку вносят 2 капли раствора галловой кислоты, в другую—-2 капли танина,-прибавляют в каж¬дую пробирку по капле раствора хлорида железа. Гал¬ловая кислота с хлоридом железа дает зеленовато-черное окрашивание, а танин — сине-черное. Опыт 5. Разложение муравьиной и щавелевой кислот при нагревании с концентрированной серной кислотой Реактивы и материалы: муравьиная кислота безводная; серная кислота концентрированная (d == 1,84 г/см 3 ); щавелевая кислота кристаллическая; серная кислота (d=l,84 г/см 3 ); баритовая вода, насыщенный раствор. Оборудование: газоотводная трубка. В пробирку приливают 3 капли муравьиной кислоты, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки. Бурно выделяется газ. При поджигании газ горит голубоватыми вспышками. Химизм процесса: Муравьиная кислота под действием концентрированной серной кислоты разлагается с образованием оксида углерода. Это свойство отличает муравьиную кислоту от остальных карбоновых кислот. В пробирку помещают несколько кристаллов щавелевой кислоты и добавляют 2 капли серной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и нагревают на пламени горелки. Поджигают выделяющийся газ — он горит голубоватыми вспышками. После этого конец газоотводной трубки опускают в баритовую воду. Баритовая вода мутнеет. Химизм процесса: Под действием концентрированной серной кислоты щавелевая кислота в отличие от других двухосновных кислот разлагается. Реактивы и материалы: щавелевая кислота кристаллическая; перманганат калия, 0,1 н. раствор; серная кислота, 0,2 н. раствор; баритовая вода, насыщенный раствор; олеиновая кислота; раствор; карбонат натрия. 0,5 н. раствор. Оборудование: газоотводная трубка. В пробирку помещают несколько кристаллов щавелевой кислоты, добавляют 2 капли перманганата калия и I каплю серной кислоты. Отверстие пробирки закрывают Пробкой с газоотводной трубкой, конец которой опущен и пробирку с баритовой водой. Реакционную смесь нагревают. Розовый раствор перманганата калия обесцвечивается, а в пробирке с баритовой водой появляется белый осадок карбоната. Химизм процесса: В отличие от высших гомологов щавелевая кислота обладает восстановительными свойствами: она количественно окисляется перманганатом калия в кислом растворе. На этой реакции окисления щавелевой кислоты основано ее применение в аналитической химии для установления титра перманганата калия. В пробирку помещают по 2 капли олеиновой кислоты, раствора карбоната натрия и раствора перманганата калия. При встряхивании смеси розовая окраска исчезает. Химизм процесса: Обесцвечивание бромной воды и раствора перманганата калия указывает на наличие кратной связи в молекуле олеиновой кислоты. Лабораторная работа №13 Сложные эфиры. Жиры. Реактивы и материалы: масло растительное; перманганат калия, 0,1 н. раствор; карбонат натрия, 2 н. раствор. В пробирку вводят 2 капли растительного масла (подсолнечного), 2 капли раствора карбоната натрия и 2 капли водного раствора перманганата калия. Встряхивают содержимое пробирки. Малиновая окраска перманганата калия исчезает, что указывает на окисление глицеридов непредельных высших кислот, входящих в состав растительного масла. Химизм процесса: Опыт 2. Получение бензойноэтилового эфира Реактивы и материалы: бензойная кислота, этиловый спирт, серная кислота (d=l,84 г/см 3 ). В пробирку помещают несколько кристаллов бензойной кислоты, прибавляют 4 капли этилового спирта и 2 капли серной кислоты. Содержимое пробирки встряхивают и осторожно нагревают до кипения. Выливают полученную бесцветную жидкость в пробирку с холодной водой. Ощущается характерный запах бензойноэтилового эфира (этилбензоата). Часть бензойной кислоты, не вошедшая в реакцию, выпадает в осадок. Химизм процесса:
Реактивы и материалы: твердый жир (говяжий, бараний, свиной); едкий натр, 15%-ный спиртовой раствор; хлорид натрия, насыщенный раствор. Оборудование: водяная баня, стеклянная палочка. В широкую пробирку помещают 2 г жира и приливают 6 мл спиртового раствора щелочи. Перемешивают смесь стеклянной палочкой и нагревают на водяной бане до начала кипения. Омыление ведут 3—5 мин, пока жидкость не станет однородной. Для определения конца омыления помещают в пробирку несколько капель полученной смеси, добавляют 4—5 мл воды и нагревают раствор при встряхивании на пламени горелки. Если смесь растворяется в воде нацело, без выделения капель жира, то омыление можно считать законченным. Если выделяются капли жира, то продолжают нагревать смесь на водяной бане еще несколько минут, а затем снова проверяют полноту омыления. К полученной густой жидкости добавляют 6—7 мл насыщенного раствора поваренной соли. Жидкость мутнеет и выделяется слой мыла, всплывающий на поверхность. Дают смеси отстояться, затем охлаждают пробирку холодной водой. Затвердевшее мыло отделяют. Будучи сложными эфирами, жиры подвергаются гидролизу с образованием глицерина и смеси высших жирных кислот. Большое значение имеет гидролиз жиров, проводимый при нагревании с водой в присутствии едких щелочей. При этом получаются глицерин и смесь солей высших кислот—мыло. Этот процесс называется омылением жиров и применяется в мыловаренном производствею. Реактивы и материалы: этиловый спирт; мыло твердое; фенолфталеин, 1 %-ный спиртовой раствор. В сухую пробирку помещают кусочек мыла, 4 капли спирта, энергично взбалтывают и добавляют 1 каплю фенолфталеина. Окраска раствора не меняется. К спиртовому раствору мыла прибавляют по каплям дистиллированную воду. По мере прибавления воды появляется розовое окрашивание. Интенсивность окраски постепенно увеличивается. Разбавление спиртового раствора мыла водой вызывает гидролиз мыла. В результате образуются малодиссоциированные жирные кислоты и едкий натр. Розовое окрашивание говорит о появлении в растворе гидроксильных ионов. Реакция водных растворов мыла всегда щелочная. Лабораторная работа №14. Углеводы. Реактивы и материалы: глюкоза, 0,5%-ный раствор; едкий нарт, 2 н. раствор; сульфат меди (II), 0,2 н. раствор. В пробирку помещают 1 каплю раствора глюкозы и 5 капель раствора едкого натра. К полученной смеси добавляют 1 каплю раствора сульфата меди (II) и встряхивают содержимое пробирки. Образующийся вначале голубоватый осадок гидроксида меди (II) Сu(ОН)2 мгновенно растворяется, получается прозрачный раствор глюконата меди (II), имеющий слабую синюю окраску: Моносахариды взаимодействуют с гидроксидами, а также с оксидами тяжелых металлов, подобно многоатомным спиртам. При этом водород гидроксильных групп замещается на металл, и образуются производные моносахаридов типа алкоголятов, называемые сахаратами. Растворение гидроксида меди (II) Сu(ОН)2 доказывает наличие гидроксильных групп в глюкозе. Полученный раствор сохраняют для следующего опыта. Опыт 2. Окисление глюкозы гидроксидом меди (II) в присутствии щелочи. Реактивы и материалы: раствор сахарата меди. К полученному в предыдущем опыте щелочному раствору сахарата меди добавляют 5-6 капель воды (высота слоя жидкости должна быть 10-15 мм). Содержимое пробирки нагревают над пламенем горелки, держа пробирку наклонно, так чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагрева (для контроля). При осторожном нагревании до кипения нагретая часть синего раствора окрашивается в оранжево-желтый цвет вследствие образования гидроксида меди (I) СuОН. При более продолжительном нагревании может образоваться красный осадок оксида меди (I) Cu2O Выделяющийся при восстановлении гидроксида меди Сu(ОН)2 кислород идет на окисление глюкозы. Окисление моносахаридов (альдоз и кетоз) в щелочной среде протекает неоднородно и сложно, с разрывом молекулы и образованием более простых молекул, обладающих восстановительными свойствами, например формальдегида, ацетальдегида, муравьиной кислоты и других соединений. Опыт 3. Окисление глюкозы реактивом Фелинга Реактивы и материалы: глюкоза, 0,5%-ный раствор; реактив Фелинга. В пробирку вводят 3 капли раствора глюкозы и каплю реактива Фелинга (щелочного раствора медного алкоголята сегнетовой соли). Держа пробирку наклонно, осторожно нагревают верхнюю часть раствора. При этом нагретая часть раствора окрашивается в оранжево-желтый цвет вследствие образования гидроксида меди (I) СuОН, которая в дальнейшем переходит в красный осадок оксида меди (I) Сu2О. Реактивом Фелинга проводить окисление удобнее, чем гидроксидом меди Сu(ОН)2 в присутствии щелочи, так как при добавлении большего количества сернокислой меди, указано в предыдущем опыте, может пройти побочная реакция образования избытка гидроксида меди (II) Сu(ОН)2 и частично оксида меди (II) СuО черного цвета. При окислении реактивом Фелинга сегнетова соль связывает избыток гидроксида меди (II) Сu(ОН)2 и основная реакция окисления глюкозы протекает быстрее и более четко. Окисление реактивом Фелинга служит качественной реакцией на глюкозу. Реактивы и материалы: глюкоза, 0,5%-ный раствор; нитрат серебра, 0,2 н. раствор; аммиак, 2 н. раствор; едкий натр, 2 н. раствор. В пробирку помещают каплю раствора нитрата серебра, 2 капли раствора едкого натра и приливают по каплям раствор аммиака до растворения образовавшегося осадка гидроксида серебра. Затем добавляют 1 каплю раствора глюкозы и слегка подогревают содержимое пробирки над пламенем горелки до начала почернения раствора. Дальше реакция идет без нагревания, и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налета. Химизм процесса: Моносахариды легко окисляются, причем в зависимости от условий получаются разнообразные продукты окисления. При осторожном окислении альдоз в кислой или нейтральной среде образуются альдоновые кислоты(одноосновные многоатомные оксикислоты). Кетозы (например, фруктоза) в этих условиях не окисляются. При окислении моносахаридов в щелочной среде происходит их глубокое расщепление с образованием ряда продуктов, в том числе очень легко окисляющихся. Поэтому моносахариды являются сильными восстановителями. При окислении моносахаридов в щелочном растворе не удается выделить продукты окисления с тем же числом углеродных атомов (как альдоновые кислоты при окисления альцоз в кислой среде). Подобно альдегидам, моносахариды восстанавливают аммиачный раствор оксида серебра с образованием осадка металлического серебра («серебряного зеркала»). Эту реакцию дают как альдозы, так и кетозы. Окисление оксидом серебра в щелочной среде служит качественной реакцией на моносахариды. Примечание. Пробирку для опыта необходимо тщательно вымыть (обезжирить) — прокипятить со щелочью и промыть водой. Если стенки пробирки грязные, то металлическое серебро выделяется в виде черного осадка. Реактивы и материалы: сахарат меди, раствор. Раствор сахарата меди осторожно нагревают до кипения над пламенем горелки, держа пробирку так, чтобы нагревалась только верхняя часть раствора. Сахароза в этих условиях не окисляется, что указывает на отсутствие в ее молекуле свободной альдегидной группы. источники: http://chem-ege.sdamgia.ru/problem?id=10129 http://topuch.ru/metodicheskie-ukazaniya-po-vipolneniyu-laboratornih-rabot-po-k-v2/index6.html |
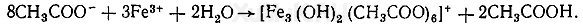
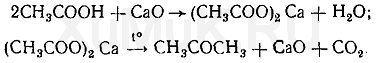
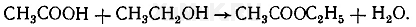








 Эта реакция представляет большой интерес и используется в клинической практике для определения молочной кислоты (как патологического продукта) в желудочном соке.
Эта реакция представляет большой интерес и используется в клинической практике для определения молочной кислоты (как патологического продукта) в желудочном соке.









