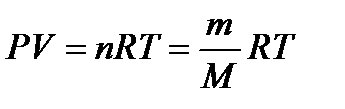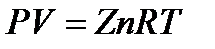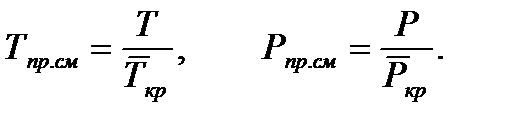6.2. Уравнения состояния реального газа
Наиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса:
(P + a/ n 2 )·( n – b) = R·T . (6.3)
а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул.
a/ n 2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения (например, для воды при 20 0 С составляет 1050 Мпа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/ n 2 внешнее давление легко изменяет их объем.
Уравнение Ван-дер-Ваальса качественно верно отображает поведение жидких и газообразных веществ, для двухфазных состояний оно неприменимо.
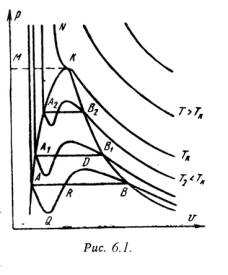
На PV – диаграмме (рис.6.1) показаны изотермы построенные по уравнению Ван-дер-Ваальса. Из кривых видно, что при сравнительно низких температурах имеются волнообразные участки. Чем выше температура, тем короче эти части кривых. Эти волнообразные кривые указывают на непрерывный переход от жидкого состояния в парообразное при данной температуре. Точка А соответствует состоянии жидкости, точка В относится парообразному состоянии вещества.
В действительности переход из жидкого состояния в парообразное всегда происходит через двухфазное состояние вещества. При этом при данной температуре процесс перехода происходит также и при постоянном давлении. Этот действительный переход из жидкого состояния в парообразное изображается прямой линией АВ.
Практически для особо чистых веществ возможно осуществление участков волнообразной кривой AQ и DB. В первом случае имеют место неустойчивые состояния перегретой жидкости, а во втором – переохлажденного пара.
При определенной температуре изотерма уравнения Ван-дер-Ваальса не будет иметь волнообразного участка (точка К). Эту температуру называют критической. Если соединить точки А1, А2, А3 … и В1, В2, В3 . получим кривую похожую на параболу. Кривая АК называется нижней пограничной кривой и соответствует в состоянии кипения жидкости. Кривая КВ называется верхней пограничной кривой и соответствует состояния сухого насыщенного пара.
Таким образом, для реального вещества PV – диаграмму можно разбить на 3 области:
1 — область жидкого состояния, расположена левее нижней пограничной кривой;
2 — область двухфазных состояний (влажный пар), расположена между нижней и верхней пограничной кривой);
3 – область перегретого пара, расположена правее верхней пограничной кривой и выше критической точки. Условно область жидкости ограничивают сверху линией КМ – критическая изобара.
Критическую температуру Д.И.Менделеев называл абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю, т.е. исчезает различие между жидкостью и парообразным состоянием вещества (насыщенным паром).
Связь между критическими параметрами и постоянными уравнения Ван-дер-Ваальса:
Уравнение Ван-дер-Ваальса при больших плотностях газа дает значительные ошибки. Кроме этого экспериментальным путем доказана, что коэффициенты а, b зависят от температуры и давления, причем эта зависимость очень сложная.
М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реальных газов с учетом ассоциации и диссоциации их молекул, который имеет следующий вид:
(P + a/ n 2 )·( n – b) = R·T (1 – С/( n ·Т (3+2m)/2 ), (6.6)
С, m – постоянные, определяемые на основании опытных данных.
Уравнение состояния вещества
Параметры состояния связаны друг с другом. Соотношение, при котором определяется данная связь, называют уравнением состояния данного тела. В самом простом случае равновесное состояние тела определяется значением следующих параметров: давления p , объема V и температуры (масса тела или системы, как правило, известна).
Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
Уравнение состояния идеального газа запишем несколько раз ( 2 ) , ( 3 ) , ( 5 ) :
p V = m μ R T = ν R T ( 2 ) .
Уравнение ( 2 ) – уравнение Менделеева-Клапейрона, где m – это масса газа, μ – это молярная масса газа, R = 8 , 31 Д ж м о л ь · К – это универсальная газовая постоянная, ν – это число молей вещества.
где N – это количество молекул газа в массе m , k = 1 , 38 · 10 — 23 Д ж К , постоянная Больцмана, определяющая «долю» газовой постоянной, которая приходится на 1 молекулу и
N A = 6 , 02 · 10 23 м о л ь — 1 – это постоянная Авогадро.
Если поделить в ( 4 ) обе части на V , то получаем следующий вид записи уравнения состояния идеального газа:
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
p + a V μ 2 V μ — b = R T ( 6 ) ,
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
b = N A 2 3 πd 3 ( 7 ) ,
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
a = — 2 πN A 2 ∫ d ∞ W p ( r ) r 2 dr ( 8 ) ,
где W p ( r ) – это потенциальная энергия притяжения 2 -х молекул.
При увеличении объема значение поправок в уравнении ( 6 ) становится менее существенным. И в пределе уравнение ( 6 ) превращается в уравнение ( 2 ) . Это согласовано с тем фактом, что с уменьшением плотности реальные газы по своим характеристикам приближаются к идеальным.
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
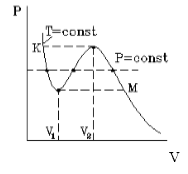
На рисунке 1 представлена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T , которая построена из соответствующего уравнения.
В месте “извилины” (участок КМ) изотерма 3 раза пересекает изобару. На участке
V 1 , V 2 давление увеличивается с ростом объема.
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
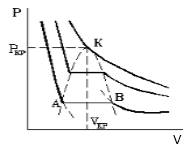
С увеличением температуры участок двухфазных состояний на изотермах уменьшается до тех пор, пока не превращается в точку (рисунок 2 ). Это особая точка К , в которой исчезает разница между жидкостью и паром. Ее называют критической точкой.
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
Необходимо найти величину n . В процессе, представленном на рисунке 3 , давление p
Из графика, приведенного на рисунке 3 , запишем уравнение процесса в параметрах p ( V ) :
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Моль кислорода охлаждают до — 100 ° C . Необходимо определить давление, которое оказывает газ на стенки сосуда, если занимаемый газом объем V = 0 , 1 л . Необходимо также сравнить p с давлением идеального газа p i d , если бы кислород вел себя как идеальный газ. Величина постоянных Ван-дер-Ваальса a и b , для кислорода a = 0 , 1358 П а · м 6 / м о л ь 2 , b = 3 , 167 · 10 — 5 м 3 / м о л ь .
Из уравнения Ван-Дер-Ваальса имеем:
p = R T V μ — b — a V μ 2
Переведем температуру в систему измерения: T = t + 273 , По условию T = 173 K , V = 0 , 1 л = 10 — 4 м 3 .
Произведем расчет: p = 8 , 31 · 173 ( 10 — 3 , 2 ) · 10 — 5 — 0 , 1358 ( 10 — 4 ) 2 = 75 , 61 · 10 5 ( П а ) .
Для идеального газа:
Рассчитаем: p i d = 1 · 8 , 31 · 173 10 — 4 = 143 · 10 5 ( П а ) .
Уравнение состояния идеального и реального газа.
Уравнение состояния идеальных газов.аналитическая зависимость между основными параметрами состояния газа (объем, давление и температура). Уравнением состояния идеальных газов называют уравнение Менделеева-Клапейрона или Клапейрона-Менделеева,
где Р – абсолютное давление, Па; V – объем занимающий газом, м 3 ; n – число киломолей газа; m – масса вещества; М – молекулярная масса; Т – абсолютная температура, К; R – универсальная газовая постоянная, 8314,3 Дж/(кмоль∙К).
Универсальная газовая постоянная – это работа расширения одного моля газа при нагревании на один градус при постоянном давлении. В системе СИ измеряется Дж/(моль*К) и равняется 8,3143.
Уравнение состояния реальных газовДля описания поведения природных газов во время добычи, переработки и транспортировки, при давлениях выше атмосферного, наиболее широко в отрасли используется следующее уравнение:
где Z – безразмерный коэффициент сферхсжимаемости газа, который вводится в уравнение состояния идеального газа, для того чтобы учитывать отклонение реального газа от законов идеального.
7. Критические параметры газа: Ткр , Ркр .
Критическим состоянием вещества (газа) является такое состояние, при котором исчезает граница между его газовой и жидкой фазой и свойства этих фаз становятся равными друг другу.
Критические параметры газа.Критической называется такая температура, выше которой, при любом давлении, газ не может быть переведен в жидкое состояние. Давление, необходимое для сжижения газа при критической температуре, называется критическим.Приведенные параметры газа.Приведенными параметрами называют безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (давление, температура, плотность, удельный объем) больше или меньше критических:
Дата добавления: 2016-12-27 ; просмотров: 5564 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/uravnenie-sostojanija-veschestva/
http://poznayka.org/s77616t1.html