Тема 5. Термодинамика потока
5.1. Первый закон термодинамики для потока
На практике при рассмотрении рабочих процессов машин, аппаратов и устройств, встречаются задачи изучении закономерностей движения рабочих тел (газов, пара и жидкостей).
Уравнение 1-го закона термодинамики для потока газа при следующих допущениях:
- движение газа по каналу установившееся и неразрывное;
- скорости по сечению, перпендикулярному оси канала, постоянны;
- пренебрегается трение частичек газа друг другу и о стенки канала;
- изменение параметров по сечению канала мало по сравнению их абсолютными значениями,
q = D u + D e + lпрот. + lтехн. , (5.1)
где D e = (w 2 2 – w 2 1)/2 + g·(z2 –z1) – изменение энергии системы,
состоящий из изменения кинетической и потенциальной энергий;
w1 ,w2 – скорости потока в начале и в конце канала;
z1 , z2 – высота положения начала и конца канала.
- lпрот. = P2· n 2 – P1· n 1– работа проталкивания, затрачиваемая на движения потока;
- lтехн. – техническая (полезная) работа (турбины, компрессора, насоса, вентилятора и т.д.).
Введем понятия энтальпии, который обозначим через величину:
Тогда уравнение 1-го закона термодинамики для потока газа будет иметь вид:
Первый закон термодинамики
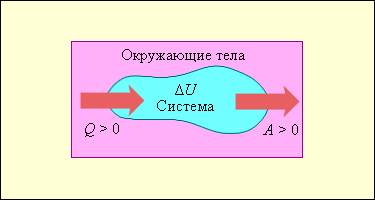
На рисунке 3 . 9 . 1 условно проиллюстрированы энергетические потоки между выделенной термодинамической системой и окружающими телами. В случае, если тепловой поток направлен к термодинамической системе, то некоторая величина Q > 0 , если же система совершает положительную работу над окружающими ее объектами, то справедливо неравенство A > 0 .
Рисунок 3 . 9 . 1 . Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы.
Состояние системы меняется, когда происходит процесс ее обмена теплом с окружающими объектами, и она совершает положительную или отрицательную работу. Изменяются макроскопические параметры системы, такие как температура, объем и давление. По причине того, что внутренняя энергия U всецело определяется макроскопическими параметрами, которые характеризуют состояние системы, процессы совершения работы и теплообмена провоцируют изменения внутренней энергии данной системы Δ U .
Определение 1 -го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
Изменение Δ U внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q , переданной системе, и работой A , совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая Δ U своей внутренней энергии.
Первый закон термодинамики в процессах газов
Первый закон термодинамики может применяться к изопроцессам в газах.
В изохорном процессе, то есть в условиях неизменного объема ( V = c o n s t ) , газ не совершает работы, A = 0 .
В этом случае справедливой будет формула внутренней энергии газа:
Q = ∆ U = U ( T 2 ) — U ( T 1 ) .
В данном выражении U ( T 1 ) и U ( T 2 ) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло ( Q > 0 ) , чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам ( Q 0 ) .
В изобарном процессе, предполагающем постоянность значения давления ( p = c o n s t ) , работа, совершаемая газом, выражается в виде соотношения:
A = p ( V 2 — V 1 ) = p ∆ V .
Первый закон термодинамики для изобарного процесса дает:
Q = U ( T 2 ) — U ( T 1 ) + p ( V 2 — V 1 ) = ∆ U + p ∆ V .
При изобарном расширении Q > 0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q 0 тепло переходит внешним телам. В таком случае A 0 . При изобарном сжатии уменьшаются температура газа T 2 T 1 и значение внутренней энергии Δ U 0 .
В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, Δ U = 0 .
Первый закон термодинамики для изотермического процесса выражается соотношением
Теплота Q , приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
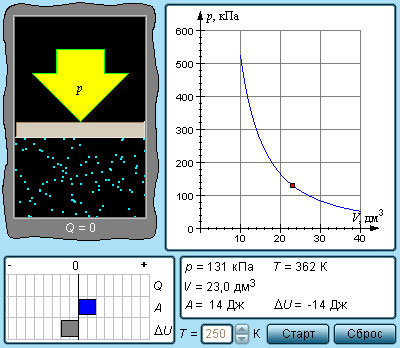
Рисунок 3 . 9 . 2 . Модель адиабатического процесса.
В адиабатическом процессе Q = 0 . По данной причине первый закон термодинамики принимает вид:
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Расширение или сжатие газа на плоскости p , V проиллюстрирована кривой, называемой адиабатой.
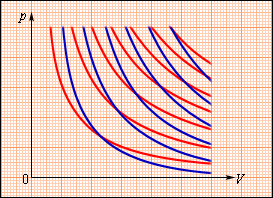
В процессе адиабатического расширения газом совершается положительная работа A > 0 , что является причиной понижения значения внутренней энергии Δ U 0 . Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом (рис. 3 . 9 . 3 ).
Рисунок 3 . 9 . 3 . Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
В условиях координат ( p , V ) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
p V γ = c o n s t .
Данное выражение, в котором γ = C p C V – показатель адиабаты, C p и C V – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ = 5 3 = 1 , 67 , двухатомного γ = 7 5 = 1 , 4 , многоатомного γ = 1 , 33 .
Работа газа в адиабатическом процессе выражается через температуры начального T 1 и конечного T 2 состояний и принимает вид:
A = C V ( T 2 — T 1 )
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу Δ Q T . Так как на каждом участке адиабатического процесса Δ Q = 0 , энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
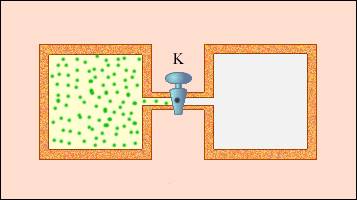
Примером неквазистатического процесса, в котором промежуточные состояния не находятся в состоянии равновесия, служит расширение газа в пустоту. На рисунке 3 . 9 . 3 иллюстрируется жесткая адиабатическая оболочка, состоящая из двух разделенных вентилем K сообщающихся емкостей. В изначальном состоянии газом заполнен один из сосудов, в это же время во втором находится лишь вакуум. Открытие вентиля запускает процесс расширения газа. Он заполняет оба сосуда, и устанавливается новое равновесное состояние.
В таком процессе Q = 0 , по той причине, что исключен теплообмен с окружающими телами, и A = 0 , так как оболочка недеформируема. Первый закон термодинамики позволяет сказать, что Δ U = 0 , то есть внутренняя энергия газа не претерпела никаких изменений. Так как внутренняя энергия идеального газа зависит лишь от температуры, температура газа в начальном и конечном состояниях одинакова. Изображающие эти состояния точки на плоскости ( p , V ) лежат на одной изотерме. Все промежуточные состояния газа не являются равновесными и не могут быть изображены на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Рисунок 3 . 9 . 4 . Расширение газа в пустоту.
Уравнение первого закона термодинамики для потока
Трубопровод I, рабочая скорость C1, термомеханический захват и др.).Здесь каждый килограмм рабочей жидкости в общем случае может получать бот от внешнего источника, например, для привода ротора турбины, а затем выводится через выхлопную трубу 3 со скоростью КП. С параметрами Tk, p>,»». Если мысленно вычленить замкнутый объем рабочего тела в потоке и наблюдать изменение параметров во время движения, то для первого закона термодинамики в приведенных выше термодинамических соотношениях, особенно в обычной системе счисления-p = D++.
Так как внутренняя энергия является функцией состояния рабочего тела, то величина и>определяется параметром рабочего тела на входе (сечение потока/), а величина аз определяется параметром рабочего тела при выходе из агрегата (сечение / I). Работа расширения I осуществляется по границе выбранного подвижного объема, то есть рабочей жидкости на стенках и границах блока. Часть стенок агрегата неподвижна, а работа расширения их стенок равна нулю. Другие части стенки стали специально подвижными(рабочие лопатки турбин и компрессоров, поршни поршневых машин), рабочая жидкость выполняет на них технические работы На входе, рабочая жидкость нажата в unit.
To сделайте это, преодолев давление p>. Так как P| = const 1.Каждый килограмм рабочего тела может занять объем только за счет работы Чтобы попасть в трубопровод 3, рабочая жидкость должна преодолеть давление pg и вытеснить оттуда такое же количество рабочей жидкости, которое было там раньше. Если скорость на выходе sv больше C|на входе, то часть работы расширения расходуется на увеличение кинетической энергии рабочего тела в потоке, равной 4/2-C1 / 2. Некоторая работа может быть потрачена на преодоление трения.
Позже +(Р2 «2- / М’|) + (5-2) Теплота, передаваемая каждому килограмму рабочей жидкости при ее прохождении через агрегат, представляет собой сумму теплоты P,, которая подводится извне, и теплоты pg, подводимой через работу трения внутри агрегата. п — = пп-Эс + СН. Подставляя полученные значения 4 и I в уравнение первого закона термодинамики, получаем: 4..- НГГ = «г-i₁+ а» +p₃og—₽! «, + + 4 / 2-4 / 24- ^ Для трения теплота равна работе трения ( ^ , p = Lp), а o + p0 = H. градация П..= ,,-,, +(..
- Это выражение первого закона, который можно сформулировать следующим образом: нагрев, вносимый в поток рабочей жидкости извне и расходуемый на увеличение энтальпии рабочей жидкости, выполнение технических работ и увеличение кинетической энергии. В дифференциальной форме, уравнение 6?, И. = Аристотель(Л+^^,+ Аристотель(с/ 2).(5.4) То же самое верно и для равновесия, заданного трением. Как упоминалось выше, против замкнутого объема рабочей жидкости указано. Если поток выделен, то к ним применяется выражение первого закона термодинамики замкнутой системы. bd = 6p, m ^ + 6nn = 11k —параметры откуда 6 Аристотель 7,^ ^ = Л-syr-6/, ₀.
Если сравнить эту формулу с формулой (5.4), то получим-o Аристотель/ p = 6/, + + A (cn / 2)+61. 5 иАристотельгр = ФАристотельХ + Размер oyr Задержкой Р._ раме(рис. 5.2) представлена заштрихованной области. Примените первый закон термодинамики к различным типам тепловых машин. Теплообменник (устройство, в котором тепло от жидкой или газообразной среды передается в другую среду). в его случае n = 0, и (4-1- (5.5) Следует подчеркнуть, что для теплообменника, установленного в потоке, эта формула справедлива не только в изобарном процессе, но и в тех процессах, где существует трение, где давление среды снижается за счет сопротивления. Тепловой двигатель.
Обычно с кем?— a u. msh = 0, следовательно、 Оценка уменьшения энтальпии: (5.6) да.- y. th и….. У1-значение л. р и о л и- Интегральное уравнение (2.27) otp, максимум p₂ и / / pm » к ia в случае w = 0、 (5.7) При сравнении формул (5.6)и (5.7)、 — Кровать; 61п Следовательно, с?-4 ″ 0,Аристотель? C — » если w = 0 и нет потерь на трение, то технический Работа равна имеющимся, а затененные тени показаны на рисунке. 5.2. It всегда есть возможность подводить и отводить воздуховоды. И затем…
В отличие от предыдущего случая, где / / Аристотель а, то есть техническая работа изолирующего компрессора затрачивается на увеличение энтальпии gas. In в случае недиабетической компрессии она компенсируется на 5,6 грн. Сопло и диффузор. Специально профилированные каналы называются в О-Л И М и для ускорения рабочей среды и придания определенного направления потоку. Канал предназначен для ограничения потока и повышения давления В них технические работы не проводятся, поэтому приводится формула (5.4 си.»»=^г + Аристотель/(С2/ 2). С другой стороны, для объема рабочего тела, движущегося в потоке без закона термодинамики замкнутой системы, возьмем w = Аристотель2nd-odr.
Если мы приравняем правую часть последнего уравнения, то получим: (5.10) Из (5.10) видно, что ac и ap всегда имеют противоположный знак. Результат. Увеличение расхода, снижение давления в нем* ((/p Аристотель0).И наоборот, замедление потока (yc Аристотель0) сопровождается повышением давления(4 ″ 0). Теплопередача между стенкой канала и средой за такое короткое время контакта очень мала, поскольку длина сопла и диффузора коротка, а расход среды в нем очень велик high.
В большинстве случаев это пренебрежимо мало, и процесс оттока можно рассматривать как адиабатический (r. «0»). в этом случае формула (5.3) имеет вид(Аристотель^-4)/ 2 −5、-Он принимает форму Λ. В результате ускорение адиабатического потока происходит за счет уменьшения энтальпии, а замедление потока вызывает его увеличение.




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://zaochnik.com/spravochnik/fizika/termodinamika/pervyj-zakon-termodinamiki/
http://lfirmal.com/uravnenie-pervogo-zakona-termodinamiki-dlya-potoka/