Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
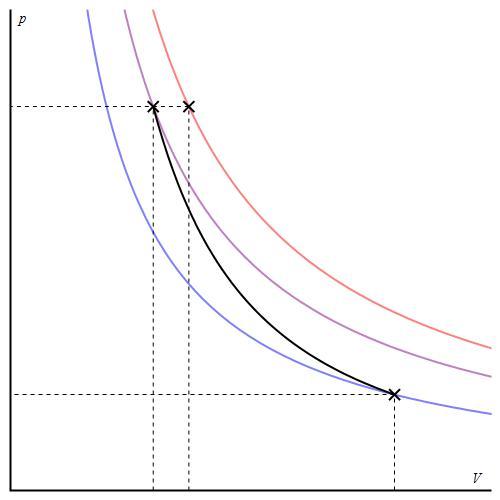
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
1. Уравнение состояния газа Ван-дер Ваальса
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
1. Уравнение состояния газа Ван-дер Ваальса
1. Реальный газ отличается от идеального.
Уравнение состояния идеального газа – приближенно:
1) М.В.Ломоносов еще в XVIII в. указывал, что давление, обусловленное ударами о стенку хаотически движущихся молекул, не будет подчиняться закону Бойля 

2) как мы знаем из теоремы Нернста, и при низких температурах 

3) существуют и другие количественные и качественные нарушения уравнения Клайперона-Менделеева 
Основной причиной наблюдаемых отличий реальных газов от идеальных является наличие сил взаимодействия между молекулами реальных газов .
Силы взаимодействия можно классифицировать следующим образом:
а) химические или валентные, если возникло новое соединение;
б) кулоновские силы притяжения и отталкивания, если газ ионизирован
(плазма — квазинейтральный ионизированный газ);
в) молекулярные силы 
Именно они нас и будут интересовать. Это силы притяжения между молекулами на “больших” расстояниях 
( 
Если в отсутствии внешних полей центры положительных и отрицательных зарядов не совпадают, то такие молекулы называются полярными.
Если электронная оболочка симметрична и центры положительных и отрицательных
зарядов в молекуле совпадают, то мы имеем дело с неполярными молекулами.
Под действием электрического поля
а) неполярные молекулы поляризуются за счет деформации электронной оболочки;
б
Вокруг каждой поляризованной молекулы возникает быстро убывающее с радиусом электрическое поле 
Если в поле 
П




Энергия взаимодействия 





Аппроксимация (от лат. approximo–приближаюсь) –приближенное выражение какого-либо математическкого объекта через другие более простые.
Потенциал Леннарда-Джонса используется в теории газов и дает хорошее совпадение с экспериментом для реальных газов.
2. Модель: В простейшей теории используется ещё более грубая пунктирная аппроксимация,
соответствующая следующей модели:
1) Газ состоит из твердых упругих шариков диаметром 
2) Молекулы-шарики притягиваются на расстоянии 


3. Учёт притяжения.
Из-за взаимного притяжения между молекулами газ как бы сжимается эффективно большим давлением, чем давление 
Величина этой положительной добавки к 
молекул, содержащихся в единице объема каждого из взаимодействующих объемов 





4. Учет отталкивания.
Учтем силы отталкивания в рамках предложенной модели, предполагая существование объема недоступного для движения молекул вследствие конечности их размера 
П


Если у нас 1 моль, то объем, доступный движению молекул, 

5. Уравнение Ван-дер-Ваальса.
Тогда подправим уравнение состояния одного моля идеального газа, написав
уравнение состояния для 1 моля газа Ван-дер-Ваальса:

где 

Если у нас не один моль, а 

Еще раз о смысле каждой скобки, 



6. Качественные вопросы
1) Изобразим изохору реального газа в координатах
То есть для реального газа увеличение температуры при постоянном объеме вызывает более резкий рост давления, чем для идеального газа:



2) Изобразим изобару в координатах
T При


2. Внутренняя энергия газа Ван-дер-Ваальса
1. Внутренняя энергия В-д-В газа


При расширении работа, совершаемая силами притяжения молекул газа, равна убыли его потенциальной энергии, связанной с притяжением молекул:

2. Задача об убранной перегородке для реального газа .
а) Для идеального газа:

б) Для Ван-дер-Ваальсовского газа:
То есть с увеличением объема
3. Эффект Джоуля-Томпсона
В

Отв. Для идеального газа температура не изменится, а для реального газа будет наблюдаться эффект Джоуля- Томпсона.
а) Если 


Газ охлаждается, так как при расширении внутренняя энергия расходуется на работу против сил молекулярного притяжения. Этот эффект используется для ожижения газов и получения низких температур.
б) При 
Отрицательный эффект Джоуля-Томпсона реализуется для 


Для общего развития: 
где 
3. Теплоемкость газа Ван-дер Ваальса
Здесь 
Проведем расчет теплоемкости для одного моля реального газа при различных процессах:
1) Изохорический 


2) Адиабатический 

3)
4)
Найдем 


т.о. 
4. Уравнение адиабаты для газа Ван-дер- Ваальса


5. Энтропия газа Ван-дер Ваальса
1)

2) Как измениться энтропия газа в задаче об убранной перегородке:
То есть
6. Уравнение политропы В-д-В газа
Уравнение адиабаты для В-д-В газа:
Для идеального газа уравнение адиабаты:
По аналогии естественно предположить, что для В-д-В газа уравнение политропы будет иметь вид:



или уравнения политропы В-д-В газа, здесь 
7. Изотермы Ван-дер-Ваальса

М
в) Изотермы, построенные в координатах (P,V), дают наиболее содержательные результаты.
Найдем особые точки изотермы, вычислив 
Найдем корни этого уравнения:



Т.о. чем 


В точке К с параметрами 

К понятию критического состояния можно придти путем анализа экспериментальной изотермы без рассмотрения какого-либо теоретического уравнения состояния. Уравнение В-д-В является лишь модельным, и не все состояния, совместимые с уравнением В-д-В, могут быть реализованы. Реализованы могут быть только устойчивые состояния.
Одно из необходимых условий термодинамической устойчивости однородного вещества:
Оно означает, что при изотермическом увеличении давления 


Участки AC и BD соответствуют разным фазовым состояниям вещества.
8. Экспериментальные изотермы реального газа
В изучение этого вопроса значительный вклад внесли следующие исследователи: Ван Марум (1750-1837), Фарадей (1791-1867), Эндрюс (1813-1885).
Опред. В термодинамике фазой называется совокупность однородных, одинаковых по
свойствам частей системы .
Различают следующие фазы: газообразная, жидкая, различные кристаллические
Разные фазы могут существовать в равновесии друг с другом.
Переход вещества из одной фазы в другую называется фазовым переходом.
Существуют фазовые переходы:
жидкость 
газ 
жидкость 
Фазовый переход I рода сопровождается выделением/поглощением тепла.
твердая фаза 
резистивное состояние 
обычная жидкость 
При фазовых переходах II рода нет выделения/поглощения тепла .
Р

На участке EF жидкость и газ находятся в термодинамическом равновесии (т.д.р.)
Условия термодинамического равновесия фаз :
Таким образом мы распространили уравнение Ван-дер Вальса на область жидкого состояния, где оно вообще-то не применимо.
Газ, находящийся в равновесии с жидкостью, называется насыщенным паром .
Вопр.: Какая разница между паром и газом?
Отв. Пар – это газ, который может быть превращен в жидкость изотермически .
Пар – это газ с температурой ниже критической.
В значительной степени двойственная терминология обусловлена исторически: те газы, которые могли быть превращены в жидкость, называли парами, а те, которые ожижить не удавалось, — газами. Когда все газы сжижили, то необходимость в различии названий отпала.
В 

Из т.1 
Из т.2
Из т.3
На самом деле 
следовательно, вещество внизу ампулы должно заметно уплотняться вследствие
гравитации, поэтому благодаря сильному изменению плотности вещества с высотой,
в ампуле иметь критическую плотность может только бесконечно тонкой слой вещества.
В нем и происходит исчезновение мениска. В этом заключается суть метода мениска для
измерения критической температуры 
В критической точке вещество обладает необычными свойствами:
1) бесконечной сжимаемостью;
2)
3
Метастабильные участки AE и BF могут существовать:
BF соответствует пересыщенному пару, который может быть получен при резком адиабатическом расширении.
EA соответствует перегретой жидкости, она может быть получена резким уменьшением давления. Это – физически однородная жидкость, в которой нет растворенного газа.
Горизонтальный участок изотермы EF определяется правилом Максвелла: 
Рассмотрим цикл 

Вопр.: Рассмотрим два цикла 



Отв.: 1) Для цикла 


2) Для цикла 


состояние не может перейти в однофазное. В обратную сторону перход возможен, но при этом 
К




9. Уравнение Клайперона-Клаузиуса. Диаграмма состояния
1234 – цикл Карно с изотермическим реальным газом.

Тангенс угла наклона кривой испарения и
сублимации всегда больше нуля,
следовательно, угол наклона соответствующих кривых меньше 
Для плавления это может быть не так (
Диаграмма фазовых переходов
Три фазы одного и того же вещества могут существовать в равновесии только в
одной точке, то есть при единственных значениях 
Р
Параметры критичного состояния для 


10. Другие уравнения реальных газов




Уравнение Ван-дер Вальса имеет преимущества вследствие легко объяснимого физического смысла параметров. Его-то и надо уметь пояснять.
Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.
Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 o C?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 o C.
http://gigabaza.ru/doc/100413.html
http://fb.ru/article/459587/adiabaticheskiy-protsess-i-uravneniya-adiabatyi-dlya-idealnogo-gaza-primer-zadachi