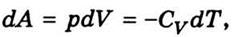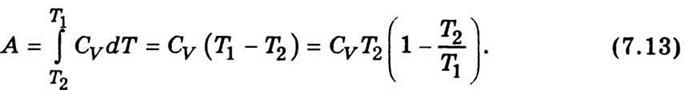Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
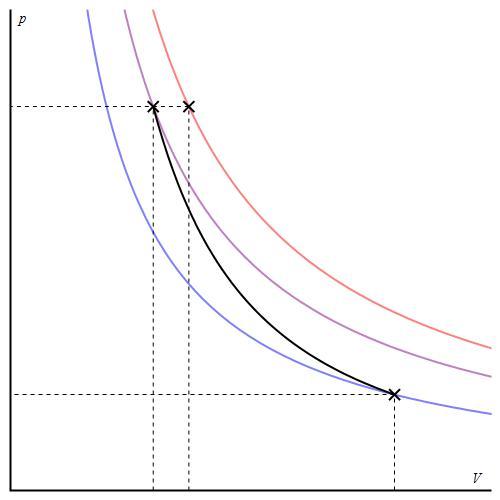
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
Адиабатный процесс. Изопроцессы в термодинамике
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы будем работать с уже известными нам физическими понятиями, но в несколько иной области применения. А именно с изопроцессами в термодинамике. Мы рассмотрим, какие изменения в первый закон термодинамики (закон сохранения энергии в тепловых процессах) внесут протекания этих самых процессов при неизменном макроскопическом параметре газа. Также мы рассмотрим новый, ранее неизвестный процесс – адиабатный.
Уравнение адиабаты идеального газа в переменных
7.5. Адиабатический процесс. Уравнение адиабаты
Адиабатическим называют процесс, который происходит без теплообмена системы с окружающей средой. Для осуществления адиабатического процесса надо окружить систему такой оболочкой, которая не пропускает теплоты, но мешает тому, чтобы система выполняла работу или работа выполнялась над системой. Такую оболочку называют адіабатичною. Примером оболочки, близкой к адиабатической, может быть оболочка из плохого проводника теплоты. При адиабатическом процессе система обменивается энергией со средой только в результате работы, при этом она не получает и не отдает теплоты, т.е. Δ Q = 0. Первый принцип термодинамики для этого случая и бесконечно малых величин имеет вид
где dU — полный дифференциал; δ А — неполный дифференциал. Пусть моль идеального газа находится под поршнем. Закрепив поршень, повысим температуру газа на d Т. Поскольку объем газа остается постоянным, то количество теплоты, которая нужна для такого нагрева, равна С V d Т. А поскольку при этом не выполняется работа, то эта количество теплоты равно увеличению внутренней энергии газа dU = C V d Т .
Если начальное состояние ( T , V) будет таким же, что и в предыдущем опыте, но поршень не закреплен, а может свободно перемещаться при неизменном внешнем давления р, то газ будет выполнять работу δ А = р dV . Поскольку внутренняя энергия газа зависит только от температуры, то она меняется так же, как и в предыдущем случае.
Следовательно, при адиабатическом процессе система выполняет работу за счет внутренней энергии, которая связана с температурой. Изменение внутренней энергии при адиабатическом процессе приводит к изменения температуры системы. Учитывая, что Δ А = р ∆ V [см. формулу (7.2)] и Δ U =С V Δ Т, формула (7.10) наберет такого вид:
При адиабатическом расширении газа, когда увеличивается объем ( Δ V > 0), из формулы (7.11) видно, что температура снижается ( Δ T 0), т.е. газ охлаждается. Если же Δ V 0, то Δ Т > 0, т.е. газ нагревается. К вещи, свойство газов охлаждаться при расширении их в адіабатичних условиях положен в основу принципа действия холодильников. Следовательно, при адиабатическом процессе температура системы может варьироваться, хотя системе теплота не передается. Отсюда следует, что теплоемкость системы при адиабатическом процессе равна нулю. Однако ноль — это фиксированное число, а процесс, при котором теплоемкость остается постоянной, называют політропним. Поэтому адиабатический процесс является частным случаем політропного процесса, а именно таким політропним процессом, при котором теплоемкость равна нулю. Уравнение адиабаты идеального газа имеет такой вид:
где γ = Сг / С V — отношение теплоемкости газа при постоянном давлении и постоянном объеме. Уравнение (7.12) называют уравнением Пуассона . Из соотношения (7.11) получим выражение для работы, если система адиабатически переходит из одного состояния в другое:
Можно показать, что для адиабатического процесса
Заменив в (7.13) отношение температур отношением объемов согласно (7.14), получим выражение для работы при адиабатическом расширении идеального газа
http://interneturok.ru/lesson/physics/10-klass/osnovy-termodinamiki/adiabatnyy-protsess-izoprotsessy-v-termodinamike
http://na-uroke.in.ua/70-69.html