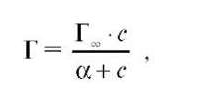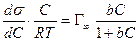Адсорбция газов на твердых телах.
Адсорбция газов твёрдыми телами протекает с большой скоростью, поэтому адсорбционное равновесие устанавливается практически мгновенно.
При взаимодействии газа с адсорбентом наряду с адсорбцией, представляющей собой типично поверхностный процесс, может происходить поглощение газа или пара всем объёмом твёрдого тела, а также их конденсация в узких порах. Поглощение вещества всей массой адсорбента называется абсорбцией. Переход поглощаемого газа или пара в жидкое состояние (и даже твёрдое) в узких порах адсорбента называется капиллярной конденсацией (пример – раствор водорода в платине – твёрдый раствор).
Хемосорбция часто протекает только на поверхности сорбента. Например, при поглощении кислорода алюминием на поверхности металла образуется тонка плёнка оксида алюминия. Адсорбция газа на твёрдом теле измеряется количеством газа, адсорбированным единицей массы твёрдого тела (моль/кг или моль/г).
Адсорбция зависит от температуры, давления и природы адсорбата, удельной поверхности и природы адсорбента. На поверхности твёрдого тела при прочих равных условиях лучше 
Адсорбция из растворов.
Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией. В результате адсорбции концентрация растворённого вещества в растворе уменьшается. Адсорбцию определяют по разности концентраций исходного и равновесного растворов адсорбата.
где 

В системах полярный растворитель – малополярный адсорбент – адсорбция ПАВ подчиняется правилу Дюкло-Траубе. При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращённое правило Дюкло-Траубе: с ростом длины углеводородного радикала адсорбция увеличивается.
В растворах сильных электролитов ионы адсорбируются лишь на полярных и практически не адсорбируются на неполярных адсорбентах. На положительно заряженных участках поверхности адсорбента адсорбируются из раствора анионы, на отрицательно заряженных – катионы. Адсорбционная способность ионов на данной поверхности возрастает с увеличением их заряда. Адсорбционная способность больше у тех ионов, радиус которых в сольватированном состоянии меньше.
Уравнение Ленгмюра (изотерма Лэнгмюра):
Для подвижных поверхностей раздела фаз
где Г — адсорбция, моль/г; Г∞ — предельная адсорбция: количество адсорбата, покрывающего поверхность адсорбента плотным монослоем. Характеризует адсорбционную способность адсорбента; α — константа адсорбционного равновесия, отражает способность адсорбата адсорбироваться; равна отношению констант скоростей десорбции и адсорбции; с — концентрация вещества в растворе, моль/л.
Для неподвижных поверхностей раздела фаз
Твёрдое тело — газ
где a – адсорбция при данных условиях, 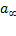

Твёрдое тело – раствор
где c – концентрация вещества в растворе.
Зависимость величины адсорбции от различных факторов. (уже сказано в предыдущих вопросах)
1. Природа фаз (предельная адсорбция, константа α). Кристаллические вещества адсорбируют хуже, чем аморфные. Лучше адсорбируются газы, которые легче конденсируются. Например, активированный уголь хорошо адсорбирует хлор (Ткип = 239,7 К), аммиак(Ткип = = 240 К), но не адсорбирует оксид углерода (II) (Ткип = 83 К), азот (Ткип = 77,0 К), водород (Ткип = = 20,0 К).
2. Давление. С увеличением давления адсорбция увеличивается до определённого значения.
3. Температура. Повышение температуры способствует понижению адсорбции и усилению десорбции.
Лекция 13. Адсорбция
13.1. Уравнение адсорбции Гиббса
Строгое определение понятия адсорбции по Дж. Гиббсу: адсорбцией данного компонента на границе раздела двух фаз называется разность между фактическим количеством этого компонента в системе и тем его количеством, которое было бы в системе, если бы концентрации в обеих сосуществующих фазах были постоянны вплоть до некоторой геометрической поверхности, разделяющей их.
Эта разность может быть положительной или отрицательной. Она обозначается символом G (гамма) и имеет размерность моль/м 2 . Эту величину называют избыточной адсорбцией по Дж. Гиббсу.
Хотя в приведенном определении адсорбция отнесена к геометрической поверхности, не имеющей толщины (что удобно при выводе уравнений), фактически граница между фазами представляет собой очень тонкий слой (поверхностный слой), в котором все свойства отличаются от свойств объемных фаз и изменяются не скачкообразно, а непрерывно.
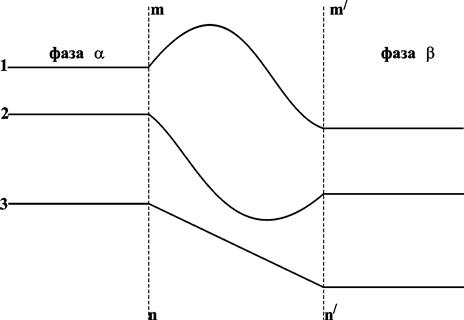
На рис. 13.1 показано возможное изменение концентрации вблизи границы раздела: концентрация компонента может быть как выше концентраций в обеих фазах (1), так и ниже (2) или иметь промежуточное значение. Эта область может рассматриваться как поверхностный слой. Таким образом, изучая границу раздела фаз, нужно рассматривать состояние трех фаз: двух объемных и одной поверхностной.
Рис. 13.1. Изменение концентрации компонентов у границы раздела фаз;
поверхностный слой – mn-m’n’
Уравнение, устанавливающее связь между всеми параметрами процесса адсорбции – величиной поверхностного натяжения s, концентрацией компонента [C] в одной из фаз, его адсорбцией Г, было выведено Дж. Гиббсом в 1876 г. Это уравнение является общим термодинамическим уравнением, справедливым для любых составов и природы поверхности раздела фаз.
Рассмотрим систему, состоящую из двух компонентов 1 и 2 и двух фаз a и b, разделенных поверхностью раздела с площадью S. Общее число молей каждого компонента в системе равно n1 o и n2 o . Если считать, что поверхностный слой не имеет толщины, т.е. представляет собой геометрическую поверхность, то обе объемные фазы будут иметь постоянный состав вплоть до этой геометрической поверхности. Обозначим число молей каждого компонента в каждой из этих фаз соответственно через n1 a ,n1 b ; n2 a ,n2 b . Так как на поверхности имеет место адсорбция, то, очевидно, n1 o ¹ n1 a + n1 b и n2 o ¹ n2 a + n2 b .
По вышеприведенному определению адсорбция каждого компонента Г1 и Г2 , отнесенная к единице площади поверхности, равна
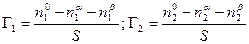
Чтобы найти Г1 и Г2, напишем уравнение энергии Гиббса для двух фаз a и b в отдельности и для всей системы в целом. В последнем случае, очевидно, нужно включить в уравнение член sdS:
dG o = — S o dT + V o dP + sdS + m1dn1 o + m2dn2 o . (13.2)
Укажем на уравнение Гиббса-Дюгема, которое устанавливает связь между химическими потенциалами:
dG = — S dT + VdP + Smidn1 (P, T – постоянные). (13.3)
Тогда для бинарной системы получим
Интегрируя это уравнение при постоянных значениях m1 и m2, получим
Из (13.4) и (13.6) вытекает, что
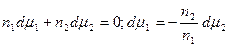
Это уравнение носит название уравнения Гиббса-Дюгема и связывает изменение химических потенциалов компонентов. Тогда с учетом уравнения Гиббса-Дюгема и поверхностных явлений получаем:
Сложение двух первых уравнений и вычитание полученной суммы из третьего дает
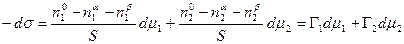
В качестве примера рассмотрим две конкретные системы: двухкомпонентный жидкий раствор, находящийся в равновесии со своим двухкомпонентным насыщенным паром, и твердое тело, находящееся в равновесии с однокомпонентным газом, совершенно не растворимым в этом твердом теле.
Поскольку в первом случае точное положение разделяющей геометрической поверхности несколько условно, то можно выбрать положение ее, при котором
Во втором случае вследствие нерастворимости газа в объеме твердого тела, объемные свойства этого тела, в частности его химический потенциал, не изменяются при адсорбции. Приписывая твердому телу индекс 1, имеем:
В обоих случаях получено одно и то же уравнение. Поэтому можно считать, что адсорбционное уравнение Гиббса имеет вид:
Оно является основным в учении о поверхностных явлениях.
Рассмотрим далее реальный раствор. Для реального раствора
где а – активность, тогда:
Подставив это значение в уравнение (13.12), получим:
ds = — Г Rt d lna,
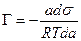
В разбавленных растворах а » С (где С – концентрация)
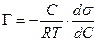
а для идеального или разреженного идеального газа
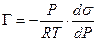
Уравнение (13.14) показывает, что если при адсорбции поверхностное натяжение s уменьшается с ростом концентрации С, т.е. ds/dC 0 и Г – отрицательно. Это соответствует поверхностно-инактивным веществам. Если известна зависимость s от С (т.е. изотерма поверхностного натяжения s = f(C) , то по уравнению Гиббса можно для каждого значения концентрации найти ds/dC и по уравнению Гиббса вычислить значение Г, т.е. построить изотерму адсорбции.
13.2. Обзор сорбционных явлений
Адсорбция на границе раздела твердое тело/газ. В общем случае явления, связанные с перераспределением веществ между различными частями гетерогенной системы, называются сорбцией. Сорбция (от лат. sorbeo – сгущать) – это изменение концентрации (часто увеличение) либо у поверхности раздела фаз (адсорбция), либо в объеме одной из фаз (абсорбция). Например, образование раствора за счет поглощения НСl (газа) и поглощение газа металлом (абсорбция). Поверхностная сорбция – адсорбция.
Твердое тело, у поверхности которого происходит адсорбция, называется адсорбентом, адсорбирующийся газ или адсорбирующийся компонент жидкого раствора – адсорбтивом, а адсорбированое вещество – адсорбат.
В строгом определении адсорбции она рассматривается как избыток вещества вблизи поверхности по сравнению с равным объемом вдали от нее. В ряде случаев удобнее рассматривать не избыток, а все количество адсорбата вблизи поверхности. Это количество обозначают символом а и называют полным содержанием, или просто адсорбцией (без указания гиббсова). Так как для пористых твердых тел бывает затруднительно знать величину поверхности, то часто адсорбцию относят не к единице поверхности, а к единице массы (моль/кг или моль/г).
Адсорбция самопроизвольна и протекает при Р = const со снижением энергии Гиббса, а при V = const – со снижением энергии Гельмгольца. Однако при этом происходит не выравнивание концентраций по всему объему системы, а увеличение разности концентраций между газовой фазой (раствором) и поверхностью. Одновременно уменьшается подвижность сорбирующихся молекул. Оба фактора ведут к уменьшению энтропии (DS o , так как DG o = DH o + TDS o ,
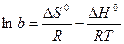
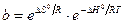
Таким образом, адсорбционный коэффициент b связан со стантартной энтропией DS° и со стандартной теплотой адсорбции q = –DH°.
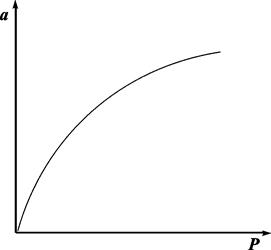
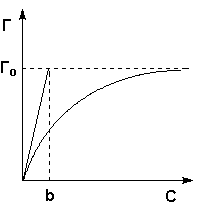
Очень часто аm называют «емкость монослоя». На рис.13.3 показана кривая, выражающая изотерму адсорбции по Ленгмюру
Рис. 13.3. Изотерма адсорбции по Ленгмюру
При очень малых заполнениях и, следовательно, очень малых давлениях Р в знаменателе, согласно (13.25), bр > 1 и а = аm, т.е. величина адсорбции перестает зависеть от давления, поскольку все центры уже заняты.
Для расчета параметров am и b уравнение Ленгмюра представляют в виде
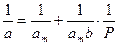
Тангенс угла наклона этой линии равен 1/amb, а отрезок, отсекаемый на оси ординат, равен 1/am.
Уравнение Ленгмюра, полученное на основании модели локализованной адсорбции газов на поверхности твердого тела, часто хорошо описывает адсорбцию растворенных веществ на поверхности жидкости (поверхность раздела раствор/газ), при которой адсорбция не локализована, так как молекулы подвижны и образуют двумерную газо- или жидкообразную пленку.
Обусловлено это тем, что основные положения модели Ленгмюра соблюдаются при адсорбции из растворов: поверхность жидкости идеально однородна, взаимодействие адсорбированных молекул в адсорбционном слое мало отличается от их взаимодействия в растворе. Оно к тому же ослаблено за счет взаимодействия молекул растворенного вещества с молекулами растворителя и практически не влияет на адсорбцию.
Уравнение Ленгмюра связано с уравнением состояния адсорбционной пленки – уравнением Гиббса. Так,
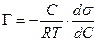
а по уравнению Ленгмюра
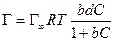
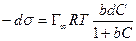
После интегрирования в пределах от sо до s и от 0 до С получим:
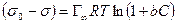
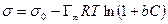
где Г¥ связано с площадью, занимаемой 1 моль адсорбированного вещества в мономолекулярном слое, следующим соотношением: 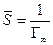
Дата добавления: 2016-02-09 ; просмотров: 2869 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Уравнение адсорбции твердое тело газ
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
4.1.3 Адсорбция на границе твердое тело – газ
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами – соответственно физическую и химическую адсорбцию.
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 – 80 кДж/моль). Таковой является, например, адсорбция инертных газов на угле.
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 – 120 кДж/моль, повышение температуры способствует её протеканию. Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
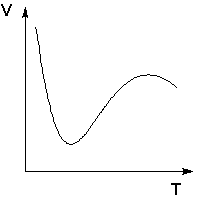
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум (рис. 4.4).
Рис. 4.4 Зависимость объема адсорбированного никелем водорода от температуры
При постоянной температуре количество адсорбированного вещества зависит только от равновесных давления либо концентрации адсорбата; уравнение, связывающее эти величины, называется изотермой адсорбции.
4.1.4 Теории адсорбции
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется; рассмотрим поэтому некоторые наиболее распространенные теории адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твердое тело – газ или твердое тело – раствор.
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр, основывается на следующих положениях.
1) Адсорбция является локализованной и вызывается силами, близкими к химическим.
2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах , которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.
3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата ; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
Рис. 4.5 Изотерма мономолекулярной адсорбции
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 – х):
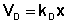
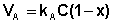
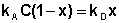
Отсюда находим х:
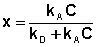
Разделив числитель и знаменатель правой части уравнения (IV.10) на kA, получим:

Максимально возможная величина адсорбции Г о достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Г о. Подставив это в уравнение (IV.11), получаем:
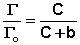
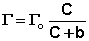
Уравнение (IV.13) есть изотерма мономолекулярной адсорбции , связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b – некоторая постоянная для данной пары адсорбент-адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Ленгмюра приведен на рис. 4.5. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
При описании процесса адсорбции газов в уравнении (IV.13) концентрация может быть заменена пропорциональной величиной парциального давления газа:
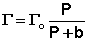
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Теория полимолекулярной адсорбции Поляни
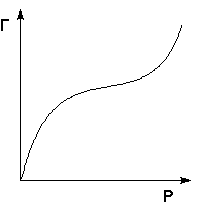
На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции (рис. 4.6), форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.
Рис. 4.6 Изотерма полимолекулярной адсорбции
Для описания таких изотерм адсорбции М. Поляни предложил теорию полимолекулярной адсорбции , основанную на следующих основных положениях:
1. Адсорбция вызвана чисто физическими силами .
2. Поверхность адсорбента однородна , т.е. на ней нет активных центров; адсорбционные силы образуют непрерывное силовое поле вблизи поверхности адсорбента.
3. Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата. Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объём , который при адсорбции заполняется молекулами адсорбата.
4. Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не меняется.
Теоретические представления, развитые Ленгмюром и Поляни, в значительной степени идеализируют и упрощают истинную картину адсорбции. На самом деле поверхность адсорбента неоднородна, между адсорбированными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид уравнения изотермы. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
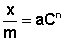
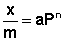
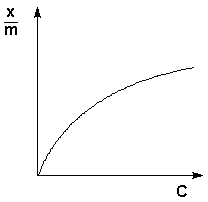
( а)
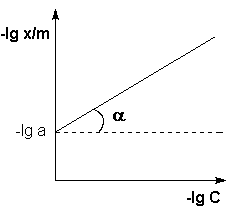
(б)
Рис. 4.7 Изотерма адсорбции Фрейндлиха в обычных (а) и логарифмических (б)
координатах
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения (IV.15 — IV.16), получаем:
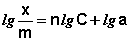
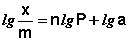
Т.о., зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lg a, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
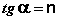
Copyright © С. И. Левченков, 1996 — 2005.
http://helpiks.org/6-84315.html
http://physchem.chimfak.sfedu.ru/Source/PCC/Colloids_3.htm