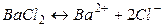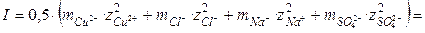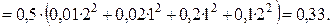Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
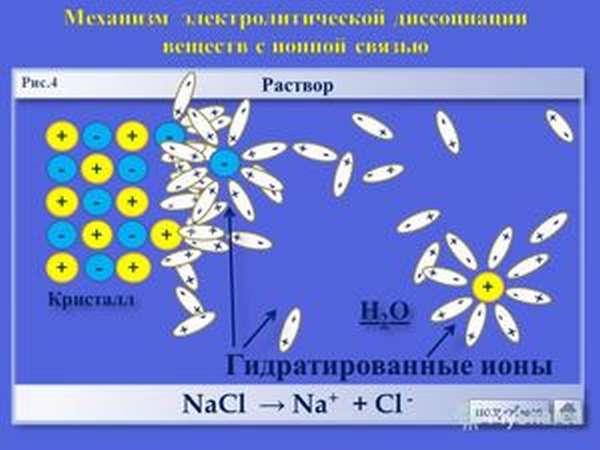
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ. ЗАКОН РАЗВЕДЕНИЯ ОСТВАЛЬДА. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ АРРЕНИУСА. 1 страница
Вещества, подвергающиеся при взаимодействии с растворителем диссоциации на ионы и сообщающие раствору способность проводить электрический ток, называются электролитами. Ионы – электрически заряженные частицы, которые являются переносчиками электричества в растворах и расплавах.
Следует помнить, что не все электролиты диссоциируют (т.е. распадаются на ионы) в одинаковой степени. В связи с этим выделяют:
– сильные электролиты (вещества, полностью диссоциирующие в растворе);
– слабые электролиты (вещества, диссоциирующие в растворе лишь частично).
Электропроводность слабых электролитов определяется в основном степенью диссоциации a, величина которой зависит от концентрации электролита и температуры. Для любого электролита:
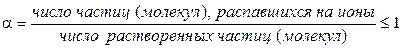
По величине степени диссоциации судить о силе электролита не очень удобно, так как величина 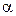
Рассмотрим равновесие диссоциации слабого электролита (для простоты – бинарного, т. е. дающего при диссоциации один катион и один анион):
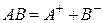
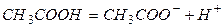
Если один моль вещества АВ растворён в V литрах раствора, то
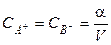
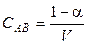
Константа диссоциации равна:
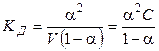
где С = 1/V — начальная (исходная) концентрация вещества АВ. Выражение (1.2) называют законом разведения Оствальда для бинарных электролитов.
Очевидно, что тем больше Кд, тем при данной концентрации выше степень диссоциации. Таким образом, величина Кд может служить удобной мерой силы электролита. Как любая константа равновесия, константа диссоциации зависит от температуры, поэтому сила электролита меняется с изменением температуры. Выражение (1.2) позволяет определять константу диссоциации по величине степени диссоциации a при данной концентрации электролита С. С другой стороны, зная константу диссоциации, можно рассчитать величину a при любой заданной концентрации.
Проанализируем уравнение Оствальда:
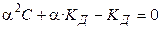
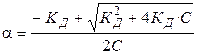
1). 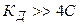
2). 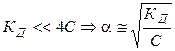
Для описания коллигативных свойств растворов электролитов используют изотонический коэффициент:
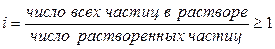
Изотонический коэффициент показывает, во сколько раз суммарная эффективная концентрация недиссоциированных молекул и ионов в растворе больше по сравнению с начальной концентрацией недиссоциированных молекул. С ростом концентрации коэффициент 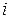
Рассмотрим как связаны 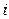
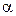
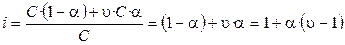
где υ – число ионов, на которые распадается частица (молекула). Если α = 0 (неэлектролит), то i = 1; если α = 1 (сильный электролит), то i = 2 (например, 
Экспериментально величину i можно найти путем сравнения опытных значений осмотических давлений растворов, понижения температуры замерзания или повышения температуры кипения растворов со значениями, вычисленными в предположении, что i = 1 (расчетные величины):
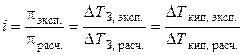
Следует помнить, что i ≥ 1 для растворов электролитов (они диссоциируют), если же молекулы ассоциируют (например, из двух молекул образуется одна частица за счёт водородных связей), то i
2. Диссоциация может быть полной или частичной.
3. Молекулы и образовавшиеся при диссоциации ионы находятся в равновесии.
4. По способности к диссоциации электролиты были разделены на слабые, средние и сильные.
Теория Аррениуса верна только для слабых электролитов с концентрацией С ≤ 0,01 моль/л. Для растворов сильных электролитов она не выполняется, так как не учитывает ни ион-дипольного, ни ион-ионного взаимодействия в растворах. Например, теория Аррениуса не может объяснить, почему константы диссоциации слабых электролитов не остаются постоянными по мере разведения растворов, а у сильных электролитов степень диссоциации, определенная разными методами, оказывается различной по величине, а в концентрированных растворах иногда даже превышает единицу.
1.2. ПОНЯТИЕ ОБ ЭЛЕКТРОЛИТИЧЕСКОЙ ТЕОРИИ СИЛЬНЫХ
Одной из теорий, количественно учитывающих ион-ионные взаимодействия, явилась теория Дебая-Гюккеля, достаточно хорошо объясняющая свойства разбавленных растворов сильных электролитов. Степень диссоциации для сильных электролитов равна единице. Поэтому зависимость электропроводности, осмотического давления и других свойств расворов от концентрации определяется главным образом действием межионных сил и сольватационными эффектами. Под сольватацией понимают совокупность энергетических и структурных изменений, происходящих в растворе при взаимодействии частиц растворенного вещества с молекулами растворителя.
В основе теории Дебая-Гюккеля лежат следующие положения: электростатическое взаимодействие противоположно заряженных ионов приводит к тому, что вокруг положительных ионов вероятность нахождения отрицательных ионов будет больше, чем положительных. Таким образом, вокруг каждого иона как бы существует ионная атмосфера из противоположно заряженных ионов. (Сфера, в которой преобладает заряд, противоположный по знаку центральному иону, и называется ионной атмосферой). Ионная атмосфера вокруг иона содержит и положительные, и отрицательные ионы, однако в среднем вокруг каждого положительного иона имеется избыток отрицательных ионов, а вокруг отрицательного иона – избыток положительных ионов. Раствор в целом остается электронейтральным.
Химический потенциал i-го компонента в идеальном растворе равен:
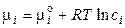
где сi – концентрация i-го иона в растворе. Для реального раствора:
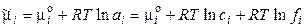
где ai = ci·fi — активность i-го иона в растворе, fi – коэффициент активности. Тогда энергия взаимодействия центрального иона с ионной атмосферой в расчете на 1 моль ионов равна
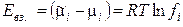
Таким образом, величина коэффициента активности, зависящая от силы электростатического взаимодействия ионов, степени их сольватации и ряда других эффектов, характеризует степень отклонения свойств реальных растворов электролитов от законов идеальных растворов.
1.3. АКТИВНОСТЬ И КОЭФФИЦИЕНТ АКТИВНОСТИ ЭЛЕКТРОЛИТОВ.
СРЕДНЯЯ ИОННАЯ АКТИВНОСТЬ И СРЕДНИЙ ИОННЫЙ КОЭФФИЦИЕНТ
АКТИВНОСТИ. ИОННАЯ СИЛА. ПРАВИЛО ИОННОЙ СИЛЫ.
Различают активность электролита и активность ионов. Для любого электролита процесс диссоциации можно записать следующим образом:
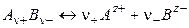
где n+ и n– — количество ионов А с зарядом z+ и ионов B c зарядом z–, на которые распадается исходная частица. Например, при диссоциации хлорида бария:
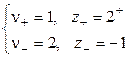
Связь активности электролита с активностями ионов выражается следующим соотношением:
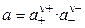
где а — активность электролита, а+ и а– — активности положительных и отрицательных ионов. Например, для бинарных электролитов справедливо:
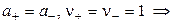
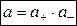
Экспериментальных методов определения активности отдельных ионов (а+ и а–) не существует. Поэтому было введено понятие средней ионной активности ( 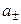
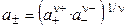
где 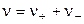
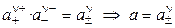
Криоскопический метод и метод, основанный на определении давления пара, позволяют определить активность электролита в целом (а) и по уравнению (7.13) найти среднюю ионную активность.
Средний ионный коэффициент активности ( 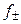
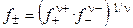
Значения 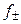
Средняя ионная моляльность ( 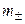
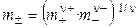
Если концентрацию раствора выражать через моляльность, то
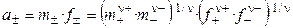
Пример 1.1. Найти связь между активностью электролита, его моляльной концентрацией и средним ионным коэффициентом активности для р-ров NaCl и Na2CO3 моляльности m.
а) Концентрации ионов, образующихся при полной диссоциации NaCl, равны m:
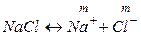
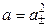
Для равновалентных электролитов средняя моляльность будет равна общей моляльности электролита:
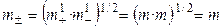
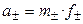
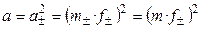
б) Концентрации ионов, образующихся при полной диссоциации Na2CO3, равны
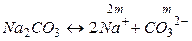
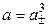
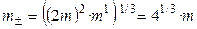
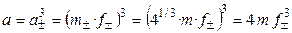
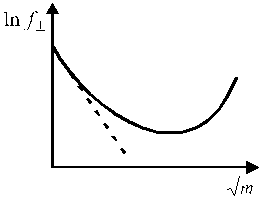 |  |
Средний ионный коэффициент активности зависит от концентрации раствора (рис. 1). В области предельно разбавленных растворов электролитов эта зависимость имеет линейный характер в координатах 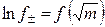
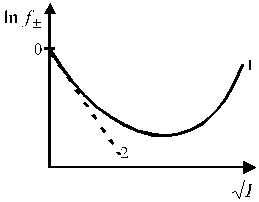
Рис. 1. Зависимость среднего ионного Рис. 2. Зависимость среднего коэффициента
коэффициента активности активности ионов от ионной силы раствора.
от концентрации электролита. Кривая 1 описывает экспериментальную
зависимость, кривая 2 описывает зависимость
по предельному закону Дебая-Гюккеля.
Присутствие в растворе других солей изменяет коэффициент активности данной соли и тем сильнее, чем больше заряд добавляемых ионов. Суммарную концентрацию всех ионов в растворе выражают через ионную силу раствора 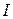
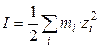
Зависимость среднего коэффициента активности ионов от ионной силы раствора имеет сложный характер и представлена на рис. 2.
Пример 1.2. Определить ионную силу раствора, содержащего на 1000 г воды 0,01 моль 
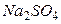
Решение. Ионная сила такого раствора равна
Пример 1.3. Определить ионную силу раствора 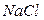
Решение. По уравнению (7.16) получаем
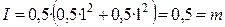
Для растворов сильных электролитов выполняется правило ионной силы: в растворах с одинаковой ионной силой средние коэффициенты активности ионов равны. Теория сильных электролитов приводит к следующему соотношению, связывающему средние коэффициенты активности ионов с ионной силой раствора в области сильно разбавленных электролитов:
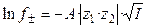
где A = f (D, T) – константа, зависящая от диэлектрической проницаемости растворителя (D) и температуры (T).
Уравнение (1.17) применимо лишь при очень больших разведениях (I ≤ 0,01, рис. 2), почему и получило название предельного закона Дебая-Гюккеля. В слабо минерализованных водах для расчета 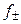
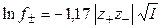
Для водных растворов бинарных электролитов при 25 o С справедливо:
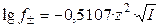
Известно, что в сильно разбавленных растворах электролитов коэффициенты активности ионов учитывают в основном поправки к их концентрациям (моляльностям), обусловленные электростатическим (ион–ионным) взаимодействием. В то же время по закону Кулона эти взаимодействия зависят также от величины зарядов и радиусов ионов. Поэтому естественно принять, как это было сделано впервые Д. Мак-Иннесом, что коэффициенты активности ионов с одинаковыми зарядами и радиусами в растворах с одинаковой ионной силой будут одинаковыми. Это предположение было названо правилом Мак–Иннеса.
Мак–Иннес предложил взять в качестве стандартов ионы калия и хлора как имеющие одинаковые заряды и радиусы гидротированных ионов. Определив значения 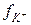
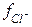
ТЕМА 2
Удельная и эквивалентная электропроводность, их зависимость от концентрации для сильных и слабых электролитов. Подвижность ионов. Закон независимости движения ионов Кольрауша, предельная ионная электропроводность. Аномальная подвижность ионов гидроксила и гидроксония. Экспериментальные приложения метода электропроводности.
2.1. УДЕЛЬНАЯ ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ.
При наложении электрического поля на раствор электролита сольватированные ионы, находящиеся до этого в беспорядочном тепловом движении, начинают упорядоченное движение (миграцию) к противоположно заряженным электродам. С возрастанием скорости движения ионов возрастает сопротивление среды и через некоторое время скорость движения ионов становится постоянной.
Скорость движения ионов i-го вида определяется градиентом потенциала (напряженности) электрического поля E (В/см) и сопротивлением среды, зависящим от температуры, природы иона и растворителя:
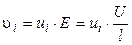
где U (В) – разность потенциалов между электродами, l (см) – расстояние между ними, ui (см 2 ·В -1 ·с -1 ) – абсолютная скорость движения ионов в данных условиях (т. е. скорость движения ионов при Е = 1 В/см).
Мерой способности вещества проводить электрический ток при наложении внешенего электрического поля является электрическая проводимость (электропроводность) L. На практике эта способность часто характеризуется обратной величиной — сопротивлением проводника. Так, общее сопротивление проводника R (Ом) длиной l (см) и поперечным сечением S (см 2 ) равно
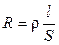
где ρ – коэффициент пропорциональности, называемый удельным сопротивлением. Из (8.2) следует, что удельное сопротивление — это сопротивление проводника длиной 1 см и сечением 1 см 2 , размерность его равна:
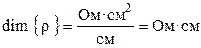
Удельная электропроводность электролита æ — величина, обратная удельному сопротивлению:
æ 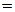
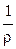
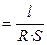
Она характиризует электропроводность слоя электролита толщиной в 1 см с площадью поперечного сечения в 1 см 2 . Тогда
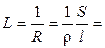
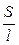
Удельная электропроводность раствора электролита определяется количеством ионов, переносящих электричество, и скоростью их миграции.
Пусть между электродами, находящимися на расстоянии l (см) и к которым приложена разность потенциалов U (В), находится раствор электролита (рис. 3). Для ионов i-го вида: концентрация Ci (моль-экв/см 3 ) и скорость миграции υi (см/с).
Рис. 3. Схема переноса зарядов через раствор электролита.
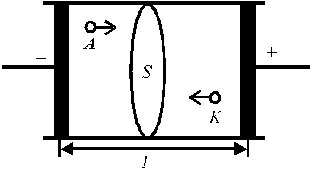 |
Через поперечное сечение S раствора (рис. 3) за 1 с мигрирует (Ci υi S) моль-эквивалентов ионов i-го вида, которые перенесут ( 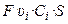

количество электричества, где F – число Фарадея (96485 Кл/моль-экв). Количество электричества (Кл), перенесенное всеми ионами за 1 с (т. е. сила тока I в А) равно:
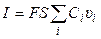
Или, с учетом (8.1),
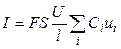
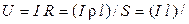
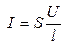
Тогда, из уравнений (8.6) и (8.8), для удельной электропроводности получаем
æ 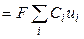
т. е. удельная электропроводность электролита пропорциональна концентрациям ионов и их абсолютным скоростям движения. Для раствора бинарного электролита концентрации С (моль-экв/см 3 ) со степенью диссоциации α имеем
æ 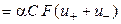
где u+ и u‑ ‑ абсолютные скорости движения катионов и анионов.
При повышении температуры электролита возрастают скорости движения ионов и удельная электропроводность:
æ2 = æ1 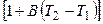
где B – температурный коэффициент (для сильных кислот 0,016; для сильных оснований 0,019; для солей 0,022).
2.2. ЭКВИВАЛЕНТНАЯ ЭЛЕКТРОПРОВОДНОСТЬ.
Удельная электропроводность растворов зависит от природы электролита, природы растворителя, температуры, концентрации ионов в растворе и т. д. Хотя для понимания свойств электролитов удельная электропроводность представляет собой малоудобную величину, зато ее можно измерить непосредственно и затем пересчитать в эквивалентную электропроводность λ. Эквивалентная электропроводность представляет собой электропроводность такого объёма раствора V (см 3 ), который содержит 1 моль-экв растворенного вещества и заключён между двумя параллельными электродами соответствующей площади, находящихся на расстоянии в 1 см друг от друга:
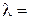
где С – концентрация раствора (моль-экв/см 3 ).
Эквивалентную электропроводность (Ом -1 ·см 2 ·(моль-экв) -1 ) легко рассчитать, если известны удельная электропроводность и концентрация раствора.
Для описания температурной зависимости эквивалентной электропроводности используется следующее уравнение:
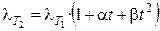
где a и b — эмпирические коэффициенты. Увеличение электропроводности с ростом температуры связано в основном с уменьшением вязкости раствора электролита. Обычно при повышении температуры на 1 К электропроводность увеличивается на 1,5 – 2%.
Эквивалентная электропроводность растворов электролитов с разбавлением возрастает и в области предельных разбавлений достигает предельного значения λ∞, называемой электропроводностью при бесконечном разбавлении или предельной электропроводностью. Эта величина соответствует электропроводности гипотетически бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
Из уравнений (2.10) и (2.11) следует, что
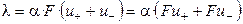
Произведение числа Фарадея на абсолютную скорость движения иона называют подвижностью иона:
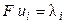
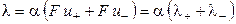
где λ+ и λ‑ ‑ подвижности катиона и аниона соответственно. Подвижности ионов измеряются в тех же единицах, что и эквивалентная электропроводность (см 2 ·Oм -1 ·моль-экв -1 ), поэтому их иногда называют ионными электропроводностями или электрическими проводимостями ионов.
При бесконечном разведении (α = 1) получаем
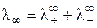
где 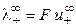
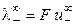
Величина предельной электропроводности бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждая из которых соответствует определенному виду ионов. Это соотношение установлено Кольраушем и называется законом независимого движения ионов (законом Кольрауша): эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов. Сущность этого закона состоит в следующем: в предельно разбавленном растворе электролита катионы и анионы переносят ток независимо друг от друга.
Закон Кольрауша помог вычислить значения λ∞ для многих слабых электролитов, для которых нельзя было определить эти значения из опытных данных экстрополяцией их к нулевой концентрации (или к бесконечному разведению) как это делается в случае сильных (и средних) электролитов. Предельные подвижности ионов, как и эквивалентная электропроводность, увеличиваются с температурой. Их значения, например, при 25 о С лежат в интервале от 30 до 80 и от 40 до 80 (см 2 ·Oм ‑1 ·моль-экв -1 ) для однозарядных катионов и анионов соответственно.
У ионов ОН ‑ и Н + наблюдается аномально высокие подвижности:
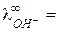
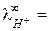
что объясняется особым — эстафетным — механизмом их перемещения (рис. 4).
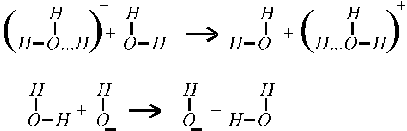 |
Рис. 4. Эстафетный механизм перемещения ионов ОН — и Н + .
На основании эквивалентной электропроводности раствора электролита и предельных подвижностей ионов можно рассчитать степень диссоциации слабого электролита:
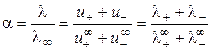
Для сильных электролитов, диссоциирующих полностью, рассчитывают 
коэффициент электропроводности:
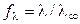
который учитывает влияние электростатического взаимодействия ионов на скорость их движения.
Электролитическая диссоциация: сущность теории С. Аррениуса

Теория электролитической диссоциации


Константа равновесия, записанная, через концентрации веществ при изотермических условиях будет иметь следующее значение:
Кд = [K+] x [A-] / [KA] (2)
Учитывая допущение теории Аррениуса, которые были применены автором, в частности, о неполноте диссоциации, вводится понятие степени диссоциации — α. Таким образом, если выразить концентрацию раствора С (моль/л), то на литр раствора приходится αС моль электролита (КА), а равновесная его концентрация может быть выражена, как (1-α)С моль/л. Из уравнения реакции (1) очевидно, что на αС моль электролита (КА) образуется такое же количество ионов К+ и А-. Если подставить все эти величины в уравнение (2) и провести ряд упрощений, то получим формулу константы диссоциации (степень диссоциации формула):

Теория Аррениуса дала развитие множеству научных направлений в химии: с её помощью были созданы первые теории кислот и оснований, были даны объяснения физико-химическим процессам в гомогенных системах. Тем не менее, она не лишена недостатков, которые в основном относятся к тому факту, что теория не учитывает межионные взаимодействия.
Классификация электролитов с примерами
Электролиты классифицируют на слабые и сильные, периодически выделяя группу электролитов средней силы. Сильные электролиты характеризуются тем, что распадаются в растворе полностью. Как правило — это сильные минеральные кислоты, например:
- Азотная кислота — HNO3.
- Хлороводородная кислота — HCl.
- Хлорная кислота — HClO4.
- Ортофосфорная кислота — H3PO4.
Сильными электролитами могут быть основания, например:
- Гидроксид натрия — NaOH.
- Гидроксид калия — KOH.
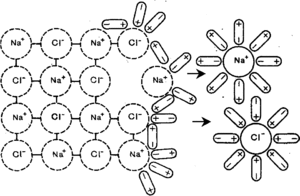
Слабые электролиты, напротив, в растворах гидратируют частично. К этой группе следует относить неорганические кислоты (H2CO3, H3BO3, H3AsO4), слабые основания (аммоний), некоторые соли (HgCl2), органические кислоты (CH3COOH, C6H5COOH), фенолы и амины. В неводных растворах одни и те же соединения могут являться и сильными и слабыми электролитами, таким образом, зависят от природы растворителя.
Диссоциация кислот, оснований и солей
Закономерности для кислот
При электрической диссоциации кислот в водных растворах обязательно в качестве катионов образуются положительно заряженные ионы водорода (Н+):
Если кислота многоосновная (например: уравнение диссоциации H2SO4), то диссоциация происходит последовательно, за каждый раз отщепляя один ион водорода:
H2SO4 → H + + HSO4- первая ступень — гидросульфат ион
HSO4- → H + + SO4- вторая ступень — сульфат ион
Процесс для многоосновной кислоты, как правило, протекает максимально по первой ступени, степень диссоциации последующих намного меньше.
Характеристика процесса для щелочей
При диссоциации щелочей в водных растворах обязательно образуется отрицательно заряженный гидроксил ион (ОН-):
Процесс для многокислотных оснований (пример — механизм диссоциации гидроксида магния) протекает многоступенчато аналогично многоосновным кислотам:
Mg (OH)2 → OH- + Mg (OH)+ первая ступень
Mg (OH)+ → OH- + Mg2+ вторая ступень
Существуют также случаи, когда в процессе диссоциации могут образовываться и катионы водорода, и гидроксил-анионы (при диссоциации амфолитов или амфотерных соединений, например, Zn, Al):
2OH- + Zn2+ + 2H2O ←→ Zn (OH)2 + H2O ←→ [Zn (OH)4]2- + 2H+
Правила протекания для кислых и основных солей
Для кислых солей, основная закономерность заключается в следующем — сначала диссоциируют катионы (положительно заряженные металлы), а только потом катионы водорода:
KHSO4 → K+ + HSO4- первая ступень
HSO4 — → H+ + SO4- вторая ступень
У основных солей, в первую очередь, переходят в раствор остатки кислоты, а уже затем гидроксил-ион:
BaOHCl → Cl- + Ba (OH)+ первая ступень
Ba (OH)+ → OH- + Ba2+ вторая ступень
Водородный показатель
Определение, сущность и значение
Процессы диссоциации могут протекать не только для растворенных веществ, но и растворителя. Так, вода является сама со себе слабым электролитом и для неё характерна диссоциация в очень незначительной степени. Уравнение процесса можно записать следующим образом:
Одна молекула воды диссоциирует на положительно заряженные ионы водорода и отрицательно заряженные анионы гидроксония. Именно концентрация этих ионов определяет уровень кислотности раствора — чем больше ионов гидроксония, тем более кислый раствор.
Концентрация ионов гидроксония в реальных растворах, как правило, очень мала (например: 5×10−6 г/л) и поэтому для удобства, это значение логарифмируют, а чтобы получить положительное значение, берут с обратным знаком. Кратко сформулируем строгое определение понятия «водородный показатель» или рН.
рН (водородный показатель) — это отрицательный натуральный логарифм концентрации ионов гидроксония, отражающий кислотность раствора.
Значения водородного показателя принято оценивать по шкале значений от 0 до 14, где 0 — наиболее кислый раствор, а 14 — наиболее щелочной. Нейтральным раствором (соответствующим рН чистой воды) считается раствор со значением 7. Для примера приводим несколько типичных растворов, имеющих характерные значения водородного показателя:
| Значение рН | Раствор |
| 11 | Нашатырный спирт |
| 9,5 | Гидроксид кальция |
| 8,0 | 30% раствор поваренной соли |
| 7,4 | Плазма крови |
| 7,0 | Деионизированная вода |
| 6,5 | Молоко |
| 5,5 | Кофе |
| 2,8 | Уксус (раствор 5% концентрации) |
| 0,1 | Хлорная кислота (65%) |
Значительно реже прибегают к использованию еще одного показателя — рОН. По своему смыслу он абсолютно аналогичен водородному показателю, за исключением того, что за основу берётся концентрация гидроксил-ионов.
http://helpiks.org/8-24354.html
http://tvercult.ru/nauka/elektroliticheskaya-dissotsiatsiya-sushhnost-teorii-s-arreniusa