Уравнение аррениуса физический смысл энергии активации
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.9 Влияние температуры на константу скорости реакции
Константа скорости реакции есть функция от температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Я. Г. Вант-Гоффом, который сформулировал следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ . Математически правило Вант-Гоффа можно записать следующим образом:
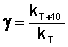
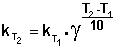
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
2.1.10 Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
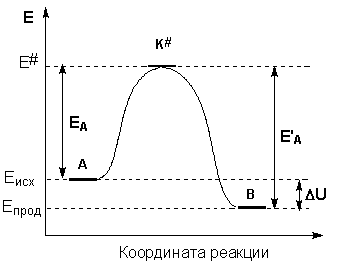
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е’А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
Рис. 2.5 Энергетическая диаграмма химической реакции.
Eисх – средняя энергия частиц исходных веществ,
Eпрод – средняя энергия частиц продуктов реакции
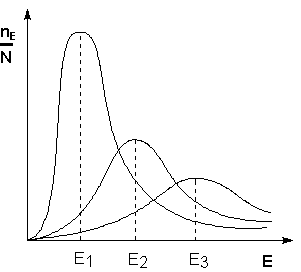
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.6 Распределение частиц по энергии
Здесь nЕ/N – доля частиц, обладающих энергией E;
Ei — средняя энергия частиц при температуре Ti (T1 уравнения Аррениуса . Согласно уравнению изобары Вант-Гоффа,
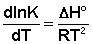
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
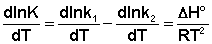
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
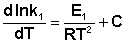
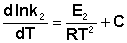
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации :
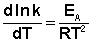
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
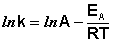
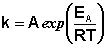
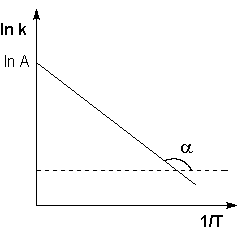
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
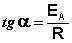
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
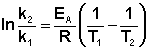
Copyright © С. И. Левченков, 1996 — 2005.
Уравнение Аррениуса. Энергия активации химической реакции





Уравнение Аррениуса. Энергия активации химической реакции
- Уравнение Аррениуса. Энергия химической активации Вы. Формулы (V.19) и (V.20) являются только приблизительными Зависимости u = f (T) и k = f (T). Зависит от функции Константа скорости химической реакции k от температуры Обновлено шведским ученым С. Аррениусом (1889): * = (V. 2 1) Где А — предэкспоненциальный фактор. EA-acty energy.
- Реакция реакции; Т — абсолютная температура К. В химической кинетике часто используется уравнение Арре. Хорошая логарифмическая форма; в * = -E>, / RT + \ nA. (V.22) Из уравнения (V.22) зависимость постоянной равна Температура роста химической реакции встроена в кору Создайте чернила / T, линейные (рисунок V.3). Эта зависимость Энергию активации реакции Ea можно определить по тангенсу угла.
Наклон линии вдоль разреза и предэкспоненциальный множитель А Если ku, 1/7 = 0, обрезать вертикальную ось. Людмила Фирмаль
Исследование советских химиков (В. И. Гольданский и др.) Ультранизкая температура (ниже точки кипения азота -77 К) показала Закон Аррениуса для серии взаимодействий при очень низких температурах Остановите поведение, потому что 1 р / г зависит от 1 / т. Рис, v.u. Зависит от Химическая скорость Температура реакции Рига V.4. ^ Постоянная зависимость Скорость реакции от темпа Отклонение от Ирати: Аркениус (Рисунок V L) нелинейный.
Скорость таких реакций низкая Температура (Т ^ 10К) составляет Уравнение Аррениуса. Уравнение Аррениуса имеет две [величины; £ a и A Некоторые характеристики каждой реакции. Их фи Логический смысл получается по следующим причинам: Неплохо Предпосылки для инициирования химических взаимодействий между Две молекулы должны столкнуться.
Но не все Молекулярные столкновения заканчиваются действием химических взаимодействий Действия, то есть не все коллизии действительны. Также процент Как правило, общее количество эффективных столкновений Незначительный, большинство столкновений между молекулами Не вызывает реакции. Это можно легко проверить, рассчитав Возможное число на основе газовой кинетики.
Молекулярные столкновения и соответствующие скорости Сравните реакцию, затем ожидание (с расчетом 100% Эффективность) фактическая скорость; первое во мне Последние несколько раз. Аррениус предположил, что химический Действия выполняются только между этими конфликтами Молекулы, которые достигли определенной энергии.
Характерный уровень этой реакции, ее энергия Барьеры. Если такая молекула считается активной, эффект Столкновения происходят только между активами Pattern. Все молекулы в системе с низким накоплением энергии Энергетический барьер реакции находится в особом состоянии, Обычно это называется переходным состоянием или активным состоянием.
Комплекс, можно предположить, что система настроена Институт Активации комплекса характеризуется тем, что он в нем Уже нет исходного материала, но нет продукта реакции [1; Исходный материал передается продукту реакции. Принципиальная схема Переход лыж от исходных материалов A и B к продукту реакции C А через активированный комплекс А …
В состояние Иллюстрация льна. D.5 *. R. При взятии среднего уровня энергии исходной молекулы Вещество в системе равно £ |, а средняя энергия перехода Разность состояний E’-E \ представляет энергию Активация этой реакции, системная энергия (рисунок U.5) Переходное состояние максимально. Это значит Купальные сооружения очень нестабильны.
В процессе реакции он Расширяется до произведения взаимодействий C и O. На рассмотрении В этом примере средний уровень энергии молекул продукта реакции Е 2 ниже среднего уровня энергии исходной молекулы Вещество E . Это означает, что процесс будет продолжен с назначением Энергия (экзотермическая реакция). Средняя энергия молекул продукта реакции £ 2.
Может быть выше, чем средний энергетический уровень молекулы источника Детали E 1 (рисунок U.b). Процесс переходит к поглощению энергии. Гии (эндотермическая реакция) из окружающей среды. разница £ 2-¿ 1 равно тепловому эффекту процесса АЭ. Энергия активации является одним из основных параметров. ry характеризует скорость химического взаимодействия. стабилитрон Активация Процесс активации зависит от характера реакции Висячие.
- Чем выше энергия активации, тем меньше Равное условие) скорость реакции. Энергия активации Необходим в основном для ослабления химических связей Преодоление отталкивания с исходным материалом Электроны, генерируемые, когда молекулы и атомы объединяются Предотвращает взаимодействие веществ и их столкновения. Реакция между веществами, которые обычно имеют сильные ковалентные связи Облигации £ Медленно.
Это относится ко многим взаимодействиям Взаимодействие с органическим веществом Н2 + У2 0 2 = П20 и л и Н 2 + ЗЫ2 = 2НХ², скорость равна Стандартное условие практически нулевое. небольшой „„ И очень высокая скорость характеризуется ионами Взаимодействие в электролите (например: + 5 0 4 ’= $ 04 или Ag при * * + SG ‘= AgCl).
Это В связи с тем, что противоположно заряженные ионы притягиваются друг к другу. Людмила Фирмаль
Будьте друзьями и не нужно тратить энергию на преодоление силы Отталкивание взаимодействующих частиц. Простой расчет энергии активации химической реакции Согласно уравнению Аррениуса (U.22) значение известно Константы скорости k / -и k-1 при разных температурах: кг: I—, / I 1 (D.23) • nramot () и [) обрабатывают координаты реакции. Ход реакции. Axhibiro Bunny. С комплексом … LN 0 Координаты реакции Рис, д.5.
Диаметр энергии Граммы лихорадки Акии Координаты реакции Рисунок D.6. Диаметр энергии Грамм для эндотермы реакция Дает энергию активации нескольких химических реакций После: N20, -2N02, Hg + 12 ^ 2H1 C2H4 + I2 — CrNb, 2H1-Hg + b. C2H5Br ^ C2H4 + HBr. C H 4 C + 2H, Е д = 54,4 кДж / моль, £ = 165,5 кДж / моль, EV = 180,5 кДж / моль L ‘= 186,4 кДж / моль, £ = 218,0 кДж / мл £ = 334,7 кДж / моль, Обычно реакция ->! При 50 кДж / моль, Не протекать при комнатной температуре.
Замечательная энергия активации Это расстройство движения, Многие химические взаимодействия не остывают Рассмотрено с точки зрения химической термодинамики (DO •




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Теория активных столкновений. Уравнение Аррениуса
Количественная зависимость константы скорости реакции от температуры была впервые предложена тоже Я.Вант-Гоффом (1887) в виде уравнений изохоры и изобары химической реакции (см. п. 4.5.2).
Эта идея была развита С.Аррениусом (1889), который открыл, что температурную зависимость скорости многих реакций можно описать уравнением:
k = Ае — Е* / RT
где k — константа скорости, e — основание натуральных логарифмов, R — универсальная газовая постоянная, T – температура, А — предэкспоненциальный множитель, Е* — энергия активации реакции.
Чтобы выяснить физический смысл величин А и Е*, входящих в уравнение Аррениуса, следует сначала познакомиться с основными положениями теории активных соударений(столкновений)(С.Аррениус и Я.Вант-Гофф; 1880-е г.г.):
1) Химическое взаимодействие между молекулами возможно только при их столкновении.
2) Не каждое столкновение молекул приводит к химическому взаимодействию, т. е. является результативным или, по терминологии Аррениуса, активным. Существует некий энергетический барьер, преодолеть который и вступить во взаимодействие может лишь часть молекул, причём, как правило, это очень малая часть от их общего числа в системе.
3) Причиной, обусловливающей существование энергетического барьера, является взаимное отталкивание электронных оболочек молекул при их сближении.
Когда две частицы удалены друг от друга на очень большое расстояние, между ними нет никакого взаимодействия и потенциальная энергия такой системы равна нулю. При меньших расстояниях между частицами они притягиваются друг к другу, и потенциальная энергия системы понижается. При дальнейшем уменьшении расстояния становятся заметными силы отталкивания электронных оболочек молекул и потенциальная энергия резко возрастает. Поэтому для сближения частиц до расстояния, на котором начнется перераспределение электронов на их орбиталях (т. е. химическое взаимодействие), частицы должны обладать достаточно большим запасом кинетической энергии. Силы отталкивания между частицами и представляют между собой так называемый потенциальный или энергетический барьер, а химическое взаимодействие возможно только в том случае, если сталкивающиеся молекулы способны преодолеть его.
4) Для того, чтобы молекулы могли при столкновении преодолеть энергетический барьер, они должны двигаться навстречу друг другу с достаточно большой скоростью. Для достижения этой необходимой скорости нужна определённая энергия, называемая энергией активации. Энергия активацииЕ* — это избыток энергии активных молекул по сравнению с неактивными, или иначе, энергия, которой должны обладать молекулы, чтобы иметь возможность вступить во взаимодействие. Размерность СИ энергии активации — Дж/моль.
5) Чем больше энергия активации реакции, тем больше энергетический барьер, и тем меньшее число молекул способно его преодолеть. Поэтому, чем больше Е*, тем медленнее идёт реакция.
6) С повышением температуры увеличивается скорость теплового движения молекул, поэтому доля активных молекул возрастает. Иными словами, при повышении температуры происходит термическая активация, приводящая к увеличению скорости реакции.
Возвращаясь к уравнению Аррениуса, отметим, что величина e — Е* / RT (“экспонента”) равна доле активных молекул, обладающих избыточной энергией Е* для вступления в химическое взаимодействие, а коэффициент А (предэкспоненциальный множитель) равен полной частоте соударений между молекулами реагирующих веществ в реакционном объёме.
Логарифмируя уравнение Аррениуса, получим уравнение прямой, не проходящей через начало координат:
| E* ln k = ln A — ¾¾ . RT |
Построив по экспериментальным данным график зависимости ln k от 1/T (т. н. “аррениусовскую зависимость”), можно вычислить энергию активации изучаемой реакции по тангенсу угла наклона, который в этом случае равен —Е*/R (рис. 12.5).
 Рис. 12.5. Аррениусовская зависимость и энергия активации Рис. 12.5. Аррениусовская зависимость и энергия активации |
Дифференцируя логарифмическую форму уравнения Аррениуса по температуре, получим уравнение, подобное уравнению изобары (изохоры) Вант-Гоффа:
| d ln k E* ¾¾¾ =¾¾ dT RT 2 |
Интегрирование его в пределах k1 ¸ k2 и Т1 ¸ Т2 приводит к уравнению
| k2 E* 1 1 ln ¾ = ¾ (¾ — ¾) k1 R T2 T1 |
| k2 E* Т2 — Т1 ln ¾ =¾ ( ¾¾¾) , (12.11) k1 R T1 T2 |
где k1 и k2 — константы скорости данной реакции при температурах T1 и T2 соответственно.
С помощью уравнения (12.11), также называемого уравнением Аррениуса, можно вычислить константу скорости k2 при заданной температуре Т2, если известны значения константы скорости k1 при температуре Т1 и энергия активации реакции Е*. Кроме того, это уравнение позволяет вычислить энергию активации реакции по значениям двух констант скорости при различных температурах:
| R T1 T2 k2 E* = ¾¾¾¾ ln¾ . Т2 — Т1 k1 |
Таким образом, в соответствии с теорией активных соударений повышение температуры увеличивает скорость химических реакций потому, что при этом возрастает доля активных молекул, способных преодолеть потенциальный барьер при столкновении.
http://lfirmal.com/uravnenie-arreniusa-energiya-aktivacii-himicheskoj-reakcii/
http://helpiks.org/6-61941.html