Уравнение аррениуса понятие об энергии активации
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.9 Влияние температуры на константу скорости реакции
Константа скорости реакции есть функция от температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Я. Г. Вант-Гоффом, который сформулировал следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ . Математически правило Вант-Гоффа можно записать следующим образом:
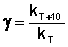
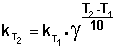
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
2.1.10 Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
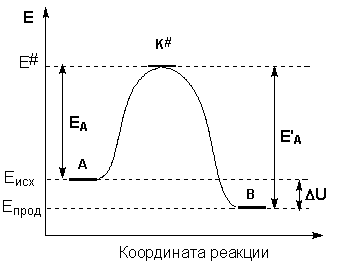
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е’А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
Рис. 2.5 Энергетическая диаграмма химической реакции.
Eисх – средняя энергия частиц исходных веществ,
Eпрод – средняя энергия частиц продуктов реакции
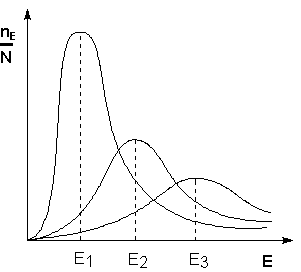
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.6 Распределение частиц по энергии
Здесь nЕ/N – доля частиц, обладающих энергией E;
Ei — средняя энергия частиц при температуре Ti (T1 уравнения Аррениуса . Согласно уравнению изобары Вант-Гоффа,
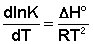
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
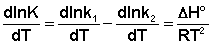
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
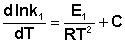
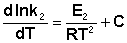
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации :
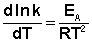
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
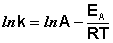
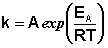
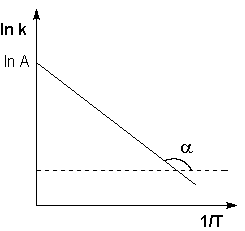
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
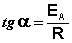
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
Copyright © С. И. Левченков, 1996 — 2005.
Уравнение Аррениуса. Энергия активации химической реакции





Уравнение Аррениуса. Энергия активации химической реакции
- Уравнение Аррениуса. Энергия химической активации Вы. Формулы (V.19) и (V.20) являются только приблизительными Зависимости u = f (T) и k = f (T). Зависит от функции Константа скорости химической реакции k от температуры Обновлено шведским ученым С. Аррениусом (1889): * = (V. 2 1) Где А — предэкспоненциальный фактор. EA-acty energy.
- Реакция реакции; Т — абсолютная температура К. В химической кинетике часто используется уравнение Арре. Хорошая логарифмическая форма; в * = -E>, / RT + \ nA. (V.22) Из уравнения (V.22) зависимость постоянной равна Температура роста химической реакции встроена в кору Создайте чернила / T, линейные (рисунок V.3). Эта зависимость Энергию активации реакции Ea можно определить по тангенсу угла.
Наклон линии вдоль разреза и предэкспоненциальный множитель А Если ku, 1/7 = 0, обрезать вертикальную ось. Людмила Фирмаль
Исследование советских химиков (В. И. Гольданский и др.) Ультранизкая температура (ниже точки кипения азота -77 К) показала Закон Аррениуса для серии взаимодействий при очень низких температурах Остановите поведение, потому что 1 р / г зависит от 1 / т. Рис, v.u. Зависит от Химическая скорость Температура реакции Рига V.4. ^ Постоянная зависимость Скорость реакции от темпа Отклонение от Ирати: Аркениус (Рисунок V L) нелинейный.
Скорость таких реакций низкая Температура (Т ^ 10К) составляет Уравнение Аррениуса. Уравнение Аррениуса имеет две [величины; £ a и A Некоторые характеристики каждой реакции. Их фи Логический смысл получается по следующим причинам: Неплохо Предпосылки для инициирования химических взаимодействий между Две молекулы должны столкнуться.
Но не все Молекулярные столкновения заканчиваются действием химических взаимодействий Действия, то есть не все коллизии действительны. Также процент Как правило, общее количество эффективных столкновений Незначительный, большинство столкновений между молекулами Не вызывает реакции. Это можно легко проверить, рассчитав Возможное число на основе газовой кинетики.
Молекулярные столкновения и соответствующие скорости Сравните реакцию, затем ожидание (с расчетом 100% Эффективность) фактическая скорость; первое во мне Последние несколько раз. Аррениус предположил, что химический Действия выполняются только между этими конфликтами Молекулы, которые достигли определенной энергии.
Характерный уровень этой реакции, ее энергия Барьеры. Если такая молекула считается активной, эффект Столкновения происходят только между активами Pattern. Все молекулы в системе с низким накоплением энергии Энергетический барьер реакции находится в особом состоянии, Обычно это называется переходным состоянием или активным состоянием.
Комплекс, можно предположить, что система настроена Институт Активации комплекса характеризуется тем, что он в нем Уже нет исходного материала, но нет продукта реакции [1; Исходный материал передается продукту реакции. Принципиальная схема Переход лыж от исходных материалов A и B к продукту реакции C А через активированный комплекс А …
В состояние Иллюстрация льна. D.5 *. R. При взятии среднего уровня энергии исходной молекулы Вещество в системе равно £ |, а средняя энергия перехода Разность состояний E’-E \ представляет энергию Активация этой реакции, системная энергия (рисунок U.5) Переходное состояние максимально. Это значит Купальные сооружения очень нестабильны.
В процессе реакции он Расширяется до произведения взаимодействий C и O. На рассмотрении В этом примере средний уровень энергии молекул продукта реакции Е 2 ниже среднего уровня энергии исходной молекулы Вещество E . Это означает, что процесс будет продолжен с назначением Энергия (экзотермическая реакция). Средняя энергия молекул продукта реакции £ 2.
Может быть выше, чем средний энергетический уровень молекулы источника Детали E 1 (рисунок U.b). Процесс переходит к поглощению энергии. Гии (эндотермическая реакция) из окружающей среды. разница £ 2-¿ 1 равно тепловому эффекту процесса АЭ. Энергия активации является одним из основных параметров. ry характеризует скорость химического взаимодействия. стабилитрон Активация Процесс активации зависит от характера реакции Висячие.
- Чем выше энергия активации, тем меньше Равное условие) скорость реакции. Энергия активации Необходим в основном для ослабления химических связей Преодоление отталкивания с исходным материалом Электроны, генерируемые, когда молекулы и атомы объединяются Предотвращает взаимодействие веществ и их столкновения. Реакция между веществами, которые обычно имеют сильные ковалентные связи Облигации £ Медленно.
Это относится ко многим взаимодействиям Взаимодействие с органическим веществом Н2 + У2 0 2 = П20 и л и Н 2 + ЗЫ2 = 2НХ², скорость равна Стандартное условие практически нулевое. небольшой „„ И очень высокая скорость характеризуется ионами Взаимодействие в электролите (например: + 5 0 4 ’= $ 04 или Ag при * * + SG ‘= AgCl).
Это В связи с тем, что противоположно заряженные ионы притягиваются друг к другу. Людмила Фирмаль
Будьте друзьями и не нужно тратить энергию на преодоление силы Отталкивание взаимодействующих частиц. Простой расчет энергии активации химической реакции Согласно уравнению Аррениуса (U.22) значение известно Константы скорости k / -и k-1 при разных температурах: кг: I—, / I 1 (D.23) • nramot () и [) обрабатывают координаты реакции. Ход реакции. Axhibiro Bunny. С комплексом … LN 0 Координаты реакции Рис, д.5.
Диаметр энергии Граммы лихорадки Акии Координаты реакции Рисунок D.6. Диаметр энергии Грамм для эндотермы реакция Дает энергию активации нескольких химических реакций После: N20, -2N02, Hg + 12 ^ 2H1 C2H4 + I2 — CrNb, 2H1-Hg + b. C2H5Br ^ C2H4 + HBr. C H 4 C + 2H, Е д = 54,4 кДж / моль, £ = 165,5 кДж / моль, EV = 180,5 кДж / моль L ‘= 186,4 кДж / моль, £ = 218,0 кДж / мл £ = 334,7 кДж / моль, Обычно реакция ->! При 50 кДж / моль, Не протекать при комнатной температуре.
Замечательная энергия активации Это расстройство движения, Многие химические взаимодействия не остывают Рассмотрено с точки зрения химической термодинамики (DO •




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Понятие об энергии активации. Активированный (переходный) комплекс
Содержание:
| Предмет: | Химия |
| Тип работы: | Курсовая работа |
| Язык: | Русский |
| Дата добавления: | 11.04.2019 |
- Данный тип работы не является научным трудом, не является готовой выпускной квалификационной работой!
- Данный тип работы представляет собой готовый результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала для самостоятельной подготовки учебной работы.
Если вам тяжело разобраться в данной теме напишите мне в whatsapp разберём вашу тему, согласуем сроки и я вам помогу!
По этой ссылке вы сможете найти много готовых курсовых работ по химии:
Посмотрите похожие темы возможно они вам могут быть полезны:
Введение:
Химическая кинетика — это наука о скоростях и механизмах химических превращений, явлениях, сопровождающих эти превращения, и факторах, которые на них влияют.
Механизм реакции представляет собой последовательность стадий, предложенных на основе экспериментально установленных данных о скорости реакции и об экспериментально обнаруженных промежуточных продуктах реакции (промежуточных продуктах).
Кинетика по методике описания химических реакций делится на два раздела. В формальной или феноменологической кинетике сформулированы закономерности, которые позволяют макроскопически описать химическую реакцию на основе экспериментальных данных. Молекулярная кинетика изучает трансформацию на основе молекулярных данных о свойствах частиц.
Теоретической основой химической кинетики является теория столкновений и переходное состояние.
Теория столкновений позволяет объяснить влияние концентрации и температуры на скорости реакции.
Теория переходного состояния рассматривает изменение геометрического расположения атомов реагирующих молекул как единой системы.
Переходное состояние или активированный комплекс является критической конфигурацией, которая соответствует максимальной потенциальной энергии вдоль координаты реакции.
Реагирующие молекулы, которые достигают этой критической конфигурации, образуют молекулы продукта.
Кинетические исследования позволяют определить порядок и константу скорости реакции, количество и характер промежуточных продуктов, энергию активации реакции, выяснить влияние природы растворителя, установить природу и количество связей сломался во время реакции и т. д.
Рассмотрим основные понятия химической кинетики.
Скорость, константа скорости, порядок и молекулярность химической реакции
Со временем в процессе химической реакции происходит изменение количества исходных веществ и продуктов реакции. Эти изменения могут быть различными из-за различных стехиометрических коэффициентов веществ, участвующих в химической реакции. Поэтому при рассмотрении скорости реакции были введены две концепции: скорость реакции для данного вещества и скорость реакции в целом (просто скорость реакции).
Скорость реакции — это изменение количества i-го вещества (в молях) за единицу времени в единице реакционного пространства R.
Это определение скорости является наиболее распространенным. Он действителен для любых условий, в том числе неизотермических.
Если реакция является гетерогенной и протекает на границе раздела фаз, то пространство реакции представляет собой поверхность (R = S), и изменение количества вещества относится к единице поверхности. Если реакция является гомогенной и протекает в объеме, то пространство реакции является объемным (R = V). Изменение количества вещества рассматривается на единицу объема.
В этом случае скорость химической реакции численно равна изменению концентрации одного из реагирующих веществ в единицу времени.
Из уравнения следует, что скорость реакции всегда положительна. Производная д Сi / д? характеризует скорость реакции для данного вещества. Он имеет отрицательное значение для исходных материалов, так как их концентрация во время реакции уменьшается, и положительно для продуктов реакции. Их количество увеличивается со временем.
Основным законом химической кинетики является закон действующих масс, который выражает зависимость скорости химической реакции от концентрации реагирующих (исходных) веществ.
Константа скорости химической реакции зависит от природы реагирующих веществ, температуры и факторов, влияющих на ход реакции.
Называется порядок химической реакции, т.е. порядок химической реакции равен сумме показателей степени концентрации реагентов в кинетическом уравнении реакции и является экспериментальным значением.
Порядок для данного вещества (частный заказ) определяется как показатель степени концентрации этого вещества в уравнении для скорости реакции.
Молекулярность химической реакции равна числу исходных молекул (или других частиц), участвующих в элементарном акте этой реакции. В этом случае количество молекул продукта реакции не имеет значения. Мономолекулярные, бимолекулярные и тримолекулярные реакции различаются в зависимости от количества исходных молекул. Молекулярность реакции является теоретической концепцией.
Порядок и молекулярность реакции совпадают только для простых реакций, происходящих в полном соответствии с их стехиометрическим равновесием и законом действия массы.
Порядок и молекулярность реакции не совпадают, если:
- один из компонентов находится в большом избытке;
- реакция имеет сложный механизм;
- на его ход влияют катализаторы или ингибиторы.
Виды химических реакций
В химической кинетике рассматриваются несколько типов химических реакций.
Необратимые (односторонние) называются реакциями, которые идут только в одном направлении. В таких реакциях продукты представляют собой осадок, газы или слаборастворимые химические соединения.
Двусторонние (обратимые) реакции называются реакциями, которые происходят одновременно в противоположных направлениях.
Параллельные реакции — это те, которые происходят одновременно в нескольких направлениях (стадиях) с образованием различных продуктов.
Скорость процесса из параллельных этапов определяется самой быстрой стадией.
Последовательные реакции состоят из нескольких этапов, следующих друг за другом. Скорость процесса от последовательных этапов определяется самой медленной.
Цепные реакции — это самоподдерживающиеся химические реакции, в которых первоначально появляющиеся продукты участвуют в образовании новых продуктов. Цепные реакции проходят три основных этапа: зарождение (инициация), развитие и разрыв цепи.
Фотохимические реакции связаны с воздействием света на вещество (например, фотосинтез). Отношение количества молекул продукта к количеству световых квантов, инициирующих реакцию, называется квантовым выходом.
Влияние температуры на скорость химической реакции
Скорости большинства реакций увеличиваются с повышением температуры. Существует приблизительное правило Ван Гоффа: при повышении температуры на каждые 10 ° скорость реакции увеличивается в 2-4 раза. В соответствии с этим правилом повышение температуры на 100 К приводит к увеличению скорости реакции примерно в 10 60 тысяч раз. Большинство простых реакций подчиняются этому правилу, но есть исключения. Например, для гидролиза метилацетата константа скорости при 308 К в 1,82 раза больше константы скорости при 298 К, а для гидролиза сахарозы с таким же повышением температуры скорость увеличивается в 4,13 раза.
До недавнего времени энергия активации рассматривалась в теории химической кинетики как эмпирическая постоянная. Но теперь существует возможность приблизительной оценки его с помощью квантовой химии.
Превышение средней энергии активированного комплекса над средним уровнем энергии исходных материалов приблизительно принимается за энергию активации. Это зависит от характера реагирующих (исходных) веществ и характеризует изменение скорости реакции от температуры. Чем выше энергия активации, тем быстрее скорость реакции увеличивается с ростом температуры.
В системе координат 1pK — 1 / T соотношение представляет собой прямую линию. Это так называемый график Аррениуса, и считается, что реакции, которые дают прямую линию в этих координатах, демонстрируют поведение Аррениуса.
Уравнение Аррениуса достаточно хорошо выполняется для простых гомогенных и многих гетерогенных реакций. Отклонение от этого закона указывает на сложный характер продолжающейся реакции. Форма выражения Аррениуса может быть получена из следующих рассуждений.
Предположим, что константа скорости реакции второго порядка является результатом бимолекулярной реакции. Для его хода необходимы два условия.
Прежде всего, молекулы должны встретиться друг с другом, то есть их столкновение должно произойти. Обозначим через Z скорость, с которой эти столкновения происходят в единице объема в газовой фазе. В газе при атмосферном давлении частота столкновений составляет приблизительно 1028 л / с см3 даже при комнатной температуре. Если бы столкновения были единственным фактором, необходимым для протекания реакции, то все газовые реакции заканчивались бы через 10 -9 с (произошел взрыв), но это не так. Кроме того, частота столкновений зависит от квадратного корня температуры. Поэтому, если учесть только количество столкновений молекул, мы получим нелепо высокую скорость реакции и ее невероятно невероятную температурную зависимость.
Другим необходимым условием проведения реакции является то, что молекулы при столкновении должны обладать достаточной энергией. Слабое столкновение не приводит к реакции; столкновение должно быть сильным. Если предположить, что для того, чтобы реакция произошла, сталкивающиеся молекулы должны иметь, по крайней мере, энергию Ea, то частота столкновений должна быть умножена на долю молекул, сталкивающихся с энергией Ea. Эта доля определяется уравнением Больцмана и равна exp (-Ea / RT) для данной системы при температуре T. Из этого следует, что температурная зависимость скорости реакции может быть выражена уравнением: W = Z * exp (-Ea / RT), где Z — количество столкновений.
При обычных температурах доля энергетически достаточных столкновений очень мала; следовательно, вышеприведенное выражение предсказывает скорость, которая намного ниже, чем значение Z. Более того, оно предсказывает экспоненциальную температурную зависимость скорости реакции, поскольку доля энергетически достаточных столкновений экспоненциально увеличивается. Это связано с температурой.
Таким образом, уравнение качественно аналогично уравнению Аррениуса, но дает меньшую скорость химической реакции. Это связано с тем, что в реакции могут участвовать частицы с энергией не только Ea, но и с более высокой энергией. На самом деле экспериментальная зависимость скорости реакции от температуры намного сильнее, чем зависимость Z от квадратного корня от температуры.
Например, для типичных энергий активации (около 50-100 кДж / моль) скорость удваивается при увеличении температуры на 10 °, но частота столкновений изменяется только (308/298) 1/2 = 1,02 раза при том же повышении температуры , С повышением температуры влияние этого фактора уменьшается.
Экспериментальные данные показывают, что энергия активации, как правило, намного меньше энергии разрыва химических связей в ходе этой реакции, то есть энергии диссоциации реагирующих молекул. Это можно объяснить тем фактом, что расход энергии на разрушение старых связей сопровождается выделением энергии при образовании новых химических связей в продуктах реакции, то есть происходит частичная компенсация затрат энергии. Для количественной оценки этого явления российский ученый Г.К. Боресков предложил значение%.
При полном разрыве связей, без компенсации образования новых связей, энергия активации совпадает с E d и? = 0. Уменьшение энергии активации соответствует возрастающей компенсации, а для Ea = 0 значение = 1 полной компенсации. Для некаталитических реакций со стабильными молекулами степень компенсации обычно не превышает 70%.
Каталитические реакции
Каталитические реакции — это реакции, которые происходят с участием каталитических веществ, которые не являются частью конечных продуктов. Катализаторы взаимодействуют с участниками этой реакции, образуют с ними одно или другое промежуточное вещество, входят в активный комплекс и извлекаются после реакции. Различают положительный катализ (ускорение реакции) и отрицательный катализ (замедление реакции или торможение).
В некоторых случаях катализатор является одним из продуктов реакции. Эта реакция называется автокаталитической. При гомогенном катализе катализатор и все реагенты составляют одну фазу. Различают следующие виды гомогенного катализа: кислотно-основной катализ органических реакций, катализ d-переходными ионами и катализ металлорганическими комплексами. В гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах, и каталитическая реакция протекает на границе раздела. Гетерогенный катализ включает пять обратимых стадий: диффузия реагентов, адсорбция (сначала физическая, затем химическая), химическая реакция, десорбция продуктов и их диффузия.
Все гетерогенные катализаторы можно разделить на четыре класса: d-переходные металлы, оксиды полупроводников, изоляторы (диэлектрики) и кислотные катализаторы.
Особый тип катализаторов представляют собой ферменты — белковые молекулы с молекулярной массой от 105 до 107 г / моль.
Эти катализаторы характеризуются следующими свойствами:
- энзим способен катализировать только одну конкретную реакцию или реакцию одного типа;
- обладают высокой эффективностью даже в очень небольших количествах;
- обладают наибольшей активностью при температуре 310 К (температура тела человека, при температуре выше 323-333 К, разрушается;
Ферменты очень чувствительны к наличию каталитических ядов.
Каталитические реакции характеризуются следующими общими особенностями:
- Катализатор не влияет на термодинамическое равновесие. Изменяется только скорость достижения состояния равновесия.
- Действие катализатора является специфическим. Из всех возможных реакций этих реагирующих веществ конкретный катализатор селективно усиливает лишь немногие.
- Скорость гомогенной каталитической реакции чаще всего пропорциональна концентрации катализатора.
- Действие катализатора зависит от его физического состояния и наличия посторонних веществ. Промоторы усиливают действие катализатора, а каталитические яды снижают активность катализатора.
- Смесь катализаторов часто действует значительно сильнее, чем отдельные катализаторы.
Сущность каталитического действия
Если энергия активации высока, то только небольшая часть сталкивающихся молекул имеет достаточно энергии для протекания реакции, а если она мала, реагирует большая часть молекул, и поэтому константа скорости будет большой. Из этого следует, что если энергия активации может быть уменьшена каким-либо образом, то реакция должна протекать с более высокой скоростью.
Катализатор — это вещество, которое заставляет реакцию протекать быстрее, уменьшая энергию активации ограничивающей стадии. Некоторая мера эффективности катализаторов может быть получена путем рассмотрения изменений энергии активации различных реакций, которые обусловлены присутствием катализаторов. Когда перекись водорода разлагается в отсутствие катализатора, энергия активации составляет 76 кДж / моль, и разложение происходит очень медленно при комнатной температуре. При добавлении небольшого количества йодида происходит та же самая реакция, но с энергией активации 57 кДж / моль, и, таким образом, при комнатной температуре (когда RT = 2,5 кДж / моль) константа скорости предельной стадии увеличивается в К (катализатор) / К (без катализатора) = е7,6? 2000 раз.
Более значительное изменение энергии активации происходит при добавлении ферментов в биохимические системы.
Фермент — это биологическая молекула, которая очень эффективна. Это иллюстрируется изменением энергии активации в реакции гидролиза сахарозы с 107 кДж / моль в присутствии иона гидрооксония до 36 кДж / моль с добавлением небольшого количества фермента сахарозы. Такое изменение энергии активации соответствует изменению значения скорости на 22 порядка.
Методы расчета энергии активации и предэкспоненциального коэффициента
В большинстве случаев для расчета энергии активации Ea по экспериментальным данным используйте интегральную форму уравнения Ванта-Хоффа-Аррениуса (6) или запишите ее в виде: logK = logKo — E a / 2,303 RT.
Поэтому logK линейно зависит от обратной абсолютной температуры.
Значение Ea определяется по наклону прямой, проходящей через экспериментальные точки: E a = -2,303Rtg?.
Предэкспоненциальный множитель K0 определяется резким отрезанным продолжением линии на оси ординат при 1 / Т = 0.
Если существуют значения константы скорости химической реакции при двух температурах, то из уравнения (9) можно получить: Еа = (2,303RT1T2 logK2 / K1) / (T2-T1).
Энергия активации Ea имеет размерную энергию / моль и измеряется в единицах Дж / моль. Размерность K0 совпадает с размерностью константы скорости. Теория и экспериментальные данные (для широкого диапазона температур) показывают, что Ea и K зависят от температуры. Однако эта зависимость не может быть учтена, если реакции изучаются в достаточно узком интервале температур.
Приведенный выше метод расчета Еа предполагает, что константы скорости реакции при различных температурах известны.
Однако существует метод вычисления Ea, так называемый метод преобразования, который не требует знания K = f (T).
Пусть химическая реакция протекает при температурах T1 и T2 в смесях одинакового исходного состава. Если в моменты времени? 1 а? 2 реакция прошла на ту же глубину, то есть изменения концентраций исходных веществ или продуктов реакции одинаковы.
Вывод:
Сильное изменение скорости реакции с температурой связано с тем, что только химические молекулы (частицы), обладающие достаточной энергией для осуществления этой реакции, вступают в химическое взаимодействие. Неактивные частицы могут стать активными, если вы скажете им необходимую дополнительную энергию — этот процесс называется активацией. Одним из способов активации является повышение температуры: с увеличением температуры число активных частиц значительно увеличивается, вследствие чего скорость реакции резко возрастает.
Энергия, которая должна сообщаться молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации.
Он определяется опытным путем, обозначается буквой Ea и обычно выражается в кДж / моль. Так, например, для соединения водорода с йодом (Н2 + I2 = 2HI) Е = 167,4 кДж / моль, а для разложения йодистого водорода (2HI = Н2 + I2) Е = 186,2 кДж / моль.
Энергия активации Ea зависит от природы реагирующих веществ и является характеристикой каждой реакции. Эти представления на примере реакции в общем виде A2 + B2 = 2AB. Ось ординат характеризует потенциальную энергию системы, ось абсцисс представляет ход реакции: начальное состояние переходное состояние конечное состояние. Чтобы реагенты А2 и В2 образовали продукт реакции АВ, они должны преодолеть энергетический барьер С. На это расходуется энергия активации Ea, значение которой увеличивает энергию системы. Более того, в ходе реакции промежуточная нестабильная группа образуется из частиц реагирующих веществ, называемых переходным состоянием или активированным комплексом (в точке C), последующее разложение которых приводит к образованию конечного продукта AB ,
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
http://lfirmal.com/uravnenie-arreniusa-energiya-aktivacii-himicheskoj-reakcii/
http://natalibrilenova.ru/ponyatie-ob-energii-aktivatsii-aktivirovannyij-perehodnyij-kompleks/