Анодные и катодные реакции
При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Me n + , OH — и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
Поскольку электродный потенциал карбида железа больше, чем потенциал железа, то в коррозионном гальваническом элементе Fe½H + ½Fe3C катодом будет карбид железа, а анодом железо. Учитывая, что 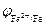
анод (Fe): Fe 0 ® Fe 2+ + 2ē
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe 0 + 2H + ® Fe 2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( 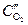
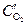
Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( 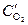
катод (Cu( 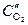
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al 0 ® Al 3+ + 3ē
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:

Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 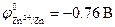
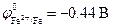
анод (Zn): Zn 0 ® Zn 2+ + 2ē
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия
Анодный и катодный процессы при атмосферной коррозии
Как правильно решать задачи на атмосферную коррозию
Задание 281.
Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Олово имеет менее отрицательный стандартный электродный потенциал (-0,14 В), чем железо (-0,44 В), поэтому оно является катодом, железо – анодом. При контакте олова и железа в атмосфере разрушаться будет железо:
Анодный процесс: Fe 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2.
б) Цинк имеет более отрицательный стандартный электродный потенциал (-0,763 В), чем железо (-0,44 В), поэтому он является анодом, железо – катодом.
Анодный процесс: Zn0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Zn 2+ с гидроксид-ионами ОН – образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Задание 282.
Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
Решение:
Стандартный электродный потенциал для полуреакции Cu 0 — 2 
Анодный процесс: Zn 0 — 2 
Катодный процесс: 2Н + + 2 
Ионно-молекулярная форма процесса:
Zn 0 + 2H + = Zn 2+ + Н20↑
Таким образом, при опускании в раствор разбавленной кислоты медной пластинки, контактирующей с цинковой пластинкой, наблюдается выделение пузырьков газообразного водорода, так как протекает реакция:
Zn 0 + 2H + = Zn 2+ + Н20 ↑
Задание 283.
Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Коррозия лужёного железа в атмосферных условиях. Стандартный электродный потенциал системы: Sn 0 — 2 

Анодный процесс: Fe 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Fe 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2.
б) Коррозия лужёной меди в атмосферных условиях. Олово имеет более отрицательный стандартный электродный потенциал (-0,14 В), чем медь (+0,34 В), поэтому оно является анодом, мед – катодом. При контакте олова и меди в атмосфере разрушаться будет олово:
Анодный процесс: Sn 0 — 2 
Катодный процесс в нейтральной среде: 1/2O2 + H2O + 2 
Так как ионы Sn 2+ с гидроксид-ионами ОН- образуют нерастворимый гидроксид, то продуктом коррозии будет Sn(OH)2.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2edd002c078fe5 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://buzani.ru/zadachi/khimiya-shimanovich/948-atmosfernaya-korroziya-zadaniya-281-283
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/281.html