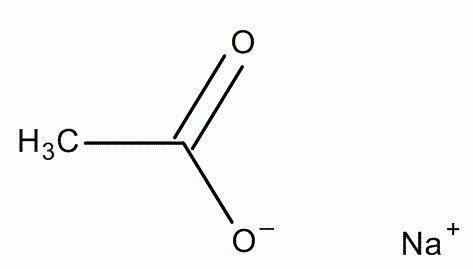
Уравнение ацетата натрия с соляной кислотой
Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ОРГАНИЧЕСКИЙ ПРОДУКТ РЕАКЦИИ | ||
| А | Б | В | Г |
А) Реакция спирта с неорганической кислотой, это реакция обмена. В ходе которой группа спирта отходит к водороду кислоты, а хлорид от кислоты становится на ее место и получается 2-хлорпропан под цифрой 4.
Б) Реакция ацетата натрия с соляной кислотой — это просто реакция обмена между солью (просто кислотный остаток от органической кислоты) и кислотой. Получается хлорид натрия и уксусная кислота под цифрой 1.
В) Реакция ацетата натрия с бромэтаном — это реакция обмена, в ходе которой к натрию вместо кислотного остатка присоединяется бром, а к кислороду вместо натрия идет этил, образуя этиловый эфир уксусной кислоты.
Г) Взаимодействие предельной карбоновой кислоты с хлором, приводит к замещению протона в альфа положении от карбоксильной группы хлором. Реакция Гелла-Фольгарда-Зелинского.
Электролиз солей карбоновых кислот (реакция Кольбе)
Электролиз по Кольбе – это электролиз растворов солей карбоновых кислот. В ходе реакции образуются соответствующие алканы.
Например, рассмотрим электролиз водного раствора ацетата натрия CH3COONa. В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO – + Na +
При этом на катод притягиваются катионы натрия Na + и молекулы воды H2O. Восстанавливаться на катоде будут молекулы воды, т.к. окислительные свойства ионов водорода превышают окислительные свойства катионов щелочных металлов:
K(-): 2H2O + 2e = H2 + 2OH –
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы. При этом от карбоксильной группы остаются метильные радикалы, которые образуют газообразный этан.
A(+): 2CH3COO – — 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
В общем виде получается:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
То есть при электролизе раствора пропионата натрия образуется бутан:
Ацетат натрия (свойства и применение)
Это химическое вещество многие знают под бытовым названием «горячий лед». На самом деле, ацетат натрия (C2H3O2Na) представляет собой искусственные кристаллы тех солей, которые входят в состав уксусной кислоты. Данное вещество широко распространено в природе. Оно имеется в составе многих клеток растительного и животного происхождения, поэтому ацетат натрия можно обнаружить во многих фруктах и ягодах. Также его образование происходит в ходе бактериальной ферментации, что приводит к его появлению в кисломолочных продуктах.
Свойства химического вещества
Ацетат натрия не без основания назвали «горячим льдом», поскольку в экзотермическом процессе кристаллизации он сильно нагревается. Это вещество имеет кристаллическую структуру. Оно практически бесцветно и имеет слабо выраженный запах уксусной кислоты. Его кристаллы обладают отличительной чертой: в эфире и спирте они очень плохо растворяются, а вот во время взаимодействия с водой они очень быстро превращаются в раствор ацетата натрия. Так, 76 г этого вещества растворяется в 100 мл H2O. Ацетат натрия обладает низким уровнем токсичности и не горюч. Удельная теплота его плавления составляет 264-289 к, а температура разложения: 324 °C. Ацетат натрия, тригидрат которого имеет точку плавления 58 °C, при нагревании до 100 °C в емкости, находящейся к кипятке, растворяется в своей кристаллизационной воде (расплавляется). Таким образом, он преобразуется в раствор. При его охлаждении наблюдается перенасыщение этого вещества в воде. Такой раствор замечательно переохлаждается до температуры 20-24 °C без образования его твердой фазы. После нажатия на металл в емкости происходит образование центра кристаллизации. В процессе роста он заставляет этот раствор преобразовываться в твердую фазу тригидрата натриевого ацетата. Этот процесс сопровождает значительное выделение тепла (264-289 кДж/кг).
Способы получения ацетата натрия
Как сделать ацетат натрия в домашних условиях
Другими словами, получение ацетата в домашних условиях называют «гашением соды». В результате этой химической реакции получается нестойкое соединение, моментально разлагающееся на воду и углекислый газ. Во время выпаривания получившегося раствора образуется кристаллический ацетат натрия. Как правило, для его получения берут соду и кислоту в соотношениях: 84 г гидрокарбоната натрия с 750 г винного уксуса (8%) или с 86 г уксусной эссенции (70%). В последнем случае выпаривание не понадобится. В результате реакции получается около 80 г ацетата натрия.
Другие названия ацетата натрия
Чаще всего для обозначения данного вещества используют такие его синонимы: натриевая соль уксусной кислоты, натриевый ацетат, натрия этаноат.
Применение ацетата натрия в качестве пищевой добавки
Данное вещество применяют в различных отраслях. Так, в пищевой промышленности его используют в качестве консерванта под обозначением Е262. На сегодняшний день производство некоторых продуктов питания без него не обходится. Так, ацетат натрия добавляют в муку для защиты хлебобулочных изделий от так называемой «картофельной болезни», вызываемой спорообразующими бактериями Bacillus mesentericus, очень распространенными в природе. При производстве чипсов также используют эту добавку для придания им приятного вкуса и аромата. Е262 добавляют и в овощные консервы, поскольку ее воздействие на продукты смягчает очень острый привкус уксусной кислоты. Многие люди очень настороженно относятся к различного рода пищевым добавкам. На самом деле, Е262 благодаря своей низкой токсичности разрешена к применению во всех европейских странах. В РФ также не устанавливалась максимальная ежедневная доза употребления ацетата натрия.
Использование в медицине
Также не редко использование данного вещества в медицинских целях. Оно имеется в составе многих лекарственных средств. Так, в частности, его можно обнаружить во многих мочегонных препаратах. Ацетаты натрия применяются в качестве ощелачивающих средств при матаболическом ацидозе и гипонатриемии.
Применение вещества в других отраслях
Помимо вышеперечисленных областей применения ацетат натрия используют в текстильной промышленности и строительстве. Данное вещество используется для нейтрализации уже отработанной серной кислоты, попадающей в сточные воды. Ацетат натрия применяют как фоторезист в процессе обработки тканей анилиновыми красителями. Он также используется в процессе дубления кож солями хрома (протравливание). Ацетат натрия во время производства синтетических резин замедляет вулканизацию хлоропрена. Его используют как противоморозную добавку для любых разновидностей бетона при производстве монолитных конструкций. Это вещество применяют в производстве так называемых «химических» обогревателей и грелок. Это обусловлено его способностью нагреваться до довольно высоких температур. Ацетат натрия является основным компонентом широко распространенной смеси под названием «горячий лед». Применяется это вещество и в производстве уксусного ангидрида, мыл, ацетилхлорида, ацетатов меди, винилацетата и других химикатов. Он используется как катализатор поликонденсации и компонент кислотных закрепителей для фотографий. Его применяют для получения электролитов и буферных растворов в гальванотехнике.
Негативные свойства вещества
Хотя ацетат натрия и малотоксичен, чрезмерное его употребление все-таки может нанести заметный ущерб здоровью человека. Так, его не рекомендуют людям, страдающим от таких заболеваний: артериальная гипертензия, вегето-сосудистая дистония, дисбактериоз. Следует значительно ограничить потребление продуктов, содержащих Е262 и тем, у кого наблюдаются проблемы с кишечником, мочевыводящими путями, печенью, желчным пузырем. Это обусловлено тем, что ацетат натрия в кишечники нередко превращается в токсичные нитраты, обладающие канцерогенным действием. Именно поэтому медики предупреждают о том, что чрезмерное потребление продуктов, содержащих Е262, может привести к образованию злокачественных опухолей, отравлениям и возникновению аллергических реакций. Ацетат натрия нельзя применять при производстве детских пищевых продуктов, поэтому наличие на упаковке маркировки Е262 является серьезной причиной отказа от их покупки.
Признаки отравления ацетатом натрия
К ним относятся: головокружение, головная боль, бледность кожи, острые болевые ощущения в животе, нарушение координации, затруднение дыхания, судороги, обмороки.
Взаимодействие ацетата натрия с другими веществами
Сочетание этого химиката с муравьиной кислотой дает аддукты. В результате его соединения с оксидом азота образуется нитрит натрия и уксусный ангидрит. Такие вещества, как ацетат натрия + концентрированная серная кислота, в соединении дают уксусную кислоту.
http://chemege.ru/elektroliz-solej-karb-kislot/
http://www.syl.ru/article/141235/mod_atsetat-natriya-svoystva-i-primenenie