Уравнение баланса энтропии в интегральном виде
Вопрос заключается в том, чтобы переписать уравнение, выражающее второе начало термодинамики, (2.2) таким образом, чтобы оно характеризовало потоки энтропии и скорость изменения энтропии перерабатываемого вещества при его прохождении через технологическую систему. Схема вывода уравнения баланса энтропии в требуемой форме аналогична выводу уравнения баланса потоков энергии (см. раздел 3.2).
Пусть массовый поток вещества через систему равен 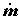
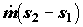
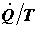
обозначим в соответствии с формулировкой второго начала (2.2) через 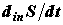
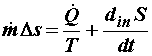
где 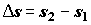
Уравнение (4.10) нетрудно обобщить на ту ситуацию, когда в теплообмене с внешним окружением участвуют части системы с разными температурами.
Сохраняя обозначения, принятые в предыдущем разделе 4.2.1, получим
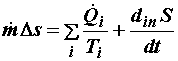
Наконец, перепишем (4.11) в форме, отвечающей дифференцированному учету каждого входа и выхода материальных потоков, аналогичной уравнению баланса потоков энергии (3.10) :
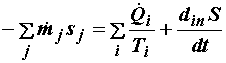
где sj – удельная энтропия j -го материального потока.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
термодинамика неравновесных процессов
ТЕРМОДИНАМИКА НЕРАВНОВЕСНЫХ ПРОЦЕССОВ -общая теория макроскопич. описания термодинамически неравновесных процессов. Её наз, также н е р а вн о в е с н о й т е р м о д и н а м и к о й или т ер м о д и н а м и к о й н е о б р а т и м ы х п р о ц е с с о в.
Впервые термодинамич, соображения были применены к необратимым процессам В. Томсоном (Кельвином) в 1854. Последоват. изучение неравновесных процессов термодинамич. методами началось с работ Л. Онсагера, установившего в 1931 соотношения взаимности для коэф. феноменологич. законов, к-рым подчиняются необратимые процессы. Как самостоят. наука Т. н. п. стала развиваться в работах Дж. Мейкснера, И. Пригожина и С. де Гроота.
Классич. термодинамика даёт полное количеств. описание равновесных (обратимых) процессов, поэтому её иногда называют термостатикой. Для неравновесных процессов она устанавливает лишь неравенства, к-рые указывают направление этих процессов (напр., Клаузиуса неравенство). Осн. задача Т. н. п.- количеств. изучение неравновесных процессов для. состояний, не сильно отличающихся от равновесных, в частности определение скоростей неравновесных процессов в зависимости от внеш. условий. В Т. н. п. системы, в к-рых протекают неравновесные процессы, рассматривают как непрерывные среды, а их параметры состояния-как полевые переменные, т. е. непрерывные ф-ции координат и времени. Для макроскопич. описания неравновесных процессов систему представляют состоящей из элементарных объёмов (физически бесконечно малых элементов среды), к-рые всё же настолько велики, что содержат очень большое число частиц. Состояние каждого выделенного элемента среды характеризуется темп-рой, плотностью, хим. потенциалами и др. термодинамич. параметрами, зависящими от координат и времени. Количеств. описание неравновесных процессов заключается в составлении ур-ний баланса для элементарных объёмов на основе законов сохранения массы, энергии и импульса, а также ур-ния баланса энтропии и феноменологич. ур-ний для рассматриваемых процессов, выражающих потоки массы, импульса и энергии через градиенты термодинамич. параметров. Методы Т. н. п. позволяют сформулировать для неравновесных процессов первое и второе начала термодинамики в локальной форме (в зависимости от положения элемента среды), получить из общих принципов, не рассматривая деталей взаимодействия частиц, полную систему ур-ний переноса, т. е. ур-ния гидродинамики, теплопроводности и диффузии для простых и сложных систем (с хим. реакциями между компонентами, с учётом эл—магн. полей и др. факторов).
Законы сохранения. Для многокомпонентной системы поток массы в элемент объёма равен r k u k , где r k -плотность, u k -массовая скорость потока частиц данного вида; следовательно, з а к о н с о х р а н е н и я м а с с ы k-гo компонента имеет вид
Для суммарной плотности 

Изменение импульса элементарного объёма может происходить за счёт движения частиц, внутр. напряжений в среде P ab и внеш. сил F k , действующих на единицу массы k-гo компонента. З а к о н с о х р а н е н и я и м п у л ь с а, применённый к элементарному объёму среды, позволяет получить осн. ур-ния гидродинамики (Навье — Стокса уравнения):
где u a — декартовы компоненты скорости u, P ab =pd ab + p ab — тензор напряжений, р-давление, d ab — символ Кронекера, p ab — тензор вязких напряжений. З а к о н с о х р а н е н и я э н е р г и и для элементарных объёмов представляет собой первое начало термодинамики в Т. н. п. Плотность полной энергии складывается из плотности кинетич. энергии ru 2 /2, плотности потенц. энергии и плотности внутр. энергии ru (энергии теплового движения частиц и энергии их короткодействующих взаимодействий). Для рм из закона сохранения энергии получается ур-ние баланса (первое начало термодинамики в Т. н. п.):
где J q — поток тепла, 

Уравнение баланса энтропии. Второе начало термодинамики в Т.н.п. выражает баланс энтропии 
s>=0, dW — элемент поверхности системы. Отсюда следует ур-ние баланса энтропии в дифференц. форме:
Если имеют место необратимые процессы, s > 0, энтропия (в отличие от массы, энергии и импульса) не сохраняется. В Т. н. п. принимают, что уд. энтропия s является такой же ф-цией внутр. энергии и, уд. объёма w=1/r и концентраций c k , как и в состоянии полного термодинамич. равновесия, и, следовательно, для неё справедливы обычные термодинамич. равенства (г и п о т е з а л о к а л ь н о г о р а в н о в е с и я). Эту же гипотезу используют и в неравновесной статистич. термодинамике. Предполагают, что термодинамич, ф-ла 
где все производные во времени являются полными.
Для плотности потока энтропии получается выражение, зависящее от плотности потока тепла J q и плотности потока диффузии J k :
а для локального производства энтропии — выражение, зависящее от потоков и градиентов термодинамич. параметров:
Т.о., локальное производство энтропии вызывается необратимыми процессами теплопроводности, диффузии и вязкости. В системах с хим. реакциями появляется ещё один член, связанный с хим. сродством реакций.
Положительность локального производства энтропии (s>0), очевидная из ф-лы (*), выражает в Т.н.п. закон возрастания энтропии (второе начало термодинамики). Возможное изменение плотности энтропии вследствие втекания её в элемент объёма или вытекания из него не связано с необратимыми процессами и может иметь любой знак. Интегрирование ур-ния баланса энтропии по объёму системы с учётом (*) даёт для полной энтропии S соотношение 
Локальное производство энтропии (*) представляет собой сумму произведений потоков (напр., диффуз. потока J k , теплового потока J q , тензора вязких напряжений p ab ) и сопряжённых им термодинамич. сил Х i :
Термодинамич. силы Х i пропорц. градиентам термодинамич. параметров, вызывающим неравновесные процессы. Величины J i , X i могут быть векторами (теплопроводность и диффузия), тензорами (сдвиговая вязкость), скалярами (объёмная вязкость, скорость хим. реакции). Поэтому со-ответств. процессы наз. векторными, тензорными или скалярными.
Феноменологические уравнения. В Т. н. п. исходят из того, что при малых отклонениях системы от термодинамич. равновесия возникающие потоки линейно зависят от термодинамич. сил и описываются феноменологич. ур-ниями типа 


В стационарном состоянии величина s минимальна при заданных внеш. условиях, препятствующих достижению равновесия (Пригожина теорема ).В состоянии термодинамич. равновесия s = 0.
Одна из осн. теорем Т. н. п.- Онсагера теорема взаимности, связанная с инвариантностью ур-ний движения относительно обращения времени, согласно к-рой в отсутствие магн. поля и вращения системы как целого онсагеров-ские кинетич. коэф. для потоков одинаковой чётности симметричны: L ik = L ki . Если на систему действует внеш. магн. поле Н или она вращается с угл. скоростью w, то
Это связано с тем, что силы Лоренца и Кориолиса не изменяются при изменении скоростей всех частиц на обратные лишь в том случае, если одновременно меняется на противоположное направление магн. поля или скорости вращения (см. Онсагера теорема).
При определ. свойствах пространственной симметрии системы феноменологич. ур-ний упрощаются. Напр., в изотропной системе потока и термодинамич. силы, имеющие разную тензорную размерность, не могут быть связаны между собой (частный случай Кюри принципа в Т.н. п.). Поэтому в производство энтропии могут входить произведения потоков и термодинамич. сил лишь одинаковой тензорной размерности: скаляры, полярные векторы, аксиальные векторы, симметричные тензоры с нулевым следом.
С учётом принципа Кюри и соотношений Онсагера Т. н. п. даёт для потока тепла J q и потока J 1 массы первой компоненты в бинарной (п = 2 )смеси феноменологич. ур-ния
Вместо феноменологич. коэф. L qq . L 11 , L 1q можно ввести коэф. теплопроводности l=L qq /T 2 , коэф. диффузии D·=L 11 m 11 /rc 2 T, коэф. термодиффузии D’ = L 1q /rc 1 c 2 T 2 , коэф. Дюфура D» = D’.
В случае вязкого течения изотропной жидкости феноменологич. ур-ние для тензора вязких напряжений имеет вид
h-сдвиговая вязкость, z — объёмная вязкость, d ab — символ Кронекера.
Т. н. п. позволяет описать неравновесные процессы в прерывных системах, напр. перенос тепла и массы между резервуарами, связанными капилляром, пористой стенкой или мембраной, если можно пренебречь объёмом капилляра или пор. В этом случае термодинамич. параметры меняются скачком. Если ввести приведённые величины:
поток тепла (где j u — изменение внутр. энергии, h k — уд. энтальпия), потоки диффузии j k =j k -c k j n /c n , (k= 1, 2, . n— 1), объёмный поток 
Эти ур-ния описывают эффект термомолекулярного давления- возникновение конечной величины Dp/DT при j q = 0, j w = 0, термоэффузию — возникновение разности концентраций Dс k /DT при j q =0, j w = 0, механокалорич. эффект — существование стационарного состояния с переносом тепла при DT=0 и фиксированном перепаде давления Dр (при j k = 0). Т.н.п. прерывных систем позволяет описать также осмотическое давление (см. Осмос)и электрокинетические явления.
Т. н. п. используют для объяснения мн. неравновесных явлений в проводниках, напр, термоэлектрических явлений, гальваномагнитных явлений, термогальваномагнит-ных явлений. Она даёт теоретич. основу для исследования открытых систем.
Вывод законов Т. н. п. из законов механики (классич. и квантовой) и получение выражений для кинетич. коэф, через параметры, характеризующие строение вещества, входят в задачу н е р а в н о в е с н о й с т а т и с т и ч е с к о й т е р м о д и н а м и к и, к-рая относится к Т. н.п. так же, как статистич. термодинамика к термодинамике (см., напр., Грuнa — Кубо формулы). Обоснование Т.н. п. для газов даёт кинетическая теория газов.
Лит.: Пригожин И., Введение в термодинамику необратимых процессов, пер, с англ., М., 1960; Термодинамика необратимых процессов, пер. с англ., М., 1962; де Гроот С., Мазур П., Неравновесная термодинамика, пер. с англ., М., 1964; Хаазе Р., Термодинамика необратимых, процессов, пер. с нем., М., 1967; Зубарев Д. Н., Неравновесная статистическая термодинамика, М.. 1971; Дьярмати И., Неравновесная термодинамика. Теория поля и вариационные принципы, пер. с англ., М., 1974; К айзер Д., Статистическая термодинамика неравновесных процессов, пер. с англ., М., 1990. Д. Н. Зубарев.
Уравнение баланса энтропии
4.5 Уравнение баланса энтропии
Уравнение баланса энтропии в общем виде можно записать следующим образом:

где JS – поток энтропии через границы системы, Σ – производство энтропии (источник энтропии). Следствием второго начала термодинамики является то, что в изолированной системе энтропия не может убывать. Это означает, что производство энтропии не может быть отрицательно:

Рассмотрим производство энтропии на примере диффузии газа в сплошной среде. Два объема V1 и V2 соединены капилляром и представляют вместе изолированную систему. Поскольку система изолирована, то поток энтропии через ее границы равен нулю. В таком случае производство энтропии может быть определено так:

где S1 и S2 энтропии вещества, находящегося в объемах. Каждую из этих величин можно записать на основе первого начала термодинамики:

Рекомендуемые файлы

Здесь мы пренебрегли изменением объема, а, следовательно, и работой, совершаемой одной системой над другой. Тогда получим:

Но ввиду изолированности системы суммарная внутренняя энергия и число частиц сохраняются:



Определим производные следующим образом:


Преобразуем величины в скобках, имея в виде, что отклонение от равновесия в каждой системе мало:


Введем так же поток тепла:

В результате получим для производства энтропии:

Видим, что производство энтропии может быть представлено в виде суммы произведений потоков и соответствующих им сил:

Заметим, что выбор потоков (или сил) произволен – можно было выбрать поток энергии.
Поскольку система изолирована, то производство энтропии в ней – величина положительная. В данном случае это можно проиллюстрировать тем, что тепло переходит от более нагретого тела к менее нагретому, или частицы движутся в область с меньшим химическим потенциалом.
В условиях, когда допустимо представление о локальном равновесии можно построить последовательную феноменологическую термодинамику необратимых процессов. Свойства неравновесной системы при этом определяются локальными термодинамическими потенциалами, которые зависят от пространственных координат и времени только через характеристические термодинамические параметры, для которых справедливы уравнения термодинамики.
Рассмотрим теперь в произвольной системе малый объем и запишем аналогично производство энтропии для этого объема. Для простоты примем, что процессы переноса происходят только вдоль оси x. Тогда объем будет представлять собой цилиндр площадью S и длиной Δx. Тогда имеем:

где σ – плотность производства энтропии. Преобразуем:

Переходя к пределу, имеем:

Видим, что плотность производства энтропии может быть представлена в виде суммы произведений плотностей потоков и соответствующих им сил. В данном случае силы будут представлять собой градиенты:


http://www.femto.com.ua/articles/part_2/4052.html
http://studizba.com/lectures/73-fizika/1064-osnovy-statisticheskoy-fiziki/19466-45-uravnenie-balansa-entropii.html














