Уравнение бернулли для определения градиента давления в сердце
1. Площадь отверстия аортального клапана. У здорового человека площадь отверстия аортального клапана (ПОАК) составляет 3-4 см 2 . Согласно рекомендациям Американской коллегии кардиологов и Американской ассоциации кардиологов (АСС/АНА), выделяют три степени стеноза аортального клапана, основываясь на площади отверстия клапана. По сравнению с ранее предложенными классификациями, граничные значения площади открытия «смещены» вверх, так что о тяжелом стенозе аортального клапана говорят лишь в том случае, если площадь его отверстия меньше 1,0 см 2 (высокая степень стеноза). Умеренный стеноз соответствует площади отверстия клапана 1,0-1,5 см 2 , а при легком стенозе площадь отверстия больше 1,5 см 2 .
2. Другие параметры. Наряду с эхокардиографическим определением площади отверстия аортального клапана для оценки степени стеноза предложено определять и целый ряд других эхокардиографических параметров. Приведенные в таблице ниже граничные значения для тяжелого стеноза (стеноза высокой степени) можно использовать лишь как ориентировочные и в комплексе с другими параметрами, которые мы обсудим в следующем разделе.
а) Сепарация створок аортального клапана. С помощью ЭхоКГ в М-режиме и двумерной ЭхоКГ можно выяснить, как происходит сепарация полулунных заслонок аортального клапана. Уже в самом начале внедрения этих методов их стали использовать для количественной оценки аортального стеноза. Если при открытии аортального клапана движение одной заслонки не ограничено, значительный аортальный стеноз можно исключить. Допуская, что конфигурация аортального клапана при открытии круглая, можно по сепарации заслонок рассчитать площадь отверстия аортального клапана:
— Сепарация 12 мм => ПОАК 1,13 см 2 ,
— Сепарация 11 мм => ПОАК 0,95 см 2 ,
— Сепарация 10 мм => ПОАК 0,8 см 2 ,
— Сепарация 9 мм => ПОАК 0,65 см 2 ,
— Сепарация 8 мм => ПОАК 0,5 см 2 .
Если конфигурация аортального клапана при открытии утрачивает круглую форму, то при определении площади отверстия аортального клапана она в зависимости от направления ультразвукового луча получается завышенной или заниженной. Наконец, при сильном обызвествлении клапана можно получить заниженные значения сепарации и тем самым завышенную степень стеноза. Тем не менее несмотря на го, что с помощью ЭхоКГ в М-режиме и двумерной ЭхоКГ можно достоверно определить сепарацию заслонок аортального клапана и на основании этого параметра исключить аортальный стеноз, основываться на одном лишь этом параметре при определении степени стеноза аортального клапана не следует.

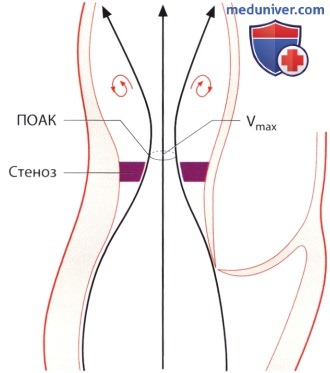
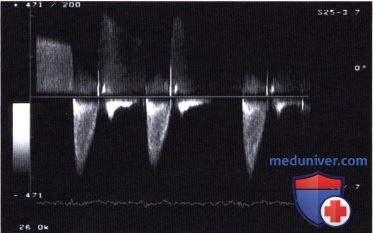
б) Максимальная скорость кровотока. При аортальном стенозе ток крови через стенозированный клапан ускоряется и струя сужается. Будучи вначале ламинарной, она на расстоянии нескольких миллиметров от стенозированного отверстия максимально сужается («сжатая вена»). Именно на этом уровне она достигает максимальной скорости, далее из-за появления нарастающей турбуленции струя постепенно расширяется.
Максимальная скорость струи является простым параметром для оценки степени аортального стеноза. В статье Otto и соавт. показано прогностическое значение данного параметра у больных с аортальным стенозом.
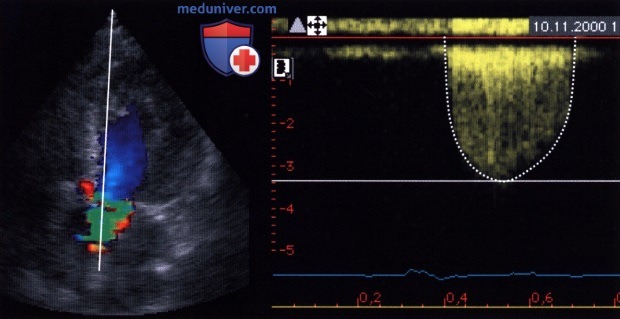
1. Расположение датчика. Для правильного определения максимальной скорости кровотока ультразвуковой луч следует направить коаксиально струе крови. Поскольку направление ультразвукового луча зависит от морфологических особенностей клапана и изменений в нем, а также положения плоскости аортального клапана, которое неодинаково у разных пациентов, при определении максимальной скорости кровотока следует подбирать оптимальную позицию ультразвукового датчика. Наиболее часто аортальный клапан лоцируют со стороны верхушки сердца, в других случаях прибегают к лоцированию из левой парастернальной, правой парастернальной, супрастернальной и, редко, субкостальной позиции датчика.
2. Настройка эхокардиографа. Поскольку при аортальном стенозе скорость стенотической струи крови высокая, необходимо допплеровское исследование в непрерывноволновом режиме. В некоторых случаях облегчить поиск аортальной струи крови можно с помощью цветового допплеровского картирования. Определенную роль играет пальпация грудной стенки, так как ощущение дрожания, характерного для аортального стеноза, помогает подобрать нужную позицию датчика, т.е. в том месте, где дрожание ощущается особенно отчетливо. В отдельных случаях имеет смысл применять допплеровские датчики с автономной системой («слепые», или карандашного типа), у которых по сравнению с датчиками для исследования в М- и В-режимах и обычными допплеровскими датчиками отношение сигнал/шум более высокое.
Современные ультразвуковые аппараты последнего поколения позволяют определить максимальную скорость кровотока примерно у 90% больных. Лишь при регистрации профиля скоростей с отчетливой огибающей можно достичь адекватной регистрации струи кровотока. Это является необходимым условием для определения скорости кровотока.
3. Эхоконтрастные растворы. Если качество сигнала плохое из-за его ослабления (например, у пациентов с ожирением или эмфиземой легких) или отклонения допплеровского курсора от центрального положения (например, при деформации грудной клетки), то можно усилить сигнал, вводя больному эхоконтрастный раствор, который проходит через легочное капиллярное русло. Введение эхоконтрастного раствора Левовист, Оптизон, Соновью или Альбунекс позволяет увеличить отношение сигнал/шум, сделать допплеровский профиль скоростей более отчетливым, не вызывая рассеяния сигнала, и, следовательно, избежать получения завышенного значения. В сравнительных исследованиях удалось показать, что точность измерения градиента давления при введении эхоконтрастного раствора повышается. Следует подчеркнуть, что введение контрастного вещества оправданно тогда, когда качество сигнала из-за плохих условий лоцирования, например у больных с эмфиземой легких или ожирением, недостаточно для отграничения максимальной скорости кровотока от артефактов. Компенсировать низкое качество акустического сигнала, связанное с неоптимальным углом между ультразвуковым лучом и направлением струи крови, путем введения эхоконтрастного вещества невозможно!
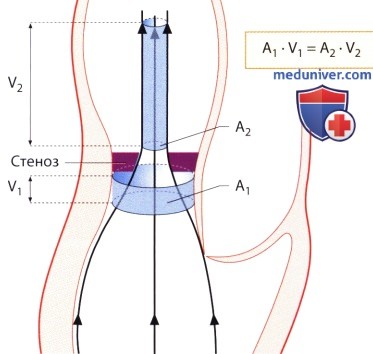
в) Максимальный и средний градиент давления. Зная скорость кровотока до стенозированного аортального клапана (V1) и максимальную скорость стенотической струи крови (V2), можно по уравнению Бернулли определить градиент давления на аортальном клапане:
Если скорость кровотока до места стеноза низкая (V1 2 2 ), уравнение Бернулли можно в упрощенном виде записать так:
По максимальному значению скорости кровотока, которое достигается во время систолы, рассчитывают максимальное мгновенное значение градиента давления на клапане.
Среднее значение градиента давления (ΔP m ) определяют по соответствующему градиенту давления для каждого значения скорости в каждый момент систолы на основании приведенной выше формулы:
При ручном или автоматическом контурировании спектральной кривой скорости кровотока указанные расчеты в имеющихся на сегодняшний день аппаратах осуществляются автоматически.
Определение максимального и среднего градиента давления по упрощенному уравнению Бернулли в настоящее время является общепризнанным методом. В ряде сравнительных исследований (как клинических, так и экспериментальных) выявлена корреляция между значениями градиента давления, рассчитанного по уравнению Бернулли на основании результатов допплеровской оценки скорости кровотока, и значениями, полученными при измерении датчиками давления, вводимыми при зондировании полостей сердца.
Градиент давления, рассчитанный по значениям допплеровской скорости кровотока, не несет существенной дополнительной информации по сравнению со значениями самой скорости кровотока (исключение составляют случаи, при которых престенотическая скорость V1 высокая и должна учитываться в уравнении Бернулли). Тем не менее этот градиент сравним с градиентом, измеренным инвазивно при катетеризации полостей сердца, что облегчает врачу интерпретацию полученных при измерениях значений.
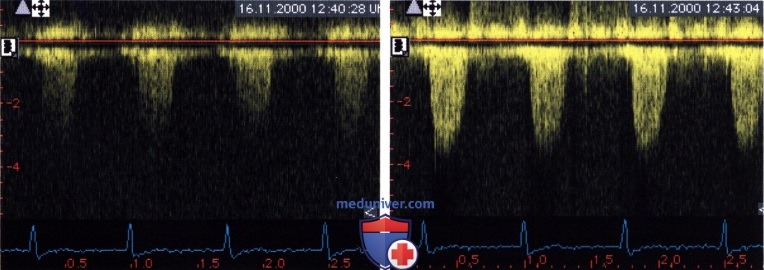
г) Причины расхождения «допплеровских» градиентов давления и градиентов давления, измеренных при зондировании сердца. В отдельных случаях значения градиентов давления на аортальном клапане, определенных с помощью допплеровского исследования и при катетеризации полостей сердца, все же существенно расходятся. Высказано несколько точек зрения на несоответствие этих результатов. Регистрация не всего профиля спектральной кривой скоростей и неоптимальный угол между ультразвуковым лучом и направлением стенотической струи крови — причины получения заниженного значения градиента давления. Ошибочное лоцирование струи митральной регургитации вместо стенотической струи через аортальный клапан дает завышенные значения допплеровского градиента давления. Методические различия в измерении межпикового градиента и мгновенного пикового градиента могут быть причиной получения завышенных значений градиента давления. При выборе нерепрезентативного сердечного сокращения значение градиента давления при допплеровском его определении может оказаться как завышенным, так и заниженным. Наконец, объяснить завышенные значения «допплеровского» градиента можно феноменом восстановления давления.
1. Нерегистрируемая максимальная скорость струи. Иногда при регистрации потока крови через стенозированный аортальный клапан исследователь не учитывает скорость узкой высокочастотной струи кровотока, что, как правило, является следствием неоптимальных условий регистрации ЭхоКГ или недостаточного опыта врача-сонолога. Так, престенотическую скорость струи крови можно ошибочно принять за постстенотическую, в результате расчетный градиент давления оказывается значительно заниженным. Ошибку можно исключить тогда, когда в «профиле струи» содержится еще второй низкочастотный профиль, который соответствует престенотической скорости V1.
2. Угловая погрешность. Позиция допплеровского датчика, обусловливающая неортогональное направление ультразвукового луча относительно направления струи, вызывает заниженные значения скорости кровотока и тем самым градиента давления. Погрешность, обусловленная углом а, сохраняется и в том случае, когда в расчетах используется косинус этого угла. Значение скорости при угле а 20° оказывается заниженным на 6%, при угле α 40° — на 24%, а при угле а 60° — на 50%. Хотя угол между ультразвуковым лучом и направлением струи учитывается во всех современных ультразвуковых аппаратах и вносится необходимая поправка, тем не менее ошибка возможна и при поправке на этот угол, и значения скорости могут оказаться как заниженными, так и завышенными. Поэтому рекомендуется полностью отказаться от поправки на угол и стараться позиционировать датчик таким образом, чтобы направление ультразвукового луча совпадало с направлением струи крови, т.е. чтобы значение скорости было максимальным и аудиосигнал регистрировался по возможности без отклонения от направления струи.
3. Пренебрежение подклапанной скоростью кровотока. Как было сказано ранее, при расчете градиента давления по упрощенному уравнению Бернулли (ΔP = 4V2 2 ) престенотической скоростью кровотока V1 пренебрегают. При высоких скоростях кровотока в выносящем тракте левого желудочка, например при наличии гемодинамически значимой аортальной недостаточности или ускорении потока вследствие подклапанной мембраны или при гипертрофической обструктивной кардиомиопатии, значение градиента на аортальном клапане получается завышенным. В этих случаях необходимо учитывать значение престенотической скорости V1, а градиент на стенозированном клапане определять по формуле ΔP = 4(V2 2 -V1 2 ).
4. Допплеровское определение «ложной» струи. Если у больного имеется эксцентрическая струя митральной недостаточности, то при допплеровском исследовании можно ошибочно принять эту струю за струю, проходящую через стенозированный аортальный клапан. Значения скорости потока крови при этом, как правило, оказываются существенно завышенными. Об этом следует помнить, если при регистрации кровотока через аортальный клапан скорость кровотока оказывается неожиданно высокой. Ошибку можно выявить, переключив режим работы ультразвукового сканера, в частности выполняя двумерную ЭхоКГ или цветовое допплеровское картирование. Дифференциальная диагностика возможна и по динамике профиля струи, характерной для аортального стеноза и митральной недостаточности: струя митральной регургитации возникает раньше и длится дольше, чем стенотический поток крови при аортальном стенозе.
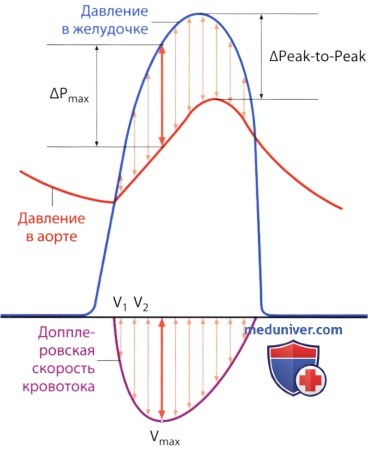
5. Различия между межпиковым (Peak-to-Peak) и мгновенным пиковым градиентом давления. Методологические различия между определением межпикового и максимального мгновенного пикового градиента давления могут стать причиной завышенных значений градиента. Следует учесть, что максимальное значение допплеровской кривой, так называемый максимальный допплеровский градиент давления, вполне соответствует мгновенному максимальному градиенту, определенному при катетеризации полостей сердца и аорты. Тем не менее при катетеризации обычно измеряют разницу между пиками кривой давления в аорте и в левом желудочке, т.е. так называемый «межпиковый градиент давления» (Peak-to-Peak) с помощью имеющихся на зонде датчиков давления.
Поскольку максимальные (пиковые) значения давления в левом желудочке и в аорте достигаются не одновременно, то о межпиковом градиенте давления говорят лишь условно; определить его с помощью допплерографии невозможно. Мгновенный пиковый градиент давления, как правило, больше межпикового. Поданным одного исследования, он превышал межпиковый градиент в среднем на 20 мм рт.ст.
6. Выбор нерепрезентативного сердечного сокращения. При выраженной вариабельности интервала R—R, например при фибрилляции предсердий или при экстрасистолии, максимальное значение скорости кровотока при различных сердечных циклах может существенно различаться. Если для определения градиента давления выбрать постэкстрасистолическое сердечное сокращение или сокращение, которое происходит после длительного R-R интервала (при мерцательной аритмии), то значение градиента давления может оказаться завышенным.
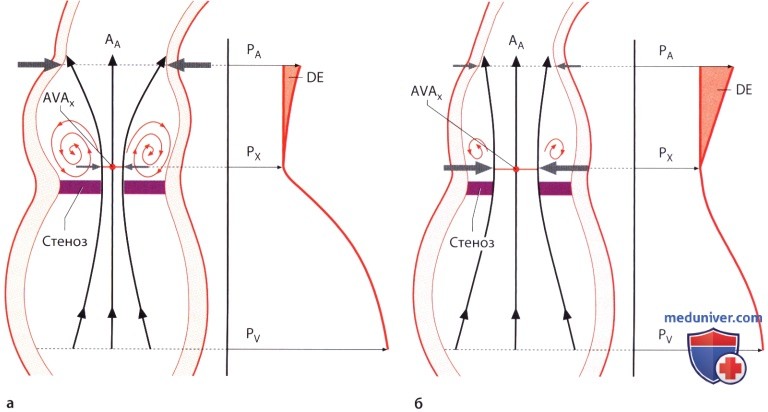
а — При выраженном стенозе (AVAX) и одновременном расширении аорты (AA) возникает значительная турбулентность и поэтому восстановление давления (DE) оказывается небольшим.
б — При небольшом стенозе (AVAX) и одновременно неширокой аорте (AA) турбулентность потока крови не столь выражена, поэтому происходит значительное восстановление давления (DE). 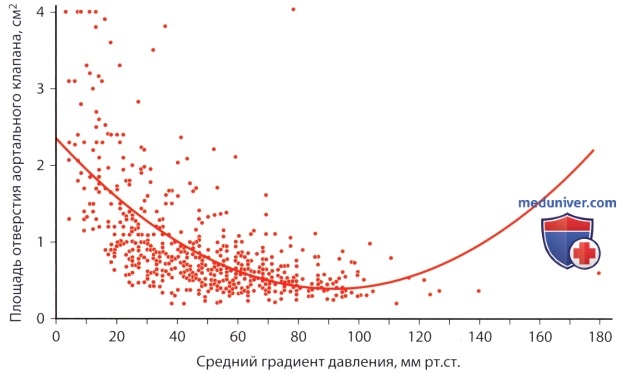
7. Феномен восстановления давления. Феномен восстановления давления (в англоязычной литературе «pressure-recovery» phenomenon) — еще одна возможная причина расхождения между значениями градиента давления, рассчитанного по результатам допплерографии и определенного при катетеризации полостей сердца. Под этим феноменом понимают повторное повышение давления за стенозированным участком. Это известный феномен в гидродинамике. При аортальном стенозе наиболее низкое давление регистрируется на уровне, соответствующем наибольшей скорости потока (т.е. на уровне «vena contracta»). Дистальнее давление частично повышается до значения, соответствующего стенозу. Иными словами, скорость потока вновь преобразуется в давление. Повторное повышение давления бывает выражено тем больше, чем меньше турбулентность потока и тем самым потери энергии дистальнее стеноза. Если аорта узкая и стеноз незначительный, турбулентность потока крови и связанные с этим потери в виде кинетической энергии незначительны. Значительная часть кинетической энергии может вновь превратиться в потенциальную энергию и тем самым трансформироваться в давление. При широкой аорте и выраженном стенозе аортального клапана турбулентность потока достигает такой степени, что восстановление давления оказывается незначительным.
8. Клиническое значение феномена восстановления давления. Клиническое значение феномена восстановления давления как причины несоответствия градиентов давления, рассчитанных с помощью допплерографии и измеренных при зондировании полостей сердца, состоит в том, что в первом случае максимальную скорость потока определяют сразу дистальнее клапана на уровне «vena contracta», где давление достигает минимума, а во втором случае, т.е. при зондировании сердца, давление измеряют дистальнее уровня его восстановления, т.е. существенно дистальнее стенозированного клапана вне стенотической струи. Таким образом, в отличие от допплерографии, при зондировании полостей сердца указывается градиент давления между желудочком и аортой, в котором уже учтено повторное повышение давления (т.е. феномен восстановления давления).
Клиническое значение феномена восстановления давления и необходимость учитывать его в отдельных случаях при сравнении значений градиентов давления, рассчитанных с помощью допплерографии и измеренных при зондировании полостей сердца, показаны в ряде исследований. Кроме того, оказалось, что степень восстановления давления зависит от степени аортального стеноза и диаметра аорты. В исследовании Baumgartner и соавт. у 7 из 23 больных с аортальным стенозом восстановление давления составило более чем 20 мм рт.ст. По данным этих авторов, расхождение в значении градиентов давления, рассчитанных с помощью допплерографии и измеренных при зондировании полостей сердца, превышало более 20 мм рт.ст. лишь у больных, у которых диаметр аорты был менее 3 см. У одного больного с гипоплазией аорты (диаметр аорты 1,7 см) восстановление давления достигало 75 мм рт.ст.
Восстановление давления в аорте в процентном отношении можно рассчитать по эффективной площади отверстия аортального клапана (AVAX) и площади поперечного сечения восходящей аорты АA. Согласно формуле, выведенной из законов сохранения массы и импульса, отношение восстановления давления к максимальному градиенту давления на клапане пропорционально площади стенозированного клапана AVAX и обратно пропорционально площади поперечного сечения аорты АA:
Восстановление давления / Максимальный градиент = 2 (AVAX/AA — AVAX 2 /AA 2 .
Ниже приводим два примера, поясняющих значение данного феномена:
— У больного с гемодинамически значимым аортальным стенозом (AVAX 0,5 см 2 ) и диаметром аорты 4 см (площадь поперечного сечения аорты 12,6 см 2 ) восстановление давления составляет 8%.
— При умеренном аортальном стенозе (AVAX 1,2 см 2 ) и узкой аорте (диаметр 2,5 см, площадь поперечного сечения аорты 4,9 см 2 ) восстановление давления составляет 37%.
Таким образом, феномен восстановления давления у больных с высокой степенью аортального стеноза не влияет на принятие тактических решений. Однако он может быть причиной расхождения между значениями градиента давления, рассчитанного по данным допплерографии и измеренного при катетеризации полостей сердца и аорты, что следует учитывать у больных с легким и умеренным аортальным стенозом в сочетании с узкой аортой.
д) Площадь отверстия аортального клапана. Как известно, градиент давления на стенозированном клапане зависит от потока крови через него, поэтому для определения степени стеноза клапана градиент давления подходит лишь условно. На рисунке ниже показано ограниченное значение градиента давления на клапане при определении степени стеноза клапана: у больных с аортальным стенозом зависимость между градиентом давления и площадью отверстия аортального клапана более слабая. Поэтому диагностическая ценность одного лишь определения градиента давления для распознавания гемодинамически значимого аортального стеноза ограничена. Умеренный градиент, превышающий 50 мм рт.ст., хотя и более специфичный признак (84%), но менее чувствителен (66%) в диагностике гемодинамически значимого аортального стеноза (AVAX 2 ).
Существует два различных способа эхокардиографического определения площади отверстия аортального клапана. По одному из них площадь отверстия аортального клапана рассчитывают из уравнения непрерывности потока. По второму ее определяют планиметрически на основании изображения аортального клапана, полученного с помощью трансторакальной или чреспищеводной ЭхоКГ. Расчет площади отверстия аортального клапана по формуле Горлина на основании данных допплеровского исследования нецелесообразен, так как формула Горлина получена из уравнения непрерывности потока. Это было бы неоправданным увеличением вычислений, так как полученные с помощью ЭхоКГ значения скорости надо будет сначала преобразовать в градиент давления, а затем значение градиента давления вставить в формулу Горлина.
1. Планиметрия. При ЧПЭ плоскость аортального клапана можно лоцировать вертикально вдоль короткой оси на уровне середины пищевода (при угле поворота датчика от 30 до 70°). Планиметрическое определение площади отверстия клапана осуществляют не менее трех раз, беря за основу отверстие вдоль внутреннего края клапана при максимальном его открытии. По данным некоторых авторов, между значениями площади отверстия аортального клапана, измеренной при ЭхоКГ и при зондировании сердца по формуле Горлина, имеется тесная корреляция. Определять площадь отверстия аортального клапана планиметрическим методом в настоящее время можно и при трансторакальной ЭхоКГ. Однако даже при удовлетворительных условиях выполнения этого исследования все же возможна значительная погрешность результатов. Часто не удается четко различить края отверстия аортального клапана и, следовательно, достоверно определить степень стеноза, особенно если имеются значительные морфологические изменения в клапане и выраженный его кальциноз. Завышенные значения площади отверстия аортального клапана при планиметрии можно получить в том случае, если рассматривать аортальный клапан в плоскости, соответствующей уровню не заслонок, а основания.
Чреспищеводная ЭхоКГ при планиметрическом определении площади отверстия аортального клапана, несомненно, более предпочтительна по сравнению с трансторакальной. При умеренном стенозе аортального клапана и отсутствии его кальциноза измерение площади его отверстия обычно не представляет трудностей. При кальцинозе клапана и сложном изменении его геометрии возможности ЧПЭ столь же ограничены, как и трансторакальной. Иногда отверстие открытого аортального клапана из-за артефактов «повторного эха» и очагов обызвествления видно нечетко. Кроме того, следует отметить, что обызвествленный и фиброзно-измененный стенозированный аортальный клапан бывает настолько деформирован, что применение лишь одного метода визуализации для измерений оказывается недостаточным. Какое место может занять трехмерная ЭхоКГ с ее более сильным пространственным разрешением в исследовании сложной геометрии стеноза аортального клапана, предстоит еще выяснить.
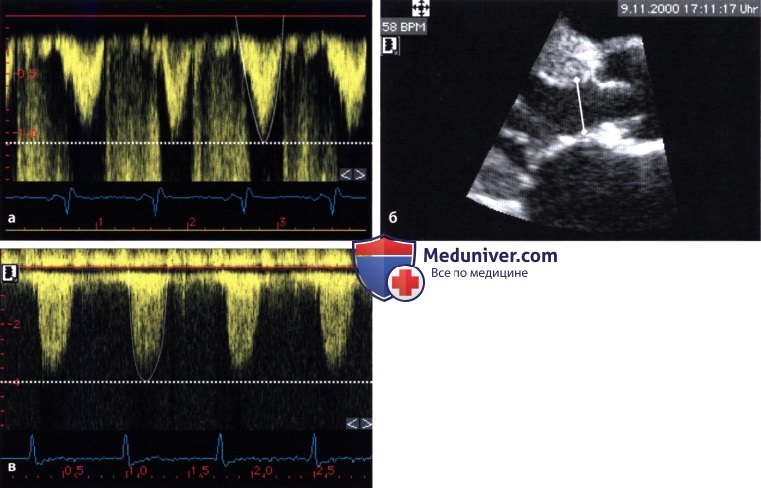
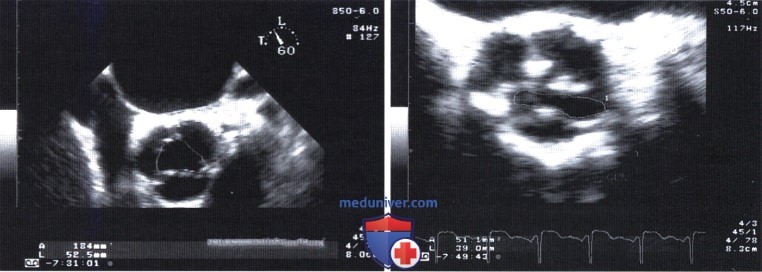
а — Допплерография в импульсном режиме: кровоток в выносящем тракте левого желудочка: V1 =110 см/с.
б — Двумерная ЭхоКГ: диаметр выносящего тракта левого желудочка: D = 2,4 см. в — Непрерывноволновая допплерография стенотической струи: скорость V2 = 400 см/с. 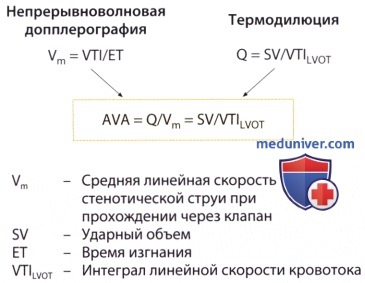
2. Уравнение непрерывности потока. Согласно уравнению непрерывности потока, выведенному из закона сохранения масс, объемная скорость тока жидкости Q в замкнутой системе трубок постоянна при любом поперечном сечении трубки. В применении к аортальному стенозу это означает, что престенотическая объемная скорость кровотока и объемная скорость ее через стенозированный участок равны, причем она равна произведению площади поперечного сечения (А) на линейную скорость кровотока (V).
3. Эффективная площадь отверстия аортального клапана. При количественной оценке аортального стеноза, когда предполагается, что аортальное отверстие круглое, диаметр выносящего тракта левого желудочка (D) равен A1 = π(D/2) 2 . Чтобы полнее использовать разрешающую способность ультразвука и точно определить место измерения клапана, исследование выполняют вдоль длинной оси сердца из парастернальной позиции датчика. Диаметр выносящего тракта левого желудочка определяют в середине систолы непосредственно проксимальнее плоскости кольца аортального клапана между межжелудочковой перегородкой и передней створкой митрального клапана; используют среднее значение 3-5 измерений. Скорость кровотока в выносящем тракте левого желудочка (V1) определяют с помощью допплеровского исследования в импульсном режиме в плоскости «пяти камер» или вдоль длинной оси сердца из апикальной позиции датчика. Соответственно позиции датчика скорость измеряют ниже плоскости аортального клапана на 0,5 см проксимальнее престенотической зоны ускорения кровотока. Наконец, измеряют еще скорость струи крови V2 c помощью непрерывноволновой допплерографии под контролем аудиосигналов. Тогда эффективную площадь отверстия аортального клапана (AVA = А2) можно определить по формуле:
Подставляя в эту формулу значения максимальной или средней скорости кровотока, можно получить значение максимальной или средней площади отверстия аортального клапана. Точность метода была проверена в ряде экспериментальных и клинических исследований. При проведении исследования опытным специалистом воспроизводимость результата определения площади отверстия аортального клапана составляет 5-8%, так что если результат при втором измерении отличается от первого результата более чем на 0,15 см 2 , например при обследовании больного в отдаленном периоде или после добутаминовой нагрузочной пробы, то разницу можно считать клинически значимой.
Наибольшие трудности при расчете площади отверстия аортального клапана с помощью уравнения непрерывности потока отмечаются при определении диаметра выносящего тракта левого желудочка, особенно при неудовлетворительных условиях проведения УЗИ. Поскольку в формуле для определения площади отверстия клапана фигурирует квадрат диаметра, то при завышении его значения на 2 мм (например, при подстановке в формулу 22 мм вместо 20 мм) значение площади получается завышенным на 21% (например, она оказывается равной 1,0 см 2 вместо 0,8 см 2 ). Есть и другая трудность: допущение о том, что сечение выносящего тракта левого желудочка является круглым, а профиль потока крови уплощенным, часто не выполняется. Поэтому в некоторых случаях, в частности у больных с неудовлетворительными условиями для УЗИ из парастернальной позиции датчика, следует воздержаться от эхокардиографического определения площади выносящего тракта левого желудочка и воспользоваться данными определения ударного объема крови методом термодилюции при зондировании правых отделов сердца.
При определении площади отверстия аортального клапана в таком случае уже используют значение ударного объема, полученное при катетеризации полостей сердца, и значение интеграла линейной скорости кровотока по времени. Такой «гибридный» способ определения площади отверстия клапана на сегодняшний день является наиболее точным и особенно целесообразен в тех случаях, когда больному и без того планируется выполнить катетеризацию правых отделов сердца.
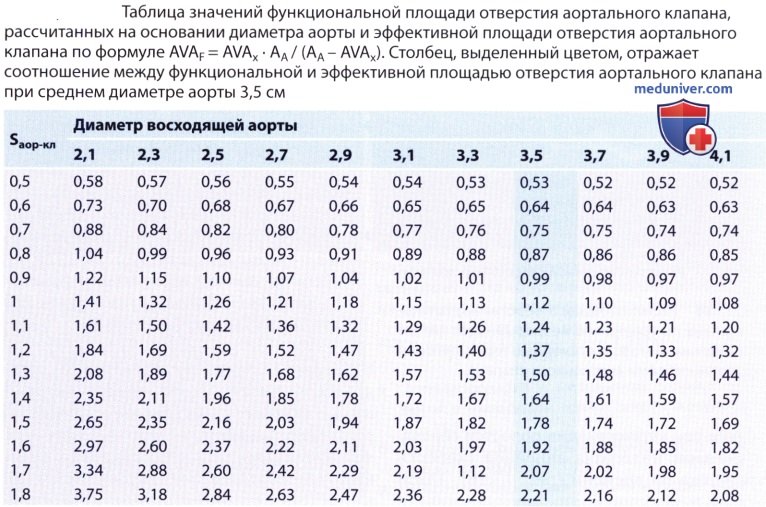
4. Функциональная площадь отверстия аортального клапана. В то время как при расчете эффективной площади отверстия аортального клапана (AVAX) из уравнения непрерывности потока описываются престенотические и стенотические динамические соотношения, для оценки функциональной значимости стеноза в целом необходимо принимать во внимание также возникновение постстенотической турбуленции потока и феномен восстановления давления. Для этого рассчитывают функциональную площадь отверстия аортального клапана (так называемый коэффициент потери энергии), т.е. дополнительно учитывают также диаметр принимающей камеры, а именно восходящей аорты (AA). Функциональную площадь отверстия аортального клапана (AVAF), которую выводят из закона сохранения импульса и массы, рассчитывают следующим образом:
Это означает, например, что:
— при AVAX, равной 1,0 см 2 , и диаметре аорты, равном 2,5 см (что соответствует площади поперечного сечения ее AA 5 см 2 ), функциональная площадь отверстия аортального клапана составляет 1,25 см 2 и
— при AVAX, равной 0,5 см 2 , и диаметре аорты 3,6 см (что соответствует площади поперечного сечения ее AA 10 см 2 ) функциональная площадь отверстия аортального клапана составляет 0,53 см 2 .
В таблице ниже отражена зависимость между эффективной и функциональной площадью отверстия аортального клапана при различных диаметрах аорты. Среднее значение диаметра аорты выведено на основании результатов клинических исследований трех авторов, проведенных в общей сложности на 175 больных: Schobel и соавт.: 3,7±0,8 см; Baumgartner и соавт.: 3,1±0,6 см; Treat и соавт.: 3,55±0,4 см.
Зная наряду с эффективной площадью отверстия аортального клапана также диаметр аорты, можно определить энергию, теряемую при прохождении струи крови через стенозированный аортальный клапан, и нагрузку на левый желудочек. Эти параметры лучше объясняют появление клинических симптомов, чем эффективная площадь отверстия аортального клапана. Так, прогрессирующее расширение аорты даже при отсутствии изменений в аортальном клапане и постоянной анатомической, или эффективной, площади отверстия аортального клапана приводит к уменьшению функциональной площади отверстия аортального клапана. Еще одним преимуществом определения функциональной площади отверстия аортального клапана является то, что этот показатель сопоставим с площадью отверстия аортального клапана, определенной по формуле Горлина, в которой также учитываются условия кровотока и гемодинамика дистальнее стеноза.
е) Дополнительные допплеровские параметры:
1. Сопротивление аортального клапана («valvular resistance»). Сопротивление аортального клапана представляет собой отношение максимального градиента давления к объемной скорости потока через клапан и основывается, в отличие от уравнения Бернулли и выведенной из него формулы Горлина, на допущении о линейной зависимости между градиентом и объемной скоростью потока. Сопротивление клапанов сердца R можно определить с помощью допплерографии, используя в случае аортального клапана формулу:
где LVOT — выносящий тракт левого желудочка (left ventricular outflow tract).
Оказалось, что этот параметр лучше описывает гемодинамику при аортальном стенозе, чем площадь отверстия аортального клапана. Однако в ряде работ было показано, что сопротивление аортального клапана не является параметром, не зависящим от потока крови, и поэтому не имеет каких-либо преимуществ перед традиционными параметрами, которые количественно характеризуют аортальный стеноз (площадь отверстия аортального клапана, градиент давления на клапане, скорость потока).
2. Дополнительная систолическая работа. Дополнительная систолическая работа (SWL от англ, stroke work loss) представляет собой параметр, предложенный для количественной характеристики аортального стеноза. Рассчитывают SWL по представленной ниже формуле, в которой не фигурируют характеристики потока крови:
где PLVSP — систолическое давление в левом желудочке.
Дополнительная систолическая работа, превышающая 25%, указывает на гемодинамически значимый аортальный стеноз и неблагоприятный прогноз. При расчете этого параметра особенности потока крови не учитываются, и в этом смысле SWL, конечно, уступает традиционному определению площади отверстия аортального клапана.
3. Отношение скоростей. Отношение скорости движения крови в выносящем тракте левого желудочка к скорости движения стенотической струи V1/V2 представляет собой упрощение уравнения непрерывности потока. Его определяют в дополнение к измерению площади отверстия аортального клапана, особенно при неудовлетворительных условиях лоцирования аорты из парастернальной позиции датчика. Значение V1/V2 меньше 0,25 указывает на гемодинамически значимый аортальный стеноз. Определение этого параметра особенно оправданно при наблюдении за больным в динамике, так как, полагая, что диаметр клапанного кольца остается постоянным, можно по соотношению скорости кровотока в выносящем тракте левого желудочка и через стенозированный клапан оценить изменение степени стеноза и гемодинамики.
4. Отношение фракции укорочения размера левого желудочка, или фракции выброса, к скорости кровотока. Для количественной оценки степени аортального стеноза предложено использовать отношение фракции укорочения (FS — Fractional Shortening) размера левого желудочка к максимальному градиенту давления, рассчитанному по упрощенному уравнению Бернулли ΔP=4V 2 . Это отношение как параметр отражает наряду со скоростью кровотока через стенозированный клапан также функцию левого желудочка, о которой судят по фракции укорочения размера левого желудочка, определяемой с помощью ЭхоКГ в М-режиме. Мнения о диагностической ценности этого параметра противоречивы.
В то время как Karpuz и соавт. для граничного значения этого параметра 0,8 показали довольно высокую чувствительность (97%) и специфичность (78%) в распознавании аортального стеноза (AVA≤0,53 см 2 /м 2 ) Otto и соавт., исследовавшие 382 больных с аортальным стенозом, выявили лишь весьма слабую корреляцию с результатами определения площади отверстия аортального клапана, рассчитанной по формуле Горлина. Фракция укорочения FS, как известно, при локальном нарушении сократительной функции миокарда желудочка бывает снижена, и, кроме того, нет тесной корреляции между фракцией укорочения FS, или глобальной сократительной функцией левого желудочка, и минутным объемом сердца, т.е. потоком крови через аортальный клапан. Этим можно объяснить слабую корреляцию с площадью отверстия аортального клапана, определенной по формуле Горлина при зондировании полостей сердца.
Учитывая перечисленные ограничения, Antonini-Canterin и соавт. предложили пользоваться модифицированным параметром, который представляет собой отношение фракции выброса левого желудочка, определенной при двумерной ЭхоКГ, к максимальной скорости кровотока. Этот параметр отражает тесную корреляцию с площадью отверстия аортального клапана, определенной при инвазивном исследовании. Однако у больных с аортальным стенозом, у которых имеется также митральная или аортальная недостаточность либо гипертрофия левого желудочка и связанное с ней уменьшение его размеров, предсказательная ценность этого параметра ограничена, так как хотя фракция выброса левого желудочка в этих случаях может быть в пределах нормы, ударный объем его снижен.
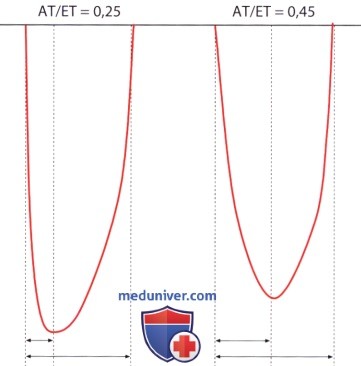
5. Отношение времени нарастания давления к периоду изгнания. Отношение времени нарастания давления в левом желудочке (АТ) к периоду изгнания (ЕТ)-АТ/ЕТ представляет собой параметр, который учитывает давно известный в клинике феномен, состоящий в том, что давление в левом желудочке при гемодинамически значимом аортальном стенозе, медленно повышаясь, достигает своего максимума лишь во второй половине систолы. При ЭхоКГ значение АТ/ЕТ, равное 0,3, является граничным; более высокие значения указывают на гемодинамически значимый аортальный стеноз. Поскольку как время нарастания давления в левом желудочке АТ, так и период изгнания зависят от функции желудочка, диагностическая ценность параметра АТ/ЕТ в отношении аортального стеноза ограничена.
ж) Значение допплер-эхокардиографии. Обобщая материал, изложенный выше, следует отметить, что ни один из названных дополнительных допплеровских параметров, предложенных для количественной оценки аортального стеноза, не имеет особого значения и по своей предсказательной ценности не превосходит традиционно определяемые параметры, в частности максимальную скорость, градиент давления и площадь отверстия аортального клапана. В некоторых случаях более предпочтительным может оказаться использование в расчетах отношения скоростей V1/V2.
1. Функциональная площадь отверстия аортального клапана. Для полной оценки изменений гемодинамики при аортальном стенозе следует определить функциональную площадь отверстия аортального клапана [так называемый коэффициент потери энергии]. Однако для этого необходимо определить весь комплекс параметров — площадь поперечного сечения выносящего тракта левого желудочка и скорость кровотока в нем, максимальную скорость стенотической струи и диаметр нисходящей аорты.
2. Эффективная площадь отверстия аортального клапана. Если диаметр восходящей аорты точно измерить из лево- или правосторонней парастернальной позиции датчика бывает невозможно, то следует рассчитать эффективную площадь отверстия аортального клапана с помощью уравнения непрерывности потока.
3. Отношение скоростей V1/V2. Если условия сканирования из парастернальной позиции оказываются неудовлетворительными и в связи с этим невозможно точно измерить размер аортального клапанного кольца, при расчетах ограничиваются отношением скорости движения крови в выносящем тракте левого желудочка к скорости движения стенотической струи V1/V2.
4. Скорость стенотической струи (V2) и градиент давления. Если невозможно точно измерить скорость кровотока в выносящем тракте левого желудочка, ограничиваются лишь определением скорости стенотической струи V2 и на ее основании рассчитывают градиент давления.
5. Качественная оценка. Если при допплерографии не удается отчетливо лоцировать стенотическую струю, независимо от того, вводится эхоконтрастный раствор или нет, то следует ограничиться лишь описанием особенностей аортального клапана (обызвествление, сепарация заслонок), левого желудочка (гипертрофия), а также результатов планиметрического определения площади отверстия аортального клапана по данным ЧПЭ.
Видео ЭхоКГ аортального клапана — оценка, протокол исследования
Редактор: Искандер Милевски. Дата обновления публикации: 29.1.2021
«Применим ли закон Бернулли для движения крови по кровеносным сосудам?»
Работа Антроповой Д.А. помогает найти ответ на проблемный вопрос, возникший при попытке применить законы физики к физиологии человека.
Идея работы: объяснить с помощью законов физики движение крови по кровеносным сосудам. Экспериментально доказать, что давление и скорость движения крови в сосудах зависят от площади сечения. Создать модель, которая поможет продемонстрировать эту зависимость. Проверить и объяснить на эксперименте, применим ли закон Бернулли для движения крови по кровеносным сосудам.
Скачать:
| Вложение | Размер |
|---|---|
| «Применим ли закон Бернулли для движения крови по кровеносным сосудам?» | 904.34 КБ |
Предварительный просмотр:
Частное общеобразовательное учреждение «Школа-интернат №22 ОАО «РЖД»
«Применим ли закон Бернулли для движения крови по кровеносным сосудам?»
Автор: Антропова Дарья Андреевна,
10 класс, Школа интернат № 22 ОАО «РЖД»
Научные руководители: Хамаганова Татьяна Фёдоровна,
учитель химии и биологии высшей квалификационной категории,
Школа-интернат №22 ОАО «РЖД»
Максимова Александра Андреевна,
учитель физики 1 квалификационной категории,
Школа-интернат №22 ОАО «РЖД»
Виды кровеносных сосудов, их основные характеристики……….………………..
Физико-биологическое моделирование движения крови по сосудам и возможность применения к ней закона Бернулли.………….………………………..
Анализ полученных данных в результате исследовательской работы ……….……
Список использованных источников………………………………………………………
С точки зрения биологии, движение крови по кровеносным сосудом, это процесс довольно сложный и характеризуется множеством параметров, такими как скорость течения, диаметр сосуда, вязкость крови и т.д. Но возможно ли применить физические законы к этому процессу. Возникнут ли противоречия при попытке применить законы физики к физиологии человека.
Так, в гемодинамике [1] , движение крови по сосудам объясняется такими физическими величинами как давление и скорость движения крови. В гидродинамике данные величины связаны законом Бернулли. Но применим данный закон к движению крови.
Цель эксперимента : выявить зависимость внутреннего давления и скорости движения жидкости от площади поперечного сечения кровеносных сосудов.
Гипотеза: закон Бернулли применим для движения крови по кровеносным сосудам.
Идея проекта: объяснить с помощью законов физики движение крови по кровеносным сосудам. Экспериментально доказать, что давление и скорость движения крови в сосудах зависят от площади сечения. Создать модель, которая поможет продемонстрировать эту зависимость. Проверить и объяснить на эксперименте, применим ли закон Бернулли для движения крови по кровеносным сосудам.
Объект исследования: движение крови по кровеносным сосудам.
Предмет исследования: давление и скорость течения крови.
- изучить литературу по данной теме;
- рассмотреть закономерности в уравнение Бернулли и гемодинамике;
- создать физико-биологическую модель кровеносных сосудов;
- сравнить и проанализировать полученные данные.
Метода исследования : практический эксперимент, посредством моделирования, мыслительно-логические методы, такие как постановка проблемы, сравнение и анализ.
1. Виды кровеносных сосудов, их основные характеристики
Кровообращение — циркуляция крови по организму. Начиная с представителей класса рыб, кровь приводится в движение сокращениями сердца и циркулирует по сосудам. Кровь снабжает ткани организма кислородом, питательными веществами, гормонами и доставляет продукты обмена веществ к органам их выделения. Обогащение крови кислородом происходит в лёгких, а насыщение питательными веществами — в органах пищеварения. Кровообращение регулируется гормонами и вегетативной нервной системой. Различают малый (через лёгкие) и большой (через органы и ткани) круги кровообращения.
Кровообращение — важный фактор в жизнедеятельности организма человека и ряда животных. Кровь может выполнять свои разнообразные функции только находясь в постоянном движении.
Кровеносная система человека и многих животных состоит из сердца и сосудов, по которым кровь движется к тканям и органам, а затем возвращается в сердце. Крупные сосуды, по которым кровь движется к органам и тканям, называются артериями. Артерии разветвляются на более мелкие артерии, артериолы, и, наконец, на капилляры. По сосудам, называемым венами, кровь возвращается в сердце. Сердце четырёхкамерное и имеет два круга кровообращения.
Рис.1 Круги кровообращения
Самые первые количественные измерения механических явлений в кровообращении были сделаны Стивеном Хейлзом (1677—1761 г.), который измерил артериальное и венозное кровяное давление, объём отдельных камер сердца и скорость вытекания крови из нескольких вен и артерий, продемонстрировав таким образом, что большая часть сопротивления течению крови приходится на область микроциркуляции.[1] Он полагал, что вследствие упругости артерий течение крови в венах более или менее установившееся, а не пульсирующее, как в артериях.
Кровообращение человека происходит по трём группам сосудов: артерии, капилляры и вены. Рассмотрим их основные отличительные характеристики.
Основные характеристики сосудов человека:
Артерии, которые почти не содержат гладких мышц, но имеют мощную эластическую оболочку, выполняют главным образом «буферную» роль, сглаживая перепады давлений между систолой и диастолой. Именно растяжение стенки сосуда воспринимается как удар пульса. Артериолы обладают развитой гладкой мускулатурой, благодаря которой способны активно менять свой просвет и, таким образом, регулировать сопротивление кровотоку.
Марчелло Мальпиги, который в 1661 г. открыл капилляры — звено кровеносных сосудов, которое соединяет артерии и вены, — и таким образом завершил описание замкнутой сосудистой системы.[2]
Капилляры характеризуются тем, что их сосудистая стенка представлена одним слоем клеток, так что они высоко проницаемы для всех растворенных в плазме крови низкомолекулярных веществ. Здесь происходит обмен веществ между тканевой жидкостью и плазмой крови.
От органов кровь возвращается через посткапилляры в венулы и вены в правое предсердие по верхней и нижней полым венам, а также по коронарным венам. Гладкие мышцы вен обеспечивают изменение их объёма в весьма широких пределах, приспосабливая их ёмкость к меняющемуся объёму циркулирующей крови. поэтому физиологическая роль вен определяется как «ёмкостные сосуды».
Движение крови по сосудам осуществляется, главным образом, благодаря разности давлений между артериальной системой и венозной. Это утверждение полностью справедливо для артерий и артериол, в капиллярах и венах появляются вспомогательные механизмы. Разность давлений создаётся ритмической работой сердца, перекачивающего кровь из вен в артерии. [3]
2. Закон Бернулли
Закон Бернулли [4] (также уравнение Бернулли, теорема Бернуллиили интеграл Бернулли) устанавливает зависимость между скоростью стационарного потока жидкости и её давлением.
При переходе жидкости с участка трубки с большим сечением на участок с меньшим сечением, скорость течение возрастает. Т.е. жидкость движется с ускорением. Следовательно, на жидкость действует сила. В горизонтальной трубе эта сила может возникнуть только из-за разности давлений в широком и узком участках трубы. Давление в широком участке трубы должно быть больше чем в узком участке.
Математический вид закона Бернулли выглядит следующим образом:
ρ— плотность жидкости;
υ— скорость потока;
g — ускорение свободного падения [5].
Согласно этому закону, если вдоль линии тока давление жидкости возрастает, то скорость течения убывает, и наоборот.
3. Физико-биологическое моделирование движения крови по сосудам и возможность применения к ней закона Бернулли
Для того, чтобы наглядно продемонстрировать движение крови, я создала модель, состоящую из трубок разного диаметра, где трубка с наименьшим поперечным сечением будет демонстрировать движение крови в капиллярах. А трубка с наибольшим поперечным сечением – движение в аорте. Трубка среднего диаметра – движение в артериях. И к каждой трубке подсоединён жидкостный манометр. Подключаем нашу установку к водопроводной сети под давлением, и проверяем жидкостным манометром давление, создаваемое в трубках разного диаметра.
Для создания модели нам понадобились:
- 3 трубки различного сечения, для демонстрации движения крови в сосудах разного диаметра (аорта, артерии, капилляры);
- 3 манометра, для определения внутреннего давления жидкости в трубке;
- подводящие и отводящие жидкость шланги и переходники;
- стробоскоп, для наблюдения быстрого движения струящейся жидкости из трубки;
- пищевой краситель красного цвета, для демонстрации скорости движения жидкости в трубке.
Рис. 2 Экспериментальная модель кровеносных сосудов
В трубке с наибольшим поперечным сечением манометр показывает 240 мм рт.ст. В трубке с наименьшим поперечным сечением 217 мм рт. ст.. В трубке среднего диаметра — 210 мм. рт. ст. Убираем манометры. Снова подключаем нашу установку к водопроводной сети. И сравниваем высоту фонтанов.
Рис. 3 Разность высот «фонтанов»
Фонтан, образующийся на трубке большего диаметра самый высокий, а самый низкий на трубке меньшего диаметра. Оказалось, что вода быстрее окрашивается в трубке меньшего диаметра.
4. Анализ полученных данных в результате исследовательской работы
Т.к. вода быстрее окрашивается в трубке меньшего диаметра, следовательно, скорость движения воды в ней самая высокая, что противоречит движению крови по кровеносным сосудам. Ведь в капиллярах скорость движения крови меньше, чем артериях, хотя артерии шире. А это имеет огромный биологический смысл, ведь благодаря медленному движению крови по капиллярам в тканях осуществляется газообмен.
Разрешить проблему и разобраться в данном вопросе мне помогла формула Торричелли, не входящая в школьный курс.
— скорость кровотока в сосуде,
S — поперечное сечение кровеносного сосуда.
Данная формула показывает, что линейная скорость кровотока уменьшается по мере увеличения суммарного сечения параллельно соединённых сосудов, т.е. учитывается свойство пропускной способности сосудов . Есть закономерность: циркуляция жидкости выше в том участке, где имеется наименьшее сечение сосуда. Такой участок — аорта. Самый широкий суммарный просвет в капиллярах. Исходя из этого, максимальная скорость в аорте (500 мм/сек), минимальная – в капиллярах (0.5 мм/сек) [6].
Наша гипотеза подтвердилась: уравнение Бернулли применимо к движению крови по кровеносным сосудам. Возникшее противоречие объясняется тем, что в капиллярах скорость движения крови низкая, потому что в капиллярах нашего тела самый широкий суммарный просвет, т.е. суммарная площадь сечения, которая в 1000 раз больше сечения аорты, и приводит к минимальной скорости движения крови в капиллярах.
Проведенные исследования важны с практической точки зрения. Данная модель может быть использована на уроках физики при углублённом изучении гидродинамики, а также на уроках биологии при рассмотрении кровеносной системы человека
Список использованных источников
- Кровообращение. URL: https://ru.wikipedia.org/wiki/
- Котляров С. Н., Александрова Л. Н. История создания шприца // Научная статья в № 2 журнала «Наука молодых — Eruditio juvenium» от 2016 г. — Рязань: Рязанский государственный медицинский университет имени академика И. П. Павлова. С. 41-48. УДК: 615.473.3. ISSN 2311-3820
- Сонин Н.И. Биология: Человек. 8 кл.: учебник /Н.И. Сонин, М.Р. Сапин. – 2-е изд., стереотип. – М.: Дрофа, 2015. – 302, [2] с.
- Ландсберг Г. С. Элементарный учебник физики. Механика. Теплота. Молекулярная физика.// Закон Бернулли / под ред. Г. С. Ландсберга., — М.:Просвещение, 1985. стр. 350 URL: http://mat.net.ua/mat/biblioteka-fizika/Landzberg-fizika-t1-mehanika-teplota.pdf
- Степанова Г.Н. Физика. 10 класс: учебник для 10 класса общеобразовательных учреждений: в 2-х частях. Ч.1. Механика./Г.Н.Степанова. – М.: ООО «ТИД» Русское слово — РС», 2010.-192с.: ил., стр. 158.
- С какой скоростью движется кровь. URL: https://mirinteresen.net/1749-s-kakoy-skorostyu-dvizhetsya-krov.html
[1] Гемодинамика — раздел физиологии кровообращения, рассматривающий закономерности, причины, механизмы и проявления движения крови в сердечно-сосудистой системе.
Способ определения систолического градиента давления между правым желудочком и легочной артерией
Изобретение предназначено для использования в медицине, в частности в кардиологии. Технический результат изобретения — упрощение определения при эхокардиографии систолического градиента давления между правым желудочком и легочной артерией, удешевление стоимости обследования и используемой аппаратуры, повышение эффективности диагностики сердечной патологии. Способ заключается в следующем. При контрастной эхокардиографии в одномерном режиме фиксируют траектории систолического движения эхоконтрастных газовых микропузырьков через устье легочной артерии вдоль ультразвукового луча, установленного в соответствие с единой осью выносящего тракта правого желудочка и начального отдела легочной артерии так, что расхождение между отмеченной осью и направлением ультразвукового луча не превышает 15 o . По траекториям определяют среднее значение скорости систолического выброса микропузырьков (V м/с) на основе показателей скорости их систолического выброса, измеренных в 5 сердечных циклах с хорошим качеством визуализации систолического фрагмента траекторий. Анализ траекторий и изменение скорости микропузырьков производят в пределах промежутка времени, равного 0,43-0,7 интервала QT от начала зубца Q соответствующего комплекса QRST одновременно регистрируемой электрокардиограммы (ЭКГ), а градиент систолического давления между правым желудочком и легочной артерием (


Изобретение относится к медицине, в частности к кардиологии.
В клинической практике для точной диагностики сердечно-сосудистой и легочной патологии крайне важно определение систолического градиента давления между правым желудочком сердца и легочной артерией (

Зондирование сердца является прямым и наиболее точным способом регистрации давления в сердечных полостях и сосудах. Однако оно относится к высокоинвазивным, сравнительно опасным для жизни пациентов методикам. В связи с этим его применение ограничено [2].
Значительно чаще используется методика допплер-эхокардиографии, являющаяся абсолютно безопасной и достаточно точной, но требующей применения сложной специальной аппаратуры.
Известна методика определения 



Однако использование известной методики требует применения дорогостоящей ультразвуковой аппаратуры, имеющей допплеровский блок и достаточно широкие возможности компьютерной обработки полученных сигналов. Это ведет к заметному усложнению и существенному удорожанию процедуры обследования.
Технический результат состоит в упрощении определения 
Результат достигается тем, что разработан способ определения систолического градиента давления между правым желудочком и легочной артерией при эхокардиографическом исследовании, основанный на регистрации в одномерном режиме скорости движения эхоконтрастных микропузырьков газа через устье легочной артерии с учетом длительности интервала QT электрокардиограммы, регистрируемой синхронно с эхокардиограммой.
Способ осуществляется следующим образом.
Выполняется эхокардиографическое исследование сердца. В одномерном режиме эхокардиографии М-строб (ось ультразвукового луча) устанавливается в соответствие с направлением единой оси выносящего тракта правого желудочка и начального отдела ствола легочной артерии таким образом, чтобы угол между осью ультразвукового луча и единой осью не превышал 15 o .
Необходимая ориентация М-строба обеспечивается с помощью котроля его положения при двухмерном эхокардиографическом режиме в поперечном парастернальном сечении сердца на уровне выносящего тракта правого желудочка.
Затем при введении эхоконтрастного средства, содержащего газовые микропузырьки, регистрируют их движение в процессе сердечного цикла (фиг. 1).
На одномерной контрастной эхокардиограмме (К-ЭхоКГ) определяют среднее значение скорости систолического выброса эхо-контрастных микропузырьков через устье легочной артерии (V «контраст», м/с) на основе показателей скорости их систолического выброса, измеренных по обычной методике оценки скорости движущегося объекта в М-режиме с построением касательной линии (C-D) к исследуемому участку объекта (в данном случае — к траекториям движения микропузырьков) [1] в 5 сердечных циклах с хорошей визуализацией систолических фрагментов траекторий. Анализ траекторий и измерение систолической скорости микропузырьков производят с учетом электрокардиографического интервала QT в промежутке времени A-B, начинающимся на расстоянии 0,43 



Изменение коэффициента «4,8» (вместо «4», как в прототипе) обусловлено тем, что гидродинамика фазонеоднородной газожидкостной (в данном случае — газокровяной) суспензии, которую представляет собой смесь ультразвукового контрастного вещества с кровью, может существенно отличаться от гидродинамики относительно фазооднородной крови. Газожидкостные суспензии являются фазонеоднородной неньютоновской жидкостью, содержащие газовую и жидкую компоненты (фазы), что может приводить к существенным отличиям закономерностей скорости движения суспензии от значительно более фазооднородной крови.
Расчеты градиента давления, выполненные с использованием старой формулы в случае применения контрастной эхокардиографии в обозначенном в данном способе режиме, не совпадают с результатами прямого измерения этого градиента при зондировании сердца и вычисленным его допплер-эхокардиографическим показателем. Подобное несовпадение весьма значительно и не позволяет ориентироваться в реальном уровне обсуждаемого градиента для решения вопросов клинической практики.
Немаловажно также, что налицо принципиальное различие методов регистрации движения крови (путем допплер-эхокардиографии — в прототипе) и газокровяной суспензии (путем одномерной эхокардиографии — в данном способе). Данные обстоятельства определили необходимость смены коэффициента пересчета в вышеприведенной формуле.
Абсолютное значение поправочного коэффициента, равное «4,8», получено в результате сопоставления данных зондирования сердца и/или допплер-эхокардиографии с показателями контрастной эхокардиографии, полученными при обследовании 81 пациента.
Исследования показали, что предлагаемое значение поправочного градиента обеспечивает вычисление показателей 
Больному М., 7 лет, весом 28 кг, ростом 122 см, с жалобами на одышку при физической нагрузке, наличием систолического шума, обнаруживаемого вдоль левого края грудины, определялся систолический градиент давления между правым желудочком и легочной артерией (
С учетом ее по упрощенному уравнению Бернулли (



Далее больному было выполнено эхоконтрастирование правый полостей сердца путем введения в локтевую вену 0,2% раствора перекиси водорода на стерильном физиологическом растворе в общем количестве 3 мл со скоростью 1 мл в секунду.
В это время ось ультразвукового луча М-режима была установлена в соответствии с направлением единой оси выносящего тракта правого желудочка и начального отдела ствола легочной артерии таким образом, чтобы угол между осью ультразвукового луча и единой осью составлял 10 o .
В одномерном режиме регистрировались траектории движения газовых микропузырьков. Определялось среднее значение их систолической скорости движения (V «контраст») в устье легочной артерии, вычисленное на основе измерения показателей этой скорости в 5 сердечных циклах с хорошей визуализацией систолического фрагмента траекторий движения эхоконтрастных микропузырьков.
Показатели скорости определялись путем построения касательной C-D к наиболее качественно зарегистрированным траекториям движения микропузырьков в указанной анализируемой зоне сердца с учетом интервала QT электрокардиограммы, снимаемой одновременно с эхокардиограммой, в промежутке времени A-B, начинающимся на расстоянии 0,43 

В данном случае интервал QT составлял 0,36 с.
Промежуток времени A-B, в рамках которого осуществлялись анализ траекторий движения эхоконтрастных микропузырьков и определение их скорости, начинался с точки A, расположенной на расстоянии 0,15 с (0,43 

V «контраст» в данном промежутке времени определялась путем построения касательной C-D к наиболее качественно зарегистрированным траекториям микропузырьков и соответствовала 1,05 м/с.
Систолический градиент давления между правым желудочком и легочной артерией рассчитывался на основе V «контраста» по формуле: 


При зондировании сердца 
Различие между измеренным и расчетным градиентам давления составило: при использовании известной допплер-эхокардиографической методики — 11,8%; при применении предлагаемого способа — 3,8%.
Таким образом, при использовании данного способа степень отклонения рассчитанного показателя 
Кроме того, его применение не потребовало оснащения сложной и дорогостоящей допплеровской аппаратурой.
Больному П., 7 лет, ростом 124 см, имеющему систолический шум, выслушиваемый у левого края грудины, определялся систолический градиент давления между правым желудочком и легочной артерией (
На ее основе по упрощенному равнению Бернулли (



Далее больному трижды было выполнено эхоконтрастирование правых полостей сердца путем введения в течение 3 секунд 10 мл 0,9% стерильного раствора натрия хлорида через катетер, установленный в правой подключичной вене.
В этом время ось ультразвукового луча в М-режиме была установлена в соответствие с направлением единой оси выносящего тракта правого желудочка и начального отдела ствола легочной артерии так, что угол между осью ультразвукового луча и единой осью соответствовал 10 o .
В одномерном режиме регистрировались траектории движения газовых микропузырьков. Определялось среднее значение их систолической скорости движения (V «контраст») в устье легочной артерии, вычисленное на основе измерения показателей этой скорости в 5 сердечных циклах с хорошей визуализацией систолического фрагмента траекторий движения эхоконтрастных микропузырьков.
Показатели скорости определялись путем построения касательной C-D к наиболее качественно зарегистрированным траекториям движения микропузырьков в указанной анализируемой зоне сердца с учетом интервала QT одновременно снимаемой эхокардиограммы, в промежутке времени A-B, начинающимся на расстоянии 0,43 

В данном случае интервал QT составлял 0,31 с.
Промежуток времени A-B, в рамках которого осуществлялись анализ траекторий движения эхоконтрастных микропузырьков и определение их скорости, начинался с точки A, расположенной на расстоянии 0,13 с (0,43 

V «контраст» в данном промежутке времени определялась путем построения касательной C-D к наиболее качественно зарегистрированным траекториям микропузырьков и соответствовала 0,694 м/с.




Позднее больному было проведено зондирование сердца с измерением давления в его полостях. 
Различие между измеренным и расчетным градиентами давления составило: при использовании известной допплер-эхокардиографической методики — 16,0%, при применении данного способа — 15,0%.
Следовательно, рассчитанные показатели 
Вместе с тем, применение предлагаемого способа не потребовало сложного дорогостоящего допплеровского оборудования.
Больной К. , 14 лет, весом 48 кг, ростом 166 см, с систолическим шумом, регистрируемым вдоль левого края грудины с максимумом в 3 межреберье, определялся систолический градиент давления между правым желудочком и легочной артерией (
На ее основе по упрощенному уравнению Бернулли (



Далее больному было проведено эхоконтрастирование правых камер сердца путем капельного введения в локтевую вену 0,3% раствора перекиси водорода на стерильном физиологическом растворе со скоростью 90 капель в минуту в общем количестве 95 мл.
Под контролем секторального (двухмерного) изображения ось ультразвукового луча (М-строб одномерного режима эхокардиографии) установили в соответствие с направлением единой оси выносящего тракта правого желудочка и начального отдела ствола легочной артерии так, что угол между осью ультразвукового луча и единой осью составил 14 o .
В одномерном режиме регистрировались траектории движения газовых микропузырьков. Определялось среднее значение их систолической скорости движения (V «контраст») в устье легочной артерии, вычисленное на основе измерения показателей этой скорости в 5 сердечных циклах с хорошей визуализацией систолического фрагмента траекторий движения эхоконтрастных микропузырьков.
Показатели скорости определялись путем построения касательной C-D к наиболее качественно зарегистрированным траекториям движения микропузырьков в указанной анализируемой зоне сердца с учетом интервала QT электрокардиограммы, снимаемой одновременно с эхокардиограммой, в промежутке времени A-B, начинающимся на расстоянии 0,43 

В данном случае интервал QT составлял 0,39 с.
Промежуток времени A-B, в рамках которого осуществлялись анализ траекторий движения эхоконтрастных микропузырьков и определение их скорости, начинался с точки A, расположенной на расстоянии 0,17 с (0,43 

V «контраст» в данном промежутке времени определялась путем построения касательной C-D к наиболее качественной зарегистрированным траекториям микропузырьков и соответствовала 0,688 м/с.




Затем больной было проведено зондирование сердца и измерено давление в его полостях. 
Различие между измеренным и вычисленным показателями составило: при применении известной допплер-эхокардиографической методики — 14%, при использовании предлагаемого способа — 13,5%.
Следовательно, рассчитанные показатели 
Вместе с тем, применение данного способа не потребовало оснащения сложным и дорогостоящим допплеровским оборудованием.
Больному З. , 21 года, весом 72 кг, ростом 169 см, с подозрением на дефект межпредсердной перегородки определялся систолический градиент давления (
Первоначально при импульсной допплер-эхокардиографии под контролем двухмерного изображения поперечного сечения сердца на уровне выносящего тракта правого желудочка и устья легочной артерии с учетом поправки на различие направлений оси ультразвукового луча и оси легочной артерии, составлявшее 16 o , при расположении контрольного объема сразу выше уровня раскрытия створок пульмонального клапана на основе показателей максимальной скорости систолического выброса в 5 сердечных циклах, было определено среднее значение максимальной скорости систолического выброса (V «допплер»), которое составило 1,21 м/с.
На ее основе по упрощенному уравнению Бернулли (



Далее больному было проведено эхоконтрастирование правый камер сердца путем внутривенного капельного введения 0,3% раствора перекиси водорода на стерильном физиологическом растворе со скоростью 120 капель в минуту, в общем количестве — 100 мл.
Ось ультразвукового луча установили в соответствии с направлением единой оси выносящего тракта правого желудочка и начального отдела ствола легочной артерии так, что угол между осью ультразвукового луча и единой осью составил 15 o .
В одномерном режиме регистрировались траектории движения газовых микропузырьков. Определялось среднее значение их систолической скорости движения (V «контраст») в устье легочной артерии, вычисленное на основе измерения показателей этой скорости в 5 сердечных циклах с хорошей визуализацией систолического фрагмента траекторий движения эхоконтрастных микропузырьков.
Показатели скорости определялись путем построения касательной C-D к наиболее качественно зарегистрированным траекториям движения микропузырьков в указанной анализируемой зоне сердца с учетом интервала QT электрокардиограммы, снимаемой одновременно с эхокардиограммой, в промежутке времени A-B, начинающимся на расстоянии 0,43 

В данном случае интервал QT составлял 0,45 с.
Промежуток времени A-B, в рамках которого осуществлялись анализ траекторий движения эхоконтрастных микропузырьков и определение их скорости, начинался с точки A, расположенной на расстоянии 0,19 с (0,43 

V «контраст» в данном промежутке времени определялась путем построения касательной C-D к наиболее качественно зарегистрированным траекториям микропузырьков и соответствовала 1,15 м/с.




Позднее больному было проведено зондирование сердца и измерен 
Различие между измеренным и вычисленным показателем достигало: при применении известной допплер-эхокардиографической методики — 16,3%, при использовании предлагаемого способа — 9,3%.
Следовательно, при использовании предлагаемого способа отличие рассчитанного показателя 
Вместе с тем, применение данного способа не потребовало оснащения сложным и дорогостоящим допплеровским оборудованием.
Клинические испытания предлагаемого способа были выполнены при обследовании 81 человека, составивших три группы лиц: 1-я — 12 человек без порока сердца; 2-я — 27 пациентов с незаращением овального окна;
3-я — 6 пациентов с открытым артериальным протоком,
4 пациента с аномалией Эбштейна, 21 пациент с дефектором межпредсердной перегородки, 4 пациента с дефектом межжелудочковой перегородки, 7 пациентов со стенозом легочной артерии.
Состояние сердечно-сосудистой системы у обследованных устанавливалось при комплексном клинико-инструментальном исследовании с применением эхокардиографии, зондирования сердца и рентгенконтрастной вентрикулографии.
Эхокардиографическое исследование выполнялось с использованием аппаратов Sonolayer SSH-40A («Toshiba», Япония), Sonoline CD («Siemens», Германия), Vingmed CFM-725 («Diasonics Sonotron», ФРГ).
Показатели систолического градиента давления между правым желудочком и легочной артерией, полученные с помощью известной допплер-эхокардиографической методики, имели с градиентом, измеренным при зондировании сердца, коэффициент линейной корреляции Пирсона (r) равный: для 1-й группы — 0,85; для 2-й группы — 0,90; для 3-й группы — 0,91. Тот же коэффициент для показателей отмеченного градиента, полученных предлагаемым способом, в сравнении с показателями, измеренными при зондировании сердца, соответствовал: для 1-й группы — 0,79; для 2-й группы — 0,89; для 3-й группы — 0,88.
Следовательно, коэффициент линейной корреляции предлагаемого способа по отношению к данным прямого измерения 
При этом не обнаружено статистически достоверного различия (p > 0,05) между средними результатами показателей 


Также в отмеченных группах при сравнении воспроизводимости получения показателя 
Все вышеотмеченное свидетельствует о хорошей адекватности и высокой надежности предлагаемого способа. По точности он не уступает известной допплер-эхокардиографической методике определения 
При использовании данного способа отсутствовали тяжелые и опасные для жизни осложнения, что является значительным преимуществом по сравнению с гораздо более инвазивной методикой зондирования полостей сердца.
Способ может быть рекомендован для широкого применения в медицинской практике как в госпитальных, так и в амбулаторных условиях.
Источники информации
1. Шиллер Н., Осипов М.А. Клиническая эхокардиография. М., 1993, с.45 — 59 (прототип).
2. Сидельников В. М. , Кривченя Д.Ю., Бабко С.А. Оценка состояния сердечно-сосудистой системы по данным инструментальных методов исследования. // Кардиология детского возраста / Под ред. П.С. Мощича, В.М. Сидельникова, Д. Ю. Кривчени. Киев, «Здоровь’я», 1986, 42 — 50.
Способ определения систолического градиента давления между правым желудочком и легочной артерией (


http://nsportal.ru/ap/library/nauchno-tekhnicheskoe-tvorchestvo/2020/05/04/primenim-li-zakon-bernulli-dlya-dvizheniya
http://findpatent.ru/patent/212/2127544.html

