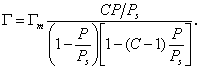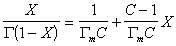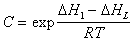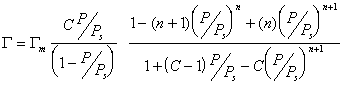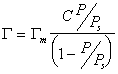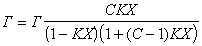Уравнение бэт адсорбция удельная поверхность
В большинстве случаев реальная поверхность твердого тела не вполне однородна энергетически; адсорбция, как правило, не является строго локализованной; адсорбированные молекулы практически всегда взаимодействуют между собой; наконец, стехиометрия может нарушаться, вследствие чего адсорбция не будет ограничена образованием одного слоя. Поэтому реальные изотермы адсорбции всегда отклоняются от изотермы Ленгмюра. Еще самим Ленгмюром было показано, что если адсорбционные центры считать энергетически неоднородными, то суммарная адсорбция на всех центрах будет выражена следующим уравнением:
где i — количество групп одинаковых центров.
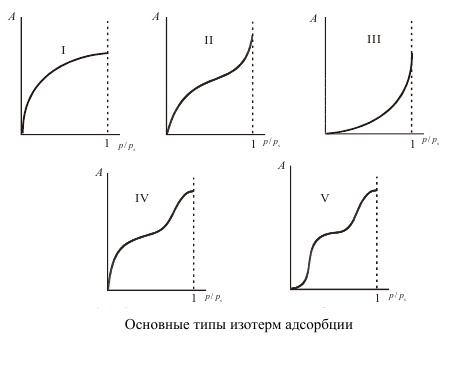
Брунауэр, Эммет и Теллер отказались от второго допущения Ленгмюра, приводящего к мономолекулярной адсорбции. Для случая, когда температура адсорбтива ниже критической (то есть, это еще пар) они разработали теорию полимолекулярной адсорбции. После анализа многочисленных реальных изотерм адсорбции ими была предложена их классификация на основе выделения пяти основных типов изотерм.
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией. Приче м, в случае II взаимодействие адсорбент — адсорбат сильнее взаимодействия адсорбат — адсорбат, а в случае III — наобор от. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на не пористом адсорбенте, а типа IV и V — на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”, названной так по начальным буквам фамилий ее авторов.
Теория БЭТ сохраняет ленгмюровские представления о динамическом характере адсорбции. Адсорбция считается полислойной. Молекулы первого слоя адсорбируются на поверхности адсорбента в результате межмолекулярного взаимодействия адсорбент — адсорбат. Каждая адсорбированная молекула первого адсорбционного слоя может, в свою очередь, являться центром адсорбции молекул второго слоя и т.д. Так формируются второй и последующие сорбционные слои. Теплота адсорбции в первом слое q1 определяется взаимодействием адсорбат — адсорбент, во всех последующих слоях — взаимодействием адсорбат — адсорбат. Поэтому теплота адсорбции во всех слоях, начиная со второго, равна теплоте конденсации λ. Второй и последующие адсорбционные слои могут начинать образовываться и при незавершенном первом слое, как это показано на рисунке:
Составив уравнение адсорбционного равновесия для каждого слоя и просуммировав их, авторы теории БЭТ получили уравнение для полислойной адсорбции:
В приведенном уравнении АМ — емкость монослоя, С — константа, равная е (q1− λ) / RT . При малых относительных давлениях, когда р как частный случай уравнения БЭТ. В случаях, когда q1 > λ , т.е. энергия взаимодействия адсорбент — адсорбат больше энергии взаимодействия адсорбат — адсорбат, изотерма адсорбции выпукла и относится к типу II или IV. Если же энергия взаимодействия адсорбат — адсорбат больше теплоты адсорбции ( λ > q1 ), то изотерма адсорбции вогнута и относится к типу III или V.
Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов. Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок, равный 1 / АМ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / АМ С.
Из этих значений можно найти величину АМ, а зная ее, рассчитать по уравнению удельную поверхность адсорбента. Стандартной методикой для определения удельной поверхности адсорбентов принято считать измерение изотермы адсорбции азота при 77 К. В этом случае wо = 0.162 нм 2 .
- Источник: Пальтиель Л.Р., Зенин Г.С., Волынец Н.Ф. КОЛЛОИДНАЯ ХИМИЯ: Учеб. пособие. – СПб: СЗТУ, 2004. – 68 с.
- Источник: Кукушкина И.И., Митрофанов А.Ю. Коллоидная химия, Кемерово:2009 — 185 с.
Уравнение изотермы адсорбции теории БЭТ
Уравнение Лэнгмюра
При адсорбции газов и паров на поверхности твердых тел (адсорбентов) возможно прямое экспериментальное определение удельной адсорбции по разности давлений газа до и после адсорбции. Удельную адсорбцию растворенных веществ на поверхности твердых тел также определяют экспериментально по изменению концентрации раствора до и после адсорбции.
В некоторых случаях при адсорбции газов толщина поверхностного слоя (слоя адсорбированного газа) равна размеру адсорбированных молекул. К таким системам применима теория мономолекулярной адсорбции Лэнгмюра.
Эта теория устанавливает следующую зависимость между удельной адсорбцией и равновесным давлением:

А∞-предельно возможное значение удельной адсорбции при полном заполнении активных центров поверхности;
k-константа, пропорциональная энергии взаимодействия молекул газа с адсорбентом.
Для некоторых систем А∞ численно равна удельной адсорбции, соответствующей образованию на поверхности адсорбента насыщенного монослоя.
Преобразуя уравнение (1) в линейное уравнение, получаем:

Из уравнения (2) следует, что в случае применимости уравнения (1) изотерма адсорбции, построенная в координатах р/А=f(p), будет представлять собой прямую линию с угловым коэффициентом, равным 1/А∞. Уравнение Лэнгмюра для адсорбции из растворов на поверхности твердых тел выглядит таким образом:

а линейная его форма:

В данном случае изотерма адсорбции строится в координатах c/A=f(c) и будет представлять собой прямую линию с тем же коэффициентом.
В некоторых случаях применяется уравнение Ленгмюра вида:

Здесь Va – адсорбционный объем, V – равновесный объем адсорбата.
Уравнение изотермы адсорбции теории БЭТ
При адсорбции газов и паров на поверхности многих адсорбентов образуется полимолекулярный адсорбционный слой. В этих случаях теория Ленгмюра неприменима и для различного рода расчетов пользуются теорией БЭТ.
Теория БЭТ устанавливает следующую зависимость между A и p :

Am-адсорбционная емкость насыщенного монослоя, определяющаяся размером “посадочной” площадки молекулы газа, т.е. площадью, которую она занимает в насыщенном монослое;
k-константа, зависящая от энергии взаимодействия молекул в адсорбционном слое;
PS-давление насыщенного пара.
Уравнение (5) можно привести к виду:



В таком виде уравнение БЭТ является уравнением прямой линии, если функцией считать величину, стоящую слева, а аргументом —P/PS.
Теория БЭТ используется для расчета удельной поверхности адсорбентов (поверхности единицы массы адсорбента) по экспериментально полученной изотерме адсорбции.
Для определения удельной поверхности адсорбента S строят график зависимости P/PS/(1- P/PS)A от P/PS. По угловому коэффициенту прямой, равному, (k-1)/kAm, и, величине отрезка, отсекаемого на оси ординат при P/PS =0 и равного 1/Amk (рис.1), рассчитывают Am.
Удельная поверхность вычисляется по формуле:

S0-площадь, занимаемая одной молекулой газа в адсорбционном слое;
Рис.1.Изотерма адсорбции в координатах линейной формы уравнения БЭТ.
Для адсорбции из растворов линейная форма уравнения БЭТ выглядит таким образом:

Сs-концентрация насыщенного раствора.
Изотерму адсорбции строим так же, как и в первом случае, в координатах соответствующих этому уравнению. Аналогично вычисляется удельная поверхность:

Метод БЭТ
Метод БЭТ сокр., БЭТ (англ. BET) — метод математического описания физической адсорбции основанный на теории полимолекулярной (многослойной) адсорбции.
Теория полимолекулярной адсорбции была развита в работах Брунауэра, Эммета и Теллера (БЭТ). В основе этой теории лежит распространение обобщенных представлений локализованного монослоя на полислойную адсорбцию. В теории БЭТ используется предпосылка, что молекулы каждого предыдущего адсорбционного слоя служат активными центрами при образовании последующих слоев. Это предполагает, что емкость каждого слоя одинакова. Считается, что силами взаимодействия между молекулами в каждом адсорбционном слое можно пренебречь (отсутствие латеральных взаимодействий), а молекулы каждого адсорбционного слоя локализованы. Полагается, что адсорбционный потенциал в первом адсорбционном слое значительно выше, чем в других слоях, а начиная со второго адсорбционного слоя он сопоставим с энергией конденсации (изотермы типа II, IV) или для всех слоев одинаков (изотермы III, IV).
Существует несколько методик вывода уравнений изотермы полимолекулярной адсорбции. В работах Брунауэра с сотрудниками использовался кинетический вывод уравнения изотермы полимолекулярной адсорбции. Позднее вывод этого уравнения был осуществлен методом статистической термодинамики.
В оригинальном кинетическом выводе уравнения изотермы адсорбции БЭТ рассматривается равновесие между адсорбционными комплексами различного заполнения. Считается, что на поверхности адсорбента одновременно могут находиться незаполненные активные центры и адсорбционные комплексы, содержащие 1, 2, 3…i, молекул адсорбата, которым соответствует площадь поверхности адсорбентаA0, A1, A2, A3, …Ai.
В 1937 году Брунауэр С., Эммет П. и Теллер Е. вывели уравнение полимолекулярной физической адсорбции, которое описывает зависимость физической адсорбции от величины поверхности:
Уравнение известно как простая форма изотермы адсорбции БЭТ. Это уравнение может быть представлено в линейной форме. Обозначим для упрощения Р/Р S =Х и разделим на X обе части уравнения:
В такой форме график зависимости должен давать прямую с наклоном С-1/ГmС и отрезком, отсекающим на оси ординат 1/ ГmС .Решение двух численных уравнений позволяет определить постоянную уравнения С, предел адсорбции Гm в монослое и рассчитать удельную активную поверхность Ауд = nmAo = ГmAoNA, где Гm должна быть выражена в моль/г; А0– называют площадью молекулярного сечения адсорбата или чаще – адсорбционной «посадочной площадкой» (этот параметр представляет собой площадь, которую занимает молекула адсорбата в насыщенном мономолекулярном слое).
Температурная зависимость постоянных равновесия K1 и С позволяет определить чистую теплоту адсорбции, так как
где DH1 , DHL – теплота адсорбции в первом адсорбционном слое и теплота конденсации адсорбата.
Если адсорбент пористый и адсорбция идет в результате заполнения мезопор, то уравнение БЭТ принимает вид:
Интересно отметить, что уравнение при n=1 переходит в уравнение Ленгмюра:
В то время как уравнение БЭТ в простейшей форме может перейти в уравнение Ленгмюра только при дополнительных условиях, что С>>1 и Р/Рs 2, то уравнение БЭТ дает изотермы типа II, при С
Строго говоря, достаточно надежные данные по емкости монослоя получаются лишь при обработке результатов эксперимента по адсорбции в области малых давлений, где модель полислойной адсорбции БЭТ оказывается справедливой. Часто на линейной изотерме адсорбции наблюдаются два участка – один в области низких относительных давлений, другой — при более высоких давлениях. Для расчетов Гm следует использовать линейный участок при низких давлениях, но только в том случае, если он включает в себя точку В. Чаще всего для определения емкости монослоя используют данные по адсорбции при 0,05 0,3 проявляется латеральное взаимодействие в адсорбционных споях.
Статистико-механическая трактовка полимолекулярной адсорбции и соответствующий вывод уравнения изотермы не позволяют снять указанные выше ограничения.
Кроме того, предпринимались неоднократные попытки модифицировать уравнение БЭТ. Так Андерсон предположил, что от второго до примерно девятого слоев теплота адсорбции отличается от теплоты конденсации на некоторую постоянную величину. Это позволило ввести в простейшее уравнение некоторую постоянную K
Интересно отметить, что в более поздних работах Брунауэра была получена аналогичная форма уравнения, но вывод его был основан на другой модели, а именно, на предпосылке, что число адсорбционных слоев даже на открытой поверхности при давлении насыщения Р/Рs®1 ограничено (5-6). Такое допущение также noзволяет ввести коэффициент K 2 /г, включив в нее изотерму адсорбции на природном кварце и различных образцах непористого и аморфного кремнезема. Такие стандартные изотермы получены и для других систем.
Многочисленные эксперименты на непористых сорбентах показали, что для определения удельной поверхности твердых адсорбентов наиболее удобно простейшее уравнение БЭТ. Для таких целей используют азот, аргон и криптон. Последний, предпочтительнее для адсорбентов с малой величиной удельной активной поверхности.
http://sdamzavas.net/3-17813.html
http://chemistry.herzen.spb.ru/%D0%B0%D0%B4%D1%81%D0%BE%D1%80%D0%B1%D1%86%D0%B8%D1%8F-%D1%81%D0%B2%D0%B8%D1%81%D1%82%D0%B0%D1%82%D1%8C-%D0%B2%D1%81%D0%B5%D1%85-%D0%BD%D0%B0-%D0%BF%D0%BE%D0%B2%D0%B5%D1%80%D1%85%D0%BD%D0%BE%D1%81/%D0%BC%D0%B5%D1%82%D0%BE%D0%B4-%D0%B1%D1%8D%D1%82/