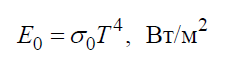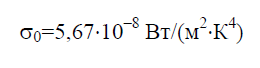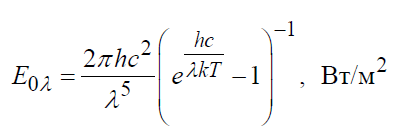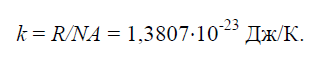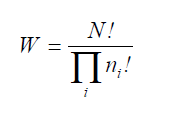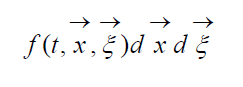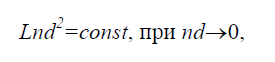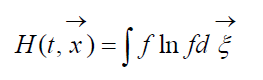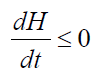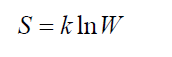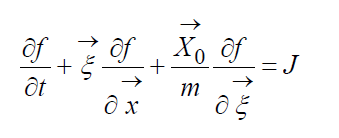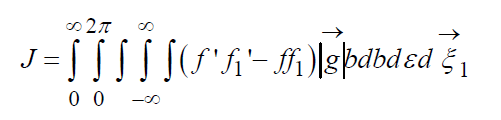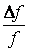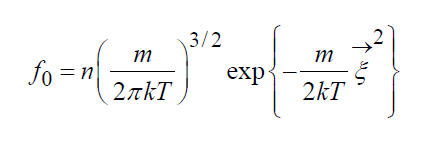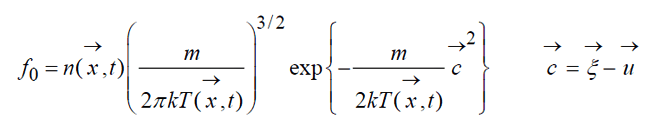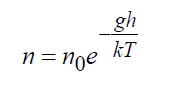Людвиг Больцман: Именные достижения
Закон излучения Стефана-Больцмана
Согласно закону Стефана – Больцмана плотность интегрального полусферического излучения E0 зависит только от температуры и изменяется пропорционально четвертой степени абсолютной температуры T:
Постоянная Стефана-Больцмана
Стефана – Больцмана постоянная σ0 – физическая постоянная, входящая в закон, определяющий объемную плотность равновесного теплового излучения абсолютно черного тела:
Исторически закон Стефана-Больцмана был сформулирован раньше закона излучения Планка, из которого он вытекает как следствие. Закон Планка устанавливает зависимость спектральной плотности потока излучения E0 от длины волны λ и температуры T:
где λ – длина волны, м; с=2,998 10 8 м/с – скорость света в вакууме; Т – температура тела, К;
h = 6,625 ×10 -34 Дж×с– постоянная Планка.
Постоянная Больцмана
Физическая постоянная k, равная отношению универсальной газовой постоянной R=8314Дж/(кг × K) к числу Авогадро NA=6,022 × 10 26 1/(кг × моль):
Статистика Больцмана
Число различных конфигураций системы из N частиц для данного набора чисел ni (число частиц, находящихся в i -том состоянии, которому соответствует энергия e i ) пропорционально величине:
Величина W есть число способов распределения N частиц по энергетическим уровням. Если справедливо соотношение (6) то считается, что исходная система подчиняется статистике Больцмана. Набор чисел ni , при котором число W максимально, встречается наиболее часто и соответствует наиболее вероятному распределению.
Физическая кинетика – микроскопическая теория процессов в статистически неравновесных системах.
Описание большого числа частиц может успешно осуществляться вероятностными методами. Для одноатомного газа состояние совокупности молекул определяется их координатами и значениями проекций скоростей на соответствующие координатные оси. Математически это описывается функцией распределения, характеризующей вероятность пребывания частицы в данном состоянии:
есть ожидаемое число молекул в объеме d 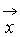
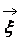
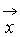
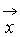
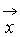
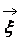
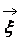
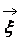
Газ Больцмана
Если осредненной по времени потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией, то газ называется идеальным. Идеальный газ называется газом Больцмана, если отношение длины пробега молекул в этом газе к характерному размеру течения L конечно, т.е.
т.к. длина пробега обратно пропорциональна nd 2 (n – числовая плотность 1/м 3 , d – диаметр молекулы, м).
H-функция Больцмана
называют H-функцией Больцмана для единицы объема, которая связана с вероятностью обнаружения системы из молекул газа в данном состоянии. Каждому состоянию соответствуют определенные числа заполнения шестимерных пространственно-скоростных ячеек, на которые может быть разбито фазовое пространство рассматриваемых молекул. Обозначим W вероятность того, что в первой ячейке рассматриваемого пространства окажется N1 молекул, во второй N2 и т.д.
С точностью до постоянной, определяющей начало отсчета вероятности, правомерно соотношение:
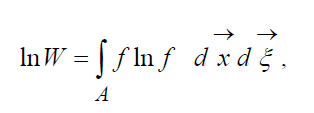
где 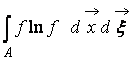
H-теорема Больцмана
Принцип Больцмана
Больцмана принцип устанавливает связь между энтропией S физической системы и термодинамической вероятностью W её состояния:
Кинетическое уравнение Больцмана
(печатается по изданию: Коган М.Н. Динамика разреженного газа. – М.: Наука, 1967.)
где 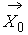
Уравнение (12) с интегралом (13) получено для столкновения молекул, при которых не возникает тангенциальных сил, т.е. сталкивающиеся частицы считаются идеально гладкими.
В процессе взаимодействия внутренняя энергия молекул не меняется, т.е. предполагается, что эти молекулы являются идеально упругими. Рассматриваются две группы молекул, имеющих до соударения друг с другом (столкновения) скорости 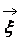
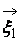
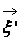
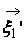
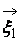
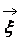
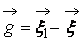
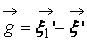
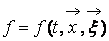
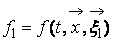
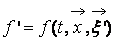
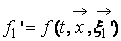
Рис. 1. Столкновение двух молекул.
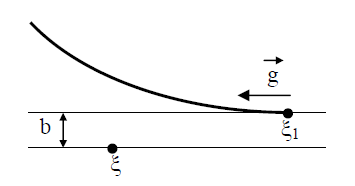
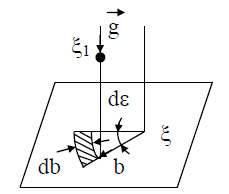
В (13) входят два параметра, характеризующие расположение сталкивающихся молекул друг относительно друга: b и ε; b – прицельное расстояние, т.е. наименьшее расстояние, на которое сблизились бы молекулы при отсутствии взаимодействия (рис. 2); ε называют угловым параметром столкновений (рис. 3). Интегрирование по b от 0 до ¥ и по от 0 до 2 p (два внешних интеграла в (12)) охватывает всю плоскость силового взаимодействия перпендикулярно вектору
Рис. 2. Траектория движения молекул.
Рис. 3. Рассмотрение взаимодействия молекул в цилиндрической системе координат: z, b, ε
Кинетическое уравнение Больцмана выведено при следующих допущениях и предположениях.
1. Считается, что происходит в основном столкновения двух молекул, т.е. роль столкновений одновременно трех и большего числа молекул незначительна. Это допущение позволяет использовать для анализа одночастичную функцию распределения, которая выше названа просто функцией распределения. Учет столкновения трех молекул приводит к необходимости использования в исследовании двухчастичной функции распределения. Соответственно анализ существенно усложняется.
2. Предположение о молекулярном хаосе. Оно выражается в том, что вероятности обнаружения частицы 1 в фазовой точке 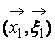
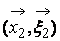
3. Равновероятны столкновения молекул с любым прицельным расстоянием, т.е. функция распределения не меняется на диаметре взаимодействия. Необходимо отметить, что анализируемый элемент 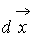
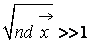

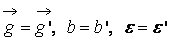
Распределение Максвелла-Больцмана
Равновесное состояние газа описывается абсолютным Максвелловским распределением, которое является точным решением кинетического уравнения Больцмана:
где m – масса молекулы, кг.
Общее локально-максвелловское распределение иначе называемое распределение Максвелла-Больцмана:
в том случае, когда газ движется как целое со скоростью 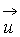
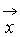
и времени t .
Формула Больцмана барометрическая
В поле тяготения Земли точное решение уравнения Больцмана показывает:
где n 0= плотность у поверхности Земли, 1/м 3 ; g – ускорение силы тяжести, м/с 2 ; h – высота, м. Формула (16) является точным решением кинетического уравнения Больцман либо в безграничном пространстве, либо при наличии границ, не нарушающих этого распределения, при этом температура также должна оставаться постоянной.
Эта страница оформлена Пузиной Ю.Ю. при поддержке Российского Фонда Фундаментальных Исследований – проект №08-08-00638.
Постоянная Больцмана
Постоянная Больцмана, представляющая собой коэффициент, равный k = 1 , 38 · 10 — 23 Д ж К , является частью значительного числа формул в физике. Она получила свое название по имени австрийского физика – одного из основоположников молекулярно-кинетической теории. Сформулируем определение постоянной Больцмана:
Постоянной Больцмана называется физическая постоянная, с помощью которой определяется связь между энергией и температурой.
Не следует путать ее с постоянной Стефана-Больцмана, связанной с излучением энергии абсолютно твердого тела.
Существуют различные методы вычисления данного коэффициента. В рамках этой статьи мы рассмотрим два их них.
Нахождение постоянной Больцмана через уравнение идеального газа
Данная постоянная может быть найдена с помощью уравнения, описывающего состояние идеального газа. Опытным путем можно определить, что нагревание любого газа от T 0 = 273 К до T 1 = 373 К приводит к изменению его давления от p 0 = 1 , 013 · 10 5 П а до p 0 = 1 , 38 · 10 5 П а . Это достаточно простой эксперимент, который может быть проведен даже просто с воздухом. Для измерения температуры при этом нужно использовать термометр, а давления – манометр. При этом важно помнить, что количество молекул в моле любого газа примерно равно 6 · 10 23 , а объем при давлении в 1 а т м равен V = 22 , 4 л . С учетом всех названных параметров можно перейти к вычислению постоянной Больцмана k :
Для этого запишем уравнение дважды, подставив в него параметры состояний.
Зная результат, можем найти значение параметра k :
Нахождение постоянной Больцмана через формулу броуновского движения
Для второго способа вычисления нам также потребуется провести эксперимент. Для него нужно взять небольшое зеркало и подвесить в воздухе с помощью упругой нитки. Допустим, что система зеркало-воздух находится в стабильном состоянии (статическом равновесии). Молекулы воздуха ударяют в зеркало, которое, по сути, ведет себя как броуновская частица. Однако с учетом его подвешенного состояния мы можем наблюдать вращательные колебания вокруг определенной оси, совпадающей с подвесом (вертикально направленной нитью). Теперь направим на поверхность зеркала луч света. Даже при незначительных движениях и поворотах зеркала отражающийся в нем луч будет заметно смещаться. Это дает нам возможность измерить вращательные колебания объекта.
Обозначив модуль кручения как L , момент инерции зеркала по отношению к оси вращения как J , а угол поворота зеркала как φ , можем записать уравнение колебаний следующего вида:
Минус в уравнении связан с направлением момента сил упругости, который стремится вернуть зеркало в равновесное положение. Теперь произведем умножение обеих частей на φ , проинтегрируем результат и получим:
Следующее уравнение является законом сохранения энергии, который будет выполняться для данных колебаний (то есть потенциальная энергия будет переходить в кинетическую и обратно). Мы можем считать эти колебания гармоническими, следовательно:
При выведении одной из формул ранее мы использовали закон равномерного распределения энергии по степеням свободы. Значит, можем записать так:
Как мы уже говорили, угол поворота можно измерить. Так, если температура будет равна приблизительно 290 К , а модуль кручения L ≈ 10 — 15 Н · м ; » open=» φ ≈ 4 · 10 — 6 , то рассчитать значение нужного нам коэффициента можно так:
Следовательно, зная основы броуновского движения, мы можем найти постоянную Больцмана с помощью измерения макропараметров.
Значение постоянной Больцмана
Значение изучаемого коэффициента состоит в том, что с его помощью можно связать параметры микромира с теми параметрами, что описывают макромир, например, термодинамическую температуру с энергией поступательного движения молекул:
» open=» E = 3 2 k T .
Этот коэффициент входит в уравнения средней энергии молекулы, состояния идеального газа, кинетической теории газа, распределение Больцмана-Максвелла и многие другие. Также постоянная Больцмана необходима для того, чтобы определить энтропию. Она играет важную роль при изучении полупроводников, например, в уравнении, описывающем зависимость электропроводности от температуры.
Условие: вычислите среднюю энергию молекулы газа, состоящего из N -атомных молекул при температуре T , зная, что у молекул возбуждены все степени свободы – вращательные, поступательные, колебательные. Все молекулы считать объемными.
Энергия равномерно распределяется по степеням свободы на каждую ее степень, значит, на эти степени будет приходиться одинаковая кинетическая энергия. Она будет равна » open=» ε i = 1 2 k T . Тогда для вычисления средней энергии мы можем использовать формулу:
» open=» ε = i 2 k T , где i = m p o s t + m υ r + 2 m k o l представляет собой сумму поступательных вращательных степеней свободы. Буквой k обозначена постоянная Больцмана.
Переходим к определению количества степеней свободы молекулы:
m p o s t = 3 , m υ r = 3 , значит, m k o l = 3 N — 6 .
i = 6 + 6 N — 12 = 6 N — 6 ; » open=» ε = 6 N — 6 2 k T = 3 N — 3 k T .
Ответ: при данных условиях средняя энергия молекулы будет равна » open=» ε = 3 N — 3 k T .
Условие: есть смесь двух идеальных газов, плотность которых в нормальных условиях равна p. Определите, какова будет концентрация одного газа в смеси при условии, что мы знаем молярные массы обоих газов μ 1 , μ 2 .
Сначала вычислим общую массу смеси.
m = ρ V = N 1 m 01 + N 2 m 02 = n 1 V m 01 + n 2 V m 02 → ρ = n 1 m 01 + n 2 m 02 .
Параметр m 01 обозначает массу молекулы одного газа, m 02 – массу молекулы другого, n 2 – концентрацию молекул одного газа, n 2 – концентрацию второго. Плотность смеси равна ρ .
Теперь из данного уравнения выразим концентрацию первого газа:
n 1 = ρ — n 2 m 02 m 01 ; n 2 = n — n 1 → n 1 = ρ — ( n — n 1 ) m 02 m 01 → n 1 = ρ — n m 02 + n 1 m 02 m 01 → n 1 m 01 — n 1 m 02 = ρ — n m 02 → n 1 ( m 01 — m 02 ) = ρ — n m 02 .
Далее нам потребуется уравнение, описывающее состояние идеального газа:
p = n k T → n = p k T .
Подставим полученное равнее значение:
n 1 ( m 01 — m 02 ) = ρ — p k T m 02 → n 1 = ρ — p k T m 02 ( m 01 — m 02 ) .
Поскольку молярные массы газов нам известны, мы можем найти массы молекул первого и второго газа:
m 01 = μ 1 N A , m 02 = μ 2 N A .
Также мы знаем, что смесь газов находится в нормальных условиях, т.е. давление равно 1 а т м , а температура 290 К . Значит, мы можем считать задачу решенной.
Ответ: в данных условиях рассчитать концентрацию одного из газов можно как n 1 = ρ — p k T m 02 ( m 01 — m 02 ) , где m 01 = μ 1 N A , m 02 = μ 2 N A .
Физический смысл и формула постоянной Больцмана
Талантливый Людвиг Больцман — один из крупнейших учёных XIX века. Именно этот человек в своё время внёс колоссальный вклад в развитие молекулярно-кинетической теории.
Целеустремлённость Больцмана повлекла за собой то, что он стал одним из главных основателей статической механики.
Краткое описание
Людвиг был автором многогранной эргодической гипотезы, статистического метода в подробном толковании идеального газа, который был основан на уравнении физической кинетики. Больцман все свои силы вложил в то, чтобы общественность могла больше узнать о термодинамике.
В итоге он смог вывести теорему, где подробно описал статистический принцип для второго начала термодинамики.
Физики высоко ценят точку зрения Больцмана, так как в результате многочисленных попыток он смог описать теорию излучения. В своих работах он неоднократно затрагивал вопросы электродинамики, оптики. Имя этого талантливого учёного было увековечено сразу в двух физических константах.
В своё время Больцман был убеждённым и последовательным сторонником теории многогранного атомно-молекулярного строения вещества. В течение многих лет он был вынужден бороться с непониманием и отрицательными отзывами по отношению к его работам в научном сообществе того времени. Многие физики полагали, что молекулы и атомы представляют собой излишнюю абстракцию.
Коллеги Больцмана были настроены весьма консервативно, из-за чего у талантливого физика возникла депрессия, с которой он так и не смог справиться. Учёный покончил с собой.
На надгробном памятнике в знак огромной признательности к его заслугам было выбито уравнение S = k * logW. В этом уравнении константа k является произведением постоянной Больцмана. Для решения задач нужно соблюдать размерность физической величины.
Основное соотношение температуры и энергии
Традиционная модель идеального газа активно используется для правильного расчёта состояний реального вещества при давлениях и температурах, которые близки к нормальным показателям.
В этом случае размер молекулы существенно меньше объёма, который занят определённым количеством газа. А вот расстояние между частицами существенно превышает итоговый радиус их тесного взаимодействия. В кинетической теории чётко описаны все необходимые понятия уравнения.
Для поиска средней энергии таких частиц принято использовать следующую формулу: E cp = 3/2 * kT. Расшифровка выглядит следующим образом:
- Т — температура.
- Е — кинетическая энергия.
- 3,2* k — используемый коэффициент пропорциональности.
В этом случае используется число 3, которое характеризует количество степеней свободы поступательного движения молекул в трёх пространственных измерениях.
А вот величину k через некоторое время назвали постоянной Больцмана в честь австрийского физика. Этот термин призван показывать то, какую часть энергии или джоуля содержит в себе один градус.
Значение константы определяет, насколько именно может статистически увеличиваться энергия хаотического движения одного фрагмента идеального газа при повышении температуры на 1°. Общая энергия теплового излучения определяется законом Стефана — Больцмана.
Установить зависимость между константой и другими фундаментальными постоянными можно, приравняв величину средней энергии молекул, найденную разными способами.
Распределение молекул статистическим образом
Учащихся часто интересует вопрос, чему равно значение постоянной Больцмана, так как это направление имеет огромную ценность в физике. Учёными было доказано, что состояние вещества макроскопического порядка представляет собой конкретный результат поведения огромной совокупности определённых частиц, так как именно с их помощью можно описать все существующие сегодня статистические методы.
Для решения элементарных задач обязательно нужно разобраться в том, каким именно образом происходит распределение энергетических параметров молекул газа.
В этом случае следует учесть несколько важных нюансов:
- На практике было доказано, что физический смысл постоянной Больцмана обязательно включает в себя своеобразное максвелловское распределение кинетических скоростей и энергий. Результат в полном объёме отображает то, что когда газ пребывает в состоянии равновесия, большинство молекул обладает определёнными скоростями, близкими к некоторой наиболее вероятной скорости. Для отображения массы молекулы предназначена определённая формула: v = √(2kT/m0).
- Практикуется применение статистики Больцмановского распределения потенциальных энергий для газов, пребывающих в поле каких-либо сил. К примеру, гравитация на нашей планете. Итоговый показатель во многом зависит от соотношения сразу двух факторов: притяжения к поверхности Земли, а также хаотического теплового движения частиц газа. Это значит, что чем ниже будет потенциальная энергия молекул, тем выше будет их итоговая концентрация.
Стоит учесть, что оба этих метода успешно объединяются в многофункциональное распределение Максвелла-Больцмана.
В этом случае учёные предусмотрели наличие экспоненциального множителя — е -Е/ kT . Большой буквой Е обозначают сумму кинетической и потенциальной энергии.
А вот kT обозначают среднюю энергию теплового движения, которая отлично управляется постоянной талантливого физика Больцмана.
Ключевые нюансы
Если при абсолютной температуре (Т) хранится однородный идеальный газ, то та энергия, что приходится на каждую поступательную степень свободы, обязательно будет равна формуле kT /2 (это утверждение подробно описано в распределении Максвелла).
Если рассматривать конкретную ситуацию на примере комнатной температуры, то итоговый показатель энергии будет находиться в пределах 2.07 * 10 -21 Дж (0.013 эВ).
В результате проведённых исследований удалось доказать, что в одноатомном идеальном газе каждый отдельный атом обладает сразу тремя степенями свободы. Данные соответствуют трем пространственным осям, благодаря чему на каждый атом приходится энергия, которая равна формуле 3/2 kT.
Правильно вычислить среднеквадратичную скорость атомов можно только в том случае, если изначально знать реальную тепловую энергию. Используемые данные должны быть обратно пропорциональны квадратичному корню атомной массы.
В учебниках по физике содержится информация о том, что стандартная среднеквадратичная скорость при комнатной температуре может варьироваться от 1379 м/с (утверждение уместно по отношению к гелию) до 240 м/с (ксенон). Ситуация немного усложняется в том случае, если речь касается молекулярного газа.
Пример: пять степеней свободы имеет двухатомный газ (колебания атомов в молекуле отсутствует только в том случае, если температура окружающей среды кардинально снижена).
Экспертами было доказано, что именно энтропия термодинамической системы может измеряться как натуральный логарифм от числа разных микросостояний (V), которые в точности соответствуют конкретному микроскопическому состоянию (чаще всего это утверждение касается состояния с заданной полной энергией).
Для решения задачи лучше воспользоваться этой формулой: S = k ln V. Постоянная Больцмана отображена коэффициентом пропорциональности (k). Определяющая связь между микроскопическими (V) и макроскопическими состояниями (S) отлично выражает главную идею многогранной статистической механики.
Способы нахождения постоянной Больцмана
Физика является интересной и многогранной наукой. Для решения поставленных задач часто используется постоянная Больцмана. Формула имеет свои особенности, но для изучения всех нюансов понадобится реальный эксперимент.
Для этого необходимо взять обычное зеркало и подвесить его в воздухе при помощи упругой нитки. Можно представить, что созданная система зеркало-воздух пребывает в стабильном состоянии, которое ещё называется статистическим равновесием.
Крошечные молекулы воздуха ударяют в поверхность зеркала, которое на практике ведёт себя как броуновская частица. С учётом подвешенного состояния во время эксперимента можно наблюдать вращательные колебания вокруг определённой оси, которая совпадает с вертикально направленной нитью.
После проделанных манипуляций нужно направить луч света на поверхность зеркала. Даже при минимальных поворотах и вращающихся движениях зеркала отражающийся луч будет существенно смещаться. Благодаря этому, есть возможность измерить вращательные колебания объекта.
Для обозначения модуля кручения нужно использовать большую букву Р. Момент инерции зеркала по отношению к основной оси вращения можно записать как В, а вот угол поворота зеркала — как Т. Недостатком этого примера можно считать то, что сила упругости стремится вернуть зеркало в равновесное положение.
Если умножить обе части на Т и проинтегрировать результат, то в итоге можно будет получить следующий результат: Р ≈ 10 -15 Н * м; ≈ 4 ⋅ 10 −6 . Если знать основы многогранного броуновского движения, то в итоге можно будет найти реальную постоянную при помощи измерения макропараметров.
Существующая энергия равномерно распределяется по степеням свободы на каждую отдельную её степень. Это значит, что на каждую степень будет приходиться равная кинетическая энергия: =½kT.
Для правильного вычисления средней энергии принято использовать следующую элементарную формулу: =i/2kT, где i=m post +m υr +2m kol.
Решение этой задачи выглядит следующим образом:
- m post = 3, m υr = 3, а это значит, что m kol = 3N − 6;
- i = 6 + 6N — 12 = 6N − 6;
- = 6N − 6/2kT = (3N − 3) kT.
Решение этой задачи является элементарным, но это утверждение актуально только в том случае, если учащийся заранее разобрался со всеми тонкостями. После проведённых манипуляций можно определить, что средняя энергия молекулы будет составлять = (3N − 3) kT.
Физическая константа
Этот раздел физики нельзя оставлять без внимания. Экспертами неоднократно было доказано, что формула Больцмана относится к категории фундаментальных констант. Если учесть все нюансы, то в итоге можно определить характеристики микроскопических явлений молекулярного уровня с параметрами процессов, которые можно наблюдать в макромире. Константа Больцмана входит в ряд важных уравнений в физике.
На сегодняшний день всё ещё неизвестно, существует ли в науке какой-либо физический принцип, на основании которого можно было бы вывести необходимую формулу исключительно теоретически.
А это значит, что в качестве меры соответствия кинетической энергии частиц можно было бы использовать другие величины и математические единицы вместо привычных градусов. Тогда численное значение константы имело бы совершенно другой показатель, но она по-прежнему оставалась бы постоянной величиной.
Если рассматривать примеры других фундаментальных величин аналогичного принципа со стандартным зарядом и постоянной гравитационной, то наука воспримет существующую константу Больцмана как данность и будет использовать её для теоретического описания протекающих на планете физических процессов.
В конце 2011 года состоялась Генеральная конференция по весам и мерам, которая приняла резолюцию. В документах было подробно описано то, что нужно выполнить полноценную ревизию Международной системы единиц, чтобы иметь возможность зафиксировать значение постоянной. Такая фиксация была напрямую связана со стремлением переопределить конкретную единицу термодинамической температуры кельвин.
http://zaochnik.com/spravochnik/fizika/molekuljarno-kineticheskaja-teorija/postojannaja-boltsmana/
http://prostudenta.ru/article-1685.html