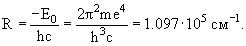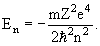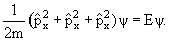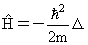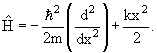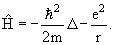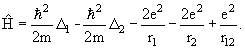Квантовая механика Бора
Вы будете перенаправлены на Автор24
Н. Бор известен как основатель первой квантовой теории атома и один из участников разработки основ квантовой механики. Ученый также внес ощутимый вклад в развитие теорий ядерной реакции и атомного ядра.
Квантовая теория атома Бора
В 1913 г. Н. Бор распространяет на атомы квантовую теорию, параллельно объясняя частоту волн, испускаемых ими при электрическом разряде. По предположению Бора, электроны могут находиться исключительно на некоторых дискретных орбитах, соответствующих разным энергетическим уровням.
«Перескок» электрона на другую орбиту (с меньшей энергией) будет сопровождаться испусканием фотонов, чья энергия определяется как разность энергий двух орбит.
Модель атома Бора появилась в 1913 г., основой выступает планетарная модель атома, ранее предложенная Резерфордом. Существенной проблемой было противоречие с классической динамикой, согласно которой, при движении вокруг ядра, электрон в модели Резерфорда должен непрерывно и, главное, очень быстро излучать энергию, иначе может ее растерять и упасть на ядро.
Бор для решения такой проблемы допускает, что электроны в атоме могут перемещаться только по стационарным орбитам (некоторым из них) и не будут, пребывая на них, излучать энергию. Энергетическое излучение и поглощение становится возможным только при переходе с одной орбиты на другую. Стационарными считаются лишь те орбиты, при движении по которым момент количества движения у электрона будет определяться целым числом постоянных Планка:
Применяя данное допущение, Бор получает возможность определить значения для радиуса стационарной орбиты $R_n$ и энергии $E_n$ для электрона, который находится на ней:
- $m_e$ будет массой электрона,
- $Z$ — количеством протонов в ядре,
- $E_0$ — электрической постоянной
- $e$ — зарядом электрона.
Принцип соответствия
В 1918 году в своей статье «Квантовая теория линейных спектров» Н. Бор представляет сформулированный им принцип соответствия. Данный принцип выступает связующим звеном между квантовой теорией и классической физикой.
Готовые работы на аналогичную тему
Идея соответствия была озвучена впервые еще в 1913 году, когда Бор предположил, что переходы между стационарными орбитами (с большими квант-числами) должны давать излучение с такой частотой, которая будет совпадать с частотой обращения электрона.
Принцип соответствия, начиная с 1918 года, стал мощным средством для получения новых результатов. Так, на основании представлений о коэффициентах Эйнштейна, он позволил определить вероятности переходов, а также интенсивности спектральных линий. Также с его помощью стала возможной интерпретация числа и поляризации компонент расщеплений Зеемана.
Впоследствии Бор определил четкую формулировку для принципа соответствия: наличие сопровождающихся излучением переходов между стационарными состояниями, связано с гармоническими компонентами колебаний в движении атома.
В период 1921-1923 гг. в ряде своих работ Бору удалось впервые на основании собственной модели атома объяснить периодическую систему Менделеева с представлением схемы заполнения электронных орбит.
В 1922 г. появилось подтверждение правильности интерпретации периодической таблицы в виде открытия Д. Костером и Г. Хевеши нового элемента – гафния. Как и ранее предсказывал Бор, данный элемент оказался по своим свойствам близок к цирконию, а не к редкоземельным элементам, согласно более ранней версии.
В 1922 году Бору была присуждается Нобелевская премия по физике за большой вклад в изучение строения атома. В своей лекции на тему строения атомов, прочитанной в том же году в Стокгольме, Бор подводит итоги десятилетней работы.
Принцип дополнительности
Новой теорией становится квантовая механика, возникшая в период 1925-1927 гг., благодаря работам Э. Шредингера, В. Гейзенберга, М. Борна, П. Дирака. Наряду с тем, несмотря на формальные успехи квантовой механики, ее основные идеи первое время оставались во многом неясными.
Для полного понимания физических основ квантовой механики требовалось связать теорию с экспериментальной частью и прояснить таким образом смысл используемых в ней понятий, другими словами, — дать интерпретацию ее формализма.
Именно над вопросами физической интерпретации квантовой механики размышлял тогда Н. Бор. Следствием этих размышлений стал принцип дополнительности, представленный ученым в 1927 году на научном конгрессе.
Исходным пунктом в эволюции научных взглядов Бора стало в 1926 г. стало принятие им волнового дуализма (ранее он отказывался признавать реальность эйнштейновских квантов света – фотонов, объясняя свою категоричность сложностью согласования с принципом соответствия). Вместе с Дж. Слэтером он создает статью, где делает предположение о несохранении импульса и энергии в микроскопических индивидуальных процессах (законы сохранения принимали статистический характер).
Именно идеи корпускулярно-волнового дуализма были заложены Н. Бором в основу интерпретации квантовой теории. Развитая в 1927 г. идея дополнительности является непосредственным отражением логического соотношения между наборами представлений и двумя способами описания, которые, хотя и взаимоисключают друг друга, все-таки необходимы для исчерпывающего описания состояния вещей.
Принцип дополнительности также был положен в основу так называемой «копенгагенской интерпретации» квантовой механики, анализа процесса измерения и характеристик микроскопических объектов. Согласно указанной интерпретации, динамические характеристики микрочастицы, позаимствованные из классической физики (ее импульс, координата, энергия) вовсе не присущи ей в самостоятельном контексте.
Роль принципа дополнительности оказалась настолько существенной, что Паули в свое время даже предлагал новое название для квантовой механики – назвать ее «теорией дополнительности» по аналогии с теорией относительности.
Квантовые постулаты Бора
Квантовые постулаты Бора – это два основных допущения, введённые Н.Бором для объяснения устойчивости атома и спектральных закономерностей (в рамках модели атома Резерфорда).
Планетарная модель атома Резерфорда позволила объяснить результаты опытов по рассеянию α-частиц вещества, но она не способна объяснить факт существования атома и его устойчивость.
В соответствии с планетарной моделью электроны атома должны двигаться вокруг неподвижного ядра. Двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, электрон должен, как и всякий ускоренно движущийся электрический заряд, излучать электромагнитные волны с частотой, равной частоте обращения электрона вокруг ядра.
Энергия электрона в атоме должна при этом непрерывно уменьшаться за счёт излучения. Сам электрон должен с каждым оборотом приближаться по спирали к ядру и упасть на него под действием электрической силы притяжения. При этом атом потеряет всю электронную оболочку, а также присущие ему физические и химические свойства. Кроме того, атом должен потерять спектр излучения частоты, то есть атом должен давать излучение с непрерывным (сплошным) спектром частот.
Эти результаты, полученные с помощью классической механики и электродинамики, находятся в резком противоречии с опытом, который показывает, что
- Атомы являются весьма устойчивыми системами и в невозбуждённом состоянии могут существовать неограниченно долго, не излучая при этом электромагнитные волны
- Спектр излучения атома является линейчатым (дискретным) – образованным из отдельных линий (от латинского discretus – прерывистый, состоящий из отдельных значений)
Всё это свидетельствует о том, что законы классический физики применить к электронам в атомах нельзя, поэтому необходимы новые представления о механизме излучения и поглощения атомами электромагнитных волн. В основе современной теории атома лежитквантовая механика – теория, устанавливающая способ описания и законы движения микрочастиц (элементарных частиц, атомов, молекул, атомных ядер) и их систем (например, кристаллов), а также связь величин, которые характеризуют частицы и системы, с физическими величинами, измеряемыми опытным путём.
В 1913 году датский физик Нильс Бор (1885 – 1962) ввёл идеи квантовой теории в ядерную модель атома Резерфорда и разработал теорию атома водорода, которая подтвердилась всеми известными тогда опытами. Бор сформулировал в виде постулатов основные положения новой теории, которые налагали лишь некоторые ограничения на допускаемые классической физикой движения. Однако последовательной теории атома Бор не дал. Впоследствии теория Бора была включена как частный случай в квантовую механику. В основе теории Бора лежат два постулата.
Первый постулат Бора: постулат стационарных состояний
Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определённая энергия En . В стационарном состоянии атом не излучает.
Второй постулат Бора: правило частотe
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En . Энергия излученного фотона равна разности энергий стационарных состояний:
Частота излучения равна:
Или, длина волны излучения λ равна:
Где h – постоянная Планка, с – скорость света в вакууме.
Если Ek > En , то происходит излучение фотона, если Ek , то происходит поглощение фотона, при котором атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией. Таким образом, для каждого атома имеется ряд строго определённых дискретных значений энергии, которыми он может обладать. Физические величины, например энергия и импульс, которые могут принимать лишь дискретные (квантовые) значения, носят название квантованные физические величины (квантование физических величин). При этом энергетические уровни атома – это возможные значения энергии атома.
Правило квантования орбит позволяет определить радиусы стационарных орбит:
где n = 1, 2, 3…, m – масса электрона, rn – радиус n-ой орбиты, vn – скорость электрона на этой орбите.
Число n – положительное число, которое называется главное квантовое число.
Величина (mvn)rn – момент импульса электрона.
h’ – это величина, которая равна:
h’ = h/2π = 1,05445887•10 -34 Дж•с
где h – постоянная Планка.
Главное квантовое число указывает номер орбиты, по которой может обращаться электрон.
Свои постулаты Н.Бор применил для построения теории простейшей атомной системы – атома водорода, состоящего из ядра – протона, и одного электрона. Эта теория также применима для водородоподобных ионов, то есть атомов с зарядом ядра Ze и потерявших все электроны, кроме одного (например, Li 2+ , Be 3+ и т.п.). В предположении, что электрон движется по круговой орбите, постулаты Бора позволяют найти радиусы rn стационарных, возможных орбит электрона. На электрон действует кулоновская сила:
Где е – модуль заряда электрона, равный заряду ядра, ε0 = 8,85418782 * 10 -12 Ф/м – электрическая постоянная в единицах СИ.
Кулоновская сила сообщает электрону на орбите центростремительное ускорение:
Согласно второму закону Ньютона:
Используя правило квантования орбит mvnrn = nh’ , можно получить выражения для возможных радиусов орбит. Исключая скорость vn из предыдущего выражения, получим:
rn = 4πε0n 2 h’ / me 2 (так как h’ = h / 2π)
Таким образом, радиусы орбит электрона в атоме водорода прямо пропорциональны квадратам главного квантового числа n .
Наименьший радиус орбит при n = 1 , то есть радиус первой орбиты в атоме водорода равен:
r1 = 4πε0h’ / me 2 = 0,528 * 10 -10 м = 0,528 Å
Радиус первой орбиты в атоме водорода носит название первый Боровский радиус и служит единицей длины в атомной физике.
Полная энергия Е электрона в атоме водорода, согласно механике Ньютона, равна сумме кинетической энергии Еk и потенциальной энергии П взаимодействия электрона с ядром:
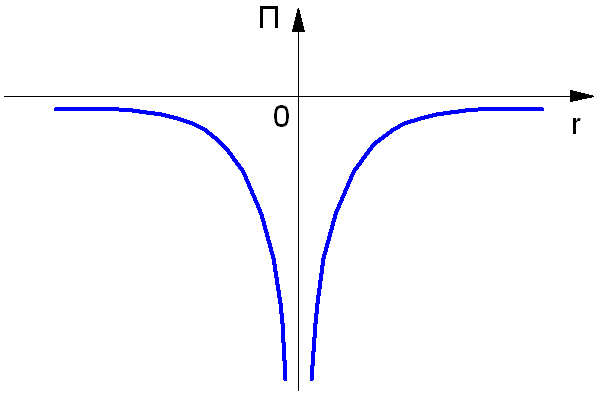
Потенциальная энергия электрона в атоме отрицательна:
Так как нулевой уровень отсчёта берётся на бесконечности (рис. 1.3), а по мере приближения электрона к ядру его потенциальная энергия уменьшается. Взаимодействующие частицы – ядро и электрон – имеют заряды противоположных знаков.
Рис. 1.3. Потенциальная энергия электрона в атоме.
Подставляя значение скорости
в выражение полной энергии, получим:
Подставляя в эту формулу выражение для радиусов орбит, получим энергетические уровни электрона в атоме водорода (значения энергий стационарных состояний атома):
En = -(1 /(4πε0) 2 ) me 4 / 2h’ 2 n 2 = — (me 4 / 8h 2 ε0 2 ) * (1 / n 2 ), n = 1,2,3…
Энергия Еn электрона в атоме водорода зависит от главного квантового числа n , которое определяет энергетические уровни электрона в атоме водорода.
Основное энергетическое состояние атома (нормальное состояние атома) – это энергетический уровень при n = 1 .
Значение энергии, соответствующее первому (низшему) энергетическому уровню в атоме водорода равно:
E1 = -(1 /(4πε0) 2 ) me 4 / 2h’ 2 λ = -2,485 * 10 -19 Дж = -13,53 эВ
В этом состоянии атом может находиться сколько угодно долго. Для того чтобы ионизировать атом водорода, ему нужно сообщить энергию 13,53 эВ, которая называется энергия ионизации.
Энергетические уровни при n > 1 – это возбуждённые энергетические состояния (возбуждённые состояния атома). Возбуждённое состояние атома является менее устойчивым, чем основное состояние. Время жизни атома в этом состоянии имеет порядок 10 -8 секунд. За это время электрон успевает совершить около ста миллионов оборотов вокруг ядра.
При переходе электрона с удалённой от ядра стационарной k -орбиты на ближайшую n -ую орбиту атом излучает фотон, энергия которого hvnk согласно второму постулату Бора определяется:
hvkn = Ek — En = -(1 / (4πε0) 2 ) * (me 4 / 2h’ 2 ) * [(1 / n 2 ) — (1 / k 2 )] = (me 4 / 8h 2 ε0 2 ) * [(1 / n 2 ) — (1 / k 2 )]
Частота излучения атома водорода:
vkn = (1 / (4πε0) 2 ) * (me 4 / h’ 3 ) * [(1 / n 2 ) — (1 / k 2 )] = R[(1 / n 2 ) — (1 / k 2 )]
R = (me 4 / (4πε0) 2 ) * 4πh’ 3 ) = (me 4 / 8h 3 ε0 2 ) = 3,288 * 10 15 c -1 — постоянная Ридберга
Постоянная Ридберга определяется через постоянную Планка, массу и заряд электрона.
Длина волны излучения определяется соотношением:
1 / λnk = vnk / c = (me 4 / 8ε0 2 h 3 c) * [(1 / n 2 ) — (1 / k 2 )] = Rc[(1 / n 2 ) — (1 / k 2 )]
Rc = R / c = 1,0974 * 10 7 м -1 — также постоянная Ридберга
с = 3*10 8 м/с – скорость света в вакууме.
Теоретическое значение R совпадает с экспериментальным значением, полученным из спектроскопических измерений.
Энергия обычно измеряется в электронвольтах (эВ). Электронвольт– это значение энергии, которую приобретает электрон, пройдя ускоряющую разность потенциалов в 1 В:
1 эВ = 1,6 * 10 -19 Кл * 1В = 1,6 * 10 -19 Дж
Уравнение бора в квантовой механике
Исходя из представлений классической физики и дополнив ее квантовыми постулатами, Н. Бор создал модель атома, в которой электроны находились в определенных стационарных состояниях, что позволило объяснить устойчивость системы и дискретный характер атомных спектров. Опыты Франка-Герца подтвердили правильность модели Бора.
Однако непоследовательность теории, в которую квантованность состояний была введена искусственно, привела к необходимости разработки более рационального подхода к описанию квантовых явлений. Гипотеза де Бройля позволила создать аппарат волновой механики, в котором вероятностный характер квантовых явлений описывается с помощью волновых функций. Квадрат волновой функции определяет вероятность обнаружения частицы в элементе объема пространства dV. Волновая функция и квантовые операторы – аналоги физических величин в классической физике, описывают состояния частиц квантового мира.
Поведение системы квантовых частиц существенно отличается от классических закономерностей. Статистики Ферми-Дирака и Бозе-Эйнштейна позволяет объяснить структуру атомов и атомных ядер, парные корреляции в атомной и ядерной среде.
3.1. Модель Бора атома водорода
В модели Э. Резерфорда в центре атома расположено положительно заряженное массивное ядро размером R ≈ 10 -12 см. Н. Бор предложил модель, которая впервые позволила удовлетворительно объяснить закономерность строения атома водорода.
Основные постулаты теории Бора:
- Электрон равномерно вращается вокруг атомного ядра по круговой орбите под действием кулоновских сил в соответствии с законами Ньютона.
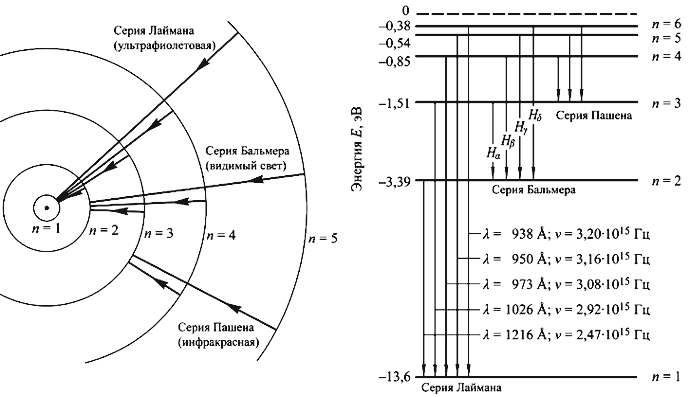
Рис. 3.1. Орбиты модели атома Бора. Схема уровней атома водорода.
- Разрешенными орбитами электрона являются только те, для которых момент импульса электрона равен nћ, где n – целое число.
- При движении электрона по стационарной орбите атом не излучает энергию.
- При переходе с орбиты с энергии Ei на другую орбиту с энергией Ef (Ei > Ef) излучается фотон, имеющий энергию hν = (Ei − Ef).
Движение по круговой орбите. Частота обращения ν:
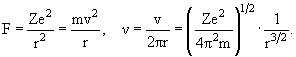 | (3.1) |
Условие стационарной орбиты. Квантование углового момента:
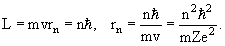 | (3.2) |
Боровский радиус атома водорода (n = 1, Z = 1) r0 = ћ 2 /me 2 = 0.529 Å
Полная энергия электрона E квантуется:
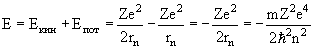 | (3.3) |
Если электрон находится на 1-ой боровской орбите, то атом водорода находится в основном состоянии E0 = −me 4 /2ћ 2 = −13.6 эВ.
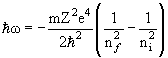 | (3.4) |
Постоянная Ридберга
3.2. Рентгеновские спектры. Закон Мозли
В химических элементах электроны распределяются по электронным орбитам в соответствии с принципом Паули. Если из атома с орбиты n = 1 выбивается электрон, то вакансия заполняется электронами с более высоких орбит с n = 2, 3 и т. д. Разность энергий этих орбит излучается в виде фотонов, длина волны которых при больших Z будет находиться в рентгеновском диапазоне.
Закон Мозли. Согласно теории Н. Бора, энергия электрона на боровской орбите пропорциональна квадрату заряда ядра
Г. Мозли предположил, что энергия и, следовательно, частота характеристического излучения должны зависеть от квадрата атомного номера Z химического элемента.
Мозли измерил характеристическое рентгеновское излучение для нескольких десятков химических элементов и показал, что их можно аппроксимировать формулой ν 1/2 = A(Z – b), где ν – частота излучения, а A и b – константы, либо слабо изменяющиеся величины. Для линии Kα эта зависимость имеет вид:
| ν = (3/4)R·2πc(Z – σ) 2 | (3.5) |
где R – постоянная Ридберга, σ – постоянная экранирования, для легких элементов σ ≈ 1.
Исследования Мозли впервые экспериментально показали, что основной величиной, определяющей положение элемента в периодической таблице, является не атомная масса, а атомный номер химического элемента.
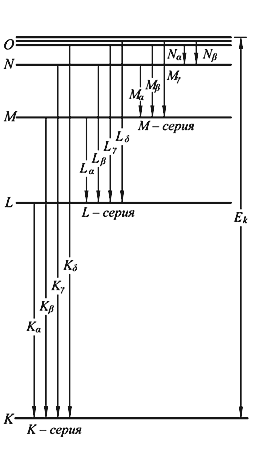 Рис. 3.2 Схема возникновения характеристических рентгеновских спектров. | 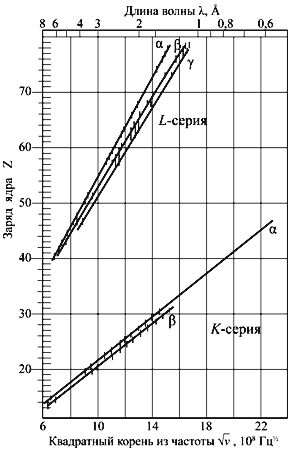 Рис. 3.3 График Мозли. Зависимость частоты рентгеновского излучения Kи L-серий от атомного номера химического элемента. |
3.3. Эксперименты Франка-Герца
Эксперименты Франка-Герца подтвердили предположение Бора о том, что спектры атомов объясняются наличием дискретных энергетических уровней, которые могут возбуждаться в результате рассеяния электронов на атоме.
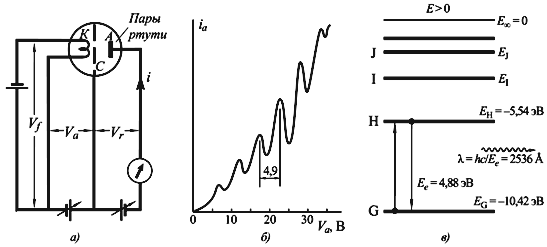
Энергии связи внешних электронов в тяжелых атомах составляют несколько эВ. На рис. 3.4 в показаны уровни энергии валентных электронов атома ртути. Энергия электронов основного состояния E0 = −10.42эВ. Энергия первого возбужденного состояния Eh = −5.54 эВ. Энергия перехода между этими состояниями
Если энергия пучка медленных электронов, проходящего через пары ртути, меньше 4.88 эВ, то столкновения электронов пучка с атомами ртути будут упругими, т.е. без передачи энергии. Если энергия пучка электронов превышает 4.88 эВ, то происходят неупругие столкновения с передачей части энергии электрону атома ртути, сопровождающиеся переходами электронов атома ртути в первое возбужденное состояние. Поэтому в зависимости анодного тока от ускоряющего потенциала будут наблюдаться характерные максимумы и минимумы, соответствующие дискретным уровням энергии, на которых находятся внешние электроны атома ртути.
Рис. 3.4 Опыт Франка-Герца. а) Схема экспериментальной установки. В баллоне с парами ртути имелись три электрода: К – катод, А – анод и С – сетка. Ускоряющая разность потенциалов Vaприкладывалась между катодом и сеткой, между сеткой и анодом создавалось тормозящее поле с
Vr = 0.5 В. б) Полученная зависимость анодного тока от Va. Интервал между максимумами составляет 4.9 В. в) Схема энергетических уровней ртути.
3.4. Состояния в классической и квантовой физике
Теория атома Н. Бора правильно описала переходы в атоме водорода. Значение радиуса первой боровской орбиты хорошо согласовывалось экспериментальными оценками размера атома водорода. Однако она не могла объяснить относительную интенсивность спектральных линий, а также структуру оптических спектров более сложных атомов. В своей теории Бор правильно предугадал основные особенности квантового строения атомов. Дальнейшее развитие квантовой физики показало, что описание состояний системы в классической и квантовой физике различны. Квантовые понятия отражают фактическую смену представлений о структуре материи, о свойствах ее фундаментальных составляющих. Поиски ответов на эти проблемы привели к новому пониманию природы материи и становлению квантовой физики.
Сопоставление способов описания частицы в классической и квантовой физике приведено в таблице.
Классическая физика
Квантовая физика
 (x,y,z)
(x,y,z) =
= H/
H/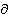 p,
p, 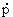 = —
= —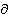 H/
H/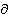 t,
t,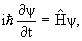
 х
х px
px
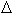
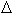
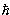
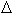
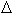
(не статистическое) описание
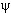 (x,y,z)| 2
(x,y,z)| 2 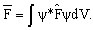
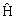 =
= 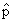 2 /2m + U(r)
2 /2m + U(r)3.5. Волновая функция
Состояние частицы в классической физике в любой момент времени описывается заданием ее координат и импульсов (x, y, z, px,py,pz). Зная эти величины в момент времени t, можно описать эволюцию системы под действием известных сил во все последующие и предыдущие моменты времени. Координаты и импульсы частиц в классической физике являются непосредственно измеряемыми величинам или наблюдаемыми.
В квантовой физике изменяется понятие состояния. Наличие у квантовой частицы волновых свойств показывает, что ей следует сопоставить некоторое волновое поле. Амплитуду этого волнового поля, зависящую от координат и времени, называют волновой функцией ψ(x,y,z,t). Волновая функция не является непосредственно наблюдаемой величиной. Наблюдаемой величиной является квадрат модуля волновой функции. В заданном состоянии с волновой функцией ψ(x,y,z,t) можно говорить только о вероятностном распределении значений наблюдаемых. Например, вероятность wнахождения частицы в данной точке x, y, z в момент времени tопределяется квадратом модуля волновой функции
|ψ(x, y, z, t)| 2 .
В силу теории сложения вероятностей определение волновой функции необходимо дополнить условием нормировки
где интеграл, взятый по всему бесконечному пространству, − вероятность достоверно обнаружить частицу в момент времени t во всем пространстве. Возникает своеобразное двухступенчатое описание физических объектов: сначала нужно найти волновую функцию, а затем, уже по ней, определить значения наблюдаемых. В квантовой теории не все наблюдаемые одновременно могут иметь точно определенные значения. Например, квантовая частица не может иметь одновременно определенные значения импульса и координаты.
3.6. Уравнение движения свободной частицы
Волновая функция свободно движущейся частицы с энергией E и импульсом p имеет вид
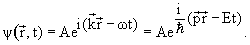 | (3.7) |
Константа A определяется из условия нормировки волновой функции
В тех случаях, когда частица находится в области пространства, где действующие на нее силы равны нулю (свободное движение), энергия частицы может принимать любые значения. Энергетический спектр свободно движущейся частицы непрерывный.
Дифференциальное уравнение, которому удовлетворяет волновая функция свободно движущейся частицы, можно установить, дифференцируя волновую функцию ψ(r,t) по tи по переменным x, y, z:
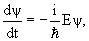 | (3.8) |
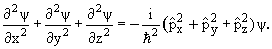 | (3.9) |
Для свободной частицы
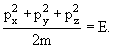 | (3.10) |
Из соотношений (3.8) и (3.9) с учетом (3.10) следует дифференциальное уравнение для волновой функции свободно движущейся частицы
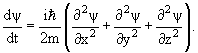 | (3.11) |
Обычно (3.11) записывается в виде
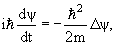 | (3.12) |
где Δ − оператор Лапласа. Уравнение (3.12) в частных производных называется уравнением движения для свободной частицы. В уравнение движения (3.12) входит только такая характеристика как масса частицы и постоянная Планка ћ. Уравнение (3.12) является дифференциальным уравнением первого порядка по времени. Поэтому для определения волновой функции в произвольный момент времени t достаточно знать значение волновую функцию в начальный момент времени.
3.7. Физические величины и операторы
В квантовой механике постулируется, что каждой физической величине, описываемой в классической механике в виде функции F(x,y,z,px,py,pz) координат и импульсов ставится в соответствие линейный оператор 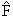
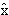
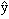
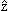



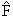
χ(x,y,z,t) = 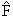
Например, оператор 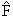
χ(x,y,z,t) = 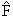
т. е. 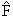
Оператор координаты 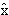
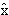
Операторами проекций импульсов являются операторы
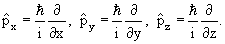 | (3.13) |
Для того, чтобы понять почему оператор импульса имеет вид (3.13), воспользуемся тем, что движение свободной частицы описывается уравнением
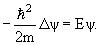 | (3.14) |
Оператор кинетической энергии 



поэтому операторы 


Остальные операторы могут быть построены с использованием операторов координаты и импульса согласно простому правилу: в квантовой механике операторы физических величин выражаются друг через друга так же, как сами физические величины в классической физике.
Оператор кинетической энергии 
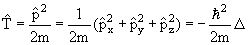 | (3.15) |
Оператор Гамильтона (гамильтониан) − оператор полной энергии 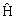
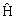


Если частица движется в потенциальном поле U (x, y, z), то оператор Гамильтона 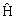
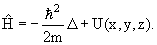 | (3.16) |
Оператор момента количества движения 
Согласно классической механике момент импульса 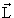

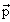
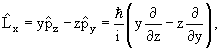 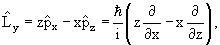 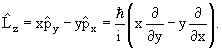 | (3.17) |
Оператор квадрата момента количества движения 
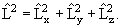 | (3.18) |
Гамильтониан
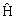


Частица в одномерной потенциальной яме U(x):
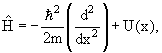
3.8. Собственные значения и собственные функции операторов
С каждым оператором 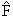
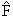 ψn(x) = Fψn(x), ψn(x) = Fψn(x), | (3.19) |
определяющее его собственные значения Fnи полную систему ортонормированных функций ψn, подчиняющихся определенным граничным условиям. Величины Fn определяют спектр возможных значений физической величины F. Функция ψn(x) характеризует состояние системы, в котором величина F имеет значение Fn. Одно из важнейших положений квантовой теории: в квантовых системах выполняется принцип суперпозиции. Если квантовая система может находиться в состояниях, описываемых функциями ψ1, ψ2, …, ψn, то линейная комбинация (суперпозиция) волновых функций ψ1, ψ2, …, ψn
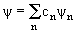 | (3.20) |
также является волновой функцией, описывающей одно из возможных состояний системы, cn – произвольные постоянные.
Квантовая механика является принципиально статистической теорией. Её предсказания носят вероятностный характер. Можно с любой точностью предсказать вероятность найти электрон в произвольной части атома водорода, но нельзя предсказать, в какие моменты времени он попадает в эту часть атома.
Различие между классической статистической теорией и квантовой механикой состоит в следующем. В классической статистической теории предполагается, что в принципе можно проследить за судьбой, например, всех молекул газа и точно рассчитать их траектории. Но, так как молекул много, то для расчета макроскопических величин нам достаточно знать не все точные величины, описывающие каждую молекулу, а небольшое количество усредненных характеристик системы. Например, для описания газа, заключенного в сосуде, вводят такие усредненные характеристики как давление и температура. Для отдельной молекулы газа совершенно бессмысленно говорить о её температуре. В противоположность этому в квантовом мире статистические свойства не вторичны, а первичны. Статистический характер процессов в микромире проявляется в том, что результат измерений в микромире имеет статистическую природу.
Среднее значение физической величины А в состоянии ψ определяется из соотношения
где dV = dx dy dz. В частности, средние значения координаты 
= ∫ ψ* ψdV, ψdV, 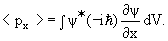 | (3.22) |
Средние значения и
имеют следующий смысл. Если многократно измерять координату 
.
Уравнения для собственных функций и собственных значений операторов 


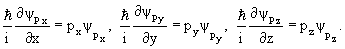 | (3.23) |
Решением уравнений будут волновые функции
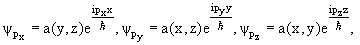 | (3.24) |
где a(y,z), a(x,z), a(x,y) – произвольные функции соответствующих координат (y,z), (x,z), (x,y).
Оператор импульса имеет сплошной спектр собственных значений. Волновая функция
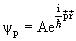 | (3.25) |
является собственной функцией операторов 


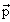
Постоянная A находится из условия нормировки волновой функции:
Волновая функция ψp с учетом нормировки имеет вид.
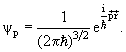 | (3.26) |
3.9. Коммутация операторов
Одним из важных вопросов в квантовой физике является вопрос о том, какие физические величины могут одновременно иметь определённые значения. Для того чтобы две величины F и R могли бы иметь определенные значения в некотором состоянии, описываемом волновой функцией ψn, эта волновая функция, очевидно, должна быть собственной функцией операторов 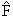
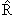
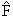
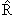
Это имеет место только в том случае, когда операторы 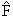
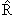
[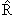 , ,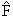 ] = ] = 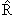 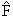 − − 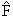 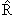 = 0. = 0. | (3.27) |
Таким образом, если квантовомеханические операторы, соответствующие двум квантовомеханическим величинам, коммутируют, то эти величины могут быть измерены одновременно. Если же операторы не коммутируют, то это величины одновременно не могут иметь определенных значений. Операторы координат и проекции импульса на различные оси коммутируют между собой. Например,


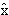
т. е. величины x и py одновременно измеримы.
В то же время операторы 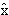



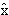
Поэтому соответствующие им величины xи pxне имеют одновременно определенных значений.
Проекции момента количества движения Lx, Ly, Lz одновременно не могут иметь определенные значения. Исключением является состояние, когда момент количества движения L= 0 , при этом
Lx = Ly = Lz = 0. В то же время операторы проекции момента количества движения 















т. е. квадрат полного момента количества движения и одна из его проекций на произвольную ось могут одновременно иметь определенные значения.
3.10. Статистики Ферми-Дирака и Бозе-Эйнштейна
Микрочастицы обладают своеобразной характеристикой, называемой статистикой. Статистика является проявлением коллективных свойств системы частиц. Существование статистики является следствием принципа неразличимости одинаковых микрочастиц и вероятностного характера описания состояний в квантовой теории.
Рассмотрим волновую функцию системы частиц одного сорта, например, системы электронов или протонов. В таких системах проявляются новые особенности, которые не имеют аналогов в системе классических одинаковых частиц. В микромире частицы одного типа неразличимы, т. е. имеет место принцип тождественности частиц . Перестановка двух одинаковых частиц не изменяет состояния системы.
Принцип тождественности частиц
Гамильтониан системы частиц инвариантен относительно перестановки всех координат двух любых частиц одного типа.
Поэтому должна быть квантовая характеристика (квантовое число) и сохраняющаяся физическая величина, отвечающая этому преобразованию.
Оператор перестановки (например, частиц 1 и 2 в системе А тождественных частиц) 
 12ψ(1,2. A) = ψ(2,1. A) = εψ(1,2. A), 12ψ(1,2. A) = ψ(2,1. A) = εψ(1,2. A), 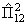 ψ(1,2. A) = ε 2 ψ(2,1. A) = ψ(1,2. A). ψ(1,2. A) = ε 2 ψ(2,1. A) = ψ(1,2. A). | (3.28) |
Поэтому ε 2 =1 и ε = ±1.
При e = +1 
волновая функция системы частиц симметрична:
ψ(2,1. A) = ψ(1,2. A).
При e = −1 
волновая функция системы частиц антисимметрична:
ψ(2,1. A) = −ψ(1,2. A).
В релятивистской квантовой теории поля доказывается, что статистика однозначно определяется спином частицы. Частицы с целым (в том числе с нулевым) спином называются бозонами и подчиняются статистике Бозе-Эйнштейна (γ‑кванты, π-мезоны, α-частицы и др.). Частицы с полуцелым спином называются фермионами и подчиняются статистике Ферми-Дирака (электроны, кварки, нейтрино, протоны, нейтроны, ядра с нечётным числом нуклонов и т.д.).
| Фермионы | Бозоны |
|---|---|
| электрон, мюон, нейтрино, протон, нейтрон и др. | фотон, π-мезоны, K-мезоны и др |
| Вероятность ƒ(E) обнаружить частицу в состоянии с энергией Eпри температуре среды T | |
| Распределение Больцмана | 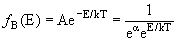 |
| Распределение Бозе-Эйнштейна | 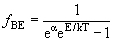 |
| Распределение Ферми-Дирака | 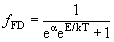 |
| Величина e α представляет собой постоянную нормировки, зависящую от плотности частиц | |
3.11. Принцип Паули для тождественных фермионов.
Для системы тождественных фермионов
Пусть частицы 1 и 2 находятся в одинаковом состоянии. Тогда ψ(2,1. A) и ψ(1,2. A) одна и та же функция и ψ = -ψ, 2ψ = 0, ψ = 0, т. е. такого состояния нет. Таким образом, в системах, подчиняющихся статистике Ферми-Дирака и описываемых антисимметричными волновыми функциями, не должно существовать двух тождественных частиц с полностью совпадающими характеристиками. Поясним различие между тремя статистиками – классической, статистикой Ферми-Дирака и статистикой Бозе-Эйнштейна – на простейшем случае, когда имеются две одинаковых частицы и два различных одночастичных состояния. Число возможных состояний такой физической системы будет разным для разных статистик.
В классической статистике возможны четыре состояния:
а) обе частицы в первом состоянии;
б) обе частицы во втором состоянии;
в) первая частица в первом состоянии, вторая – во втором;
г) первая частица во втором состоянии, вторая – в первом.
В статистике Ферми возможно только одно состояние:
одна из частиц (какая именно, здесь и ниже не имеет значения) находится в первом состоянии, другая – во втором.
В статистике Бозе-Эйнштейна возможны три состояния:
а) обе частицы в первом состоянии;
б) обе частицы во втором состоянии;
в) одна из частиц в первом состоянии, другая – во втором.
Структура электронных оболочек в атоме и нуклонных оболочек в ядре объясняется на основе принципа Паули. В атоме два электрона не могут находиться в одинаковом состоянии. Точно так же и в ядре два одинаковых нуклона не могут находиться в одном и том же состоянии. Принципу Паули подчиняются только фермионы.
Задачи
3.1. Вычислите длину волны спектральной линии, которая соответствует переходу между состояниями ni = 4 и nf = 2 в атоме водорода.
3.2. У водородоподобного иона разница длин волн первых линий серий Лаймана и Бальмера составляет 16.58 нм. Какому атому это соответствует?
3.3. Минимальная длина волны излучения рентгеновской трубки на 50 кВ составляет 0.247 Å.
Определите значение постоянной Планка.
3.4. Вычислить разность энергий связи Kи L электронов в атоме алюминия 13 Al.
3.5. Вычислить коммутатор [





3.6. Какую максимальную энергию может иметь фотон, испущенный атомом водорода?
Ответ: Eγ = 13.6 В
3.7. Определить длину волны первых трех линий серий Бальмера, Лаймана, Пашена в атоме водорода.
3.8. Какому переходу соответствует длина волны линии Бальмера λ = 3791 Å в атоме водорода?
Ответ: Переход 10 → 2
3.9. Какие спектральные линии появятся при возбуждении атомарного водорода электронами в 12.5 В? Какие линии появятся при энергии электронов в 14 В?
3.10. Мюон образовал мезоатом водорода. Вычислите радиус первой боровской орбиты моюнного атома и сравните с результатом для атома водорода. Каковы длины волн первых трех линий серии Лаймана мезоатома?
Ответ: rμ = ћ 2 /me 2 = 255 Фм; E21 = 2.11 кэВ, E31 = 2.50 кэВ, E41 = 2.64 кэВ.
3.11. Позитроний представляет собой связанную систему электрона и позитрона, вращающихся вокруг центра масс этой системы. Определить боровский радиус и энергетический спектр позитрония. Каковы длины волн первых трех линий серии Лаймана позитрония?
3.12. Энергия связи электрона в атоме гелия He равна E0 = 24.6 эВ. Какая минимальная энергия необходима для последовательного удаления обоих электронов из этого атома?
3.13. Покажите, что скорость электрона v на n-Боровской орбите в атоме водорода равна v/c = α/n, где α – постоянная тонкой структуры.
3.14. Ток, возникающий при движении заряда q по круговой орбите с частотой f, равен i = qf. Магнитный момент μ петли с током равен μ = is, где s – площадь петли. Вычислите ток и магнитный момент, создаваемый электроном на первой боровской орбите.
3.15. Определить магнитный момент мюона, находящегося на первой боровской орбите в мюоном атоме, состоящем из протона и мюона. Сравнить с магнитным моментом электрона, находящимся в атоме водорода на первой боровской орбите.
3.16. Закон Мозли для характеристического рентгеновского излучения имеет следующую форму:
ν 1/2 = A(Z − b). Получите выражение и рассчитайте A для линий Kα.
Ответ: A = 4.9·10 7 с –1/2
3.17. Какова минимальная длина волны излучения, испускаемого рентгеновской трубкой при напряжении 30 кВ?
Ответ: λγ = 4.2·10 4 Фм
3.18. Определите порядковый номер Z легкого элемента, у которого длина волны Kα λ = 0.251 нм.
Ответ: Z = 23
3.19. Длины волн Kα у меди (Z = 29) λCu = 0.1544 нм, у железа (Z = 26) λFe = 0.1935 нм. Исходя из этих данных, определите значения констант A и b в законе Мозли ν 1/2 = A(Z − b).
Ответ: A = 5·10 7 с –1/2 , b = 0.89
3.20. Сколько химических элементов содержится в ряду между химическими элементами, у которых длины волн Kα линии равны 0.1787 нм и 0.1334 нм. Какие это химические элементы?
Ответ: от 27 Co до 30 Zn
3.21. Какие физические величины могут быть одновременно измерены в квантовой физике?
3.22. Вычислить коммутаторы: a) [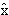



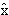
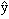







л) [



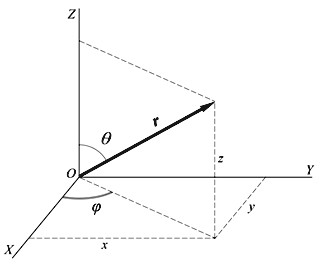 Рис. 3.5.Прямоугольная и сферическая системы координат |
3.23. При решении конкретных физических задач часто приходится иметь дело с полями с центральной симметрией. В таких случаях удобнее использовать сферическую систему координат. Переход от декартовых координат x, y, z к переменным r, θ, φ в операторах также происходит по обычным правилам замены переменных.
x = r sinθ cosφ, y = r sinθ sinφ, z = r cosφ.
Показать, что в сферической системе координат оператор момента количества движения имеет вид:
http://av-mag.ru/physics/index.php/atoms/stroenie/quantum-postulates/
http://nuclphys.sinp.msu.ru/sem2/sem03.html